Stages in the separation of the casenomacropeptide (CMP) liberated by the enzymatic effect of chymosin on k-casein.
Georgina Urbán C*., Norma Pérez F.*, Salvador Vega y León*,
Cristina Fresan O.*,
Julia Pérez R.*, Guadalupe Prado F.*, Magdalena González L.*,
Clementina González C*. y
Acacia Ramírez A*. -
Universidad Autónoma Metropolitana - Xochimilco*
Departamento de Producción Agrícola y Animal - Calzada del Hueso
1100. Col. Quietud,
México D.F., C.P. 04960
Manuel Pinto C.** -
Universidad Austral de Chile **- Facultad de Ciencias Agrarias - Casilla 567
- Valdivia, Chile
1 Convenio Universidad Austral
de Chile (DID-UACh)-Universidad Autónoma Metropolitana-Xochimilco (DPAA).
Recepción originales 15 de julio de 1998.
Separation using electophoresis of the caseinomacropeptide
(PAGE-SDS) liberated by
chymosin over k-casein. Effect of the proteolysis caused by psychrotrophic bacterias.
Key words: Caseinomacropeptides, electrophoresis, whey powder, milk powder, México.
Separation using electrophoresis of the caseinomacropeptide (CMP) liberated
by the action of chymosin on k-casein, found on cheese whey was studied. Whey
powder can be detected in fresh raw milk when doses of over 2% are added.
The proposed methodology does not present any interference with the detection
of the caseinomacropeptide liberated in cheese whey by other peptides generated
by proteolysis of psychothrophic bacterias in cooled milk.
Se estudió por electroforesis (PAGE-SDS), la separación del caseinomacropéptido
(CMP) liberado por la acción de la quimosina sobre la k-caseína,
presente en el suero de quesería. Se encontró que adiciones superiores
al 2% de suero en polvo a leche fresca de rebaños puede ser detectadas.
La metodología propuesta puede ser aplicada igualmente en la detección
de suero en polvo de quesería en leche en polvo, en niveles superiores
al 2 % (m/m).
El método no presenta interferencias en la detección del caseinomacropéptido
liberado en el suero, por otros péptidos generados por proteólisis
de psicrótrofas (Pseudomonas) en leches enfriadas.
Una de las funciones de la k-caseína es estabilizar la dispersión
de las micelas de caseínas en la leche. Durante la primera fase de la
acción enzimática de la quimosina sobre la k-caseína se
produce una proteólisis, rompiéndose el enlace peptídico
Fen105-Met106 generando
dos macromoléculas, la para-K-caseína (1-105), que permanece unida
a las micelas de caseína y un macropéptido soluble (106-169),
el cual permanece en el suero (Wheelock y Knight, 1969).
La acción enzimática sobre la k-caseína puede ser evaluada
estimando la liberación de la para-k-caseína o del caseinomacropéptido
soluble (Koning et al., 1966; Josephson et al.,
1980; Zalazar et al., 1992).
Otros métodos para estudiar la proteólisis de la fase primaria de la acción de la quimosina sobre la k-caseína, se basan en la determinación del ácido N-acetil-neuroamínico (NANA), característico del caseinomacropéptido glicosilado soluble (Warren, 1959; Koning y Rooijen, 1971; Sinkinson y Wheelock, 1970). Esta alternativa fue aceptada por la Comunidad Europea para detectar la presencia de suero en polvo en leche en polvo (C.E., 1981). El suero de quesería en es uno de los subproductos lácteos que importa México. En 1990 entraron al país 20202,7 toneladas con un costo aproximado de 7,7 millones de dólares, cifra que en 1993 subió a 27696 toneladas por un valor aproximado de 13 millones de dólares (SECOFI,1994).
La limitante principal en la determinación del ácido N-acetil-neuramínico, es la posible interferencia causada por lactosa residual (Potgieter, 1985).
El total de los caseinomacropéptidos están presentes en TCA al 2%, mientras que en TCA al 8% de concentración final, las proteínas del suero están virtualmente ausentes y se ha considerado como la concentración óptima del TCA para los análisis por HPLC (Hooydonk y Olieman, 1982).
Una alternativa más sensible y precisa para estimar los macropéptidos solubles en TCA al 8% de concentración final, fue propuesta por Olieman y van den Bedem (1983), utilizando HPLC y una columna de exclusión molecular (SE-HPLC), midiendo la absorbencia a 205 nm. Este método fue adoptado por la Comunidad Europea (CE, 1986), en reemplazo de la determinación del ácido N-acetil-neuramínico, no obstante reconocer la limitante de este método por la presencia de péptidos generados por bacterias sicrófilas en leches enfriadas. Estos péptidos, generados por bacterias proteolíticas, solubles en TCA al 8%, presentan absorbencia igualmente a los 205 nm, y a niveles altos de recuentos de bacterias sicrófilas (> 0,3 x 106 ufc/ ml) puede inducir a resultados falsos positivos (Olieman y van den Bedem, 1983).
La k-caseína se presenta como una proteína heterogénea con dos variantes genéticas, A y B , y cada una con diferentes grados de glicosilación (Walstra y Jennes, (1984), lo cual genera una solubilidad muy variada del caseinomacropéptido en soluciones de TCA.
Olieman y van Riel (1989) investigaron la alternativa de la cromatografía HPLC en la fase reversa (RF - HPLC) y su aplicación a la fracción soluble en TCA al 8%, con resultados similares a lo obtenido por exclusión molecular. Este método elimina las interferencias por péptidos generados por proteólisis de origen microbiano en leches enfriadas, y sólo detecta el macropéptido de la variante genética A que no contiene cadenas glucídicas.
Léonil y Mollé (1991) propusieron un nuevo método cuantitativo, para evaluar el caseinomacropéptido, basado en el análisis cromatográfico de intercambio catiónico FPLC. Al separar la caseína a pH 4,6 evitando el tratamiento previo de la muestra con TCA, se cuantifican los macropéptidos totales, independientes de su grado de glicosilación. Otra alternativa igualmente promisoria es la propuesta por Lieske y Konrad (1996), quienes trataron la fracción soluble de CMP en TCA al 6% con Na2SO4 y estimaron la totalidad de los macropéptidos cuantificando la absorbencia a 217 nm.
A concentraciones más elevadas de TCA se generan precipitaciones crecientes del glicomacropéptido (GMP), dependiendo del grado de glicosilación (Hooydonk y Olieman, 1982; Lieske y Konrad, 1996). La composición aminoacídica del CMP ha sido determinada por distintos autores (Jolles et al., 1966 ; Hill et al., 1970; Pinto et al., 1991).
Lo anterior nos llevó a considerar una alternativa electroforética. cualitativa, para la separación de los caseinomacropéptidos por precipitación, primero de la proteína sérica en TCA al 8% de concentración final, y luego elevando aún más la concentración del TCA en el filtrado, precipitando esta vez los caseinomacropéptidos no glicosilados y aquellos glicomacropéptidos precipitables por su bajo contenido en carbohidratos. Su separación se realiza por electroforesis (PAGE-SDS). También se estudia la posible interferencia de péptidos generados por proteólisis de psicrótrofos, los resultados se presentan a continuación.
1.- Muestras.
Leche entera fresca de rebaños (leche auténtica, La), conservada
con azida sódica al 0,02% (p/v), fue utilizada como control negativo.
Suero de quesería, obtenido por la enzima comercial HALA (Chr. Hansen's
Laboratorium A/S. Copenhagen, Denmark) (> 85% de quimosina) y secado por
proceso de spray, constituyó el control positivo.
Se prepararon mezclas de suero en polvo, con leche entera fresca de rebaños, en los niveles de 1,0; 2,0 y 3,0 % (p/v) de incorporación de suero, con 6 repeticiones.
Muestras de leche en polvo comercializada en la Ciudad de México. Se realizó un muestreo quincenal a 7 plantas elaboradoras de leche en polvo, con 8 repeticiones. Las muestras fueron reconstituidas con agua destilada a 45ºC a un nivel de 10% de sólidos totales.
2.- Preparación de las muestras
La preparación de las muestras se realiza según la metodología
recomendada por Olieman y van den Bedem (1983). A un volumen
de 25 ml de mezcla se le agregó lentamente 12,5 ml de una solución
de TCA 24 % (2:1) bajo agitación constante, la incorporación se
realiza en un tiempo de 1 minuto aproximadamente. Después de permanecer
en reposo durante 90 minutos a temperatura ambiente (25ºC), el precipitado
de caseína y suero-proteinas fue removido por filtración en papel
filtro WHATMAN N° 5. Una alícuota de 15 ml del filtrado (TCA 8%)
fue transferida a un tubo de centrífuga (30 ml), y se trató con
3 ml de una solución de TCA 50 %, permaneció en reposo a baja
temperatura (4-6ºC), por un tiempo mínimo de 120 minutos y posteriormente
centrifugada a 7000 G durante 10 minutos. El material precipitado fue lavado
con una solución de etanol-eter (1:1), seguido de una centrifugación
en condiciones idénticas.
El precipitado es recuperado por resuspensión en solución amortiguadora 0,05 M TRIS-HCL + 1mM EDTA-Na2, pH 7,2.
Las muestras preparadas mediante el procedimiento descrito fueron transferidas a tubos de microensayo, a los cuales se les agregó una solución de sacarosa al 50 % conteniendo 0,002% de azul de bromofenol.
Muestras de suero al 3 % (control positivo) y de leche auténtica (control
negativo) fueron sometidas al mismo procedimiento descrito.
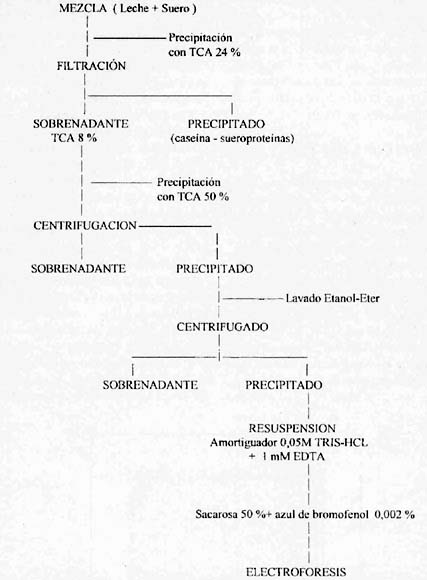
En la figura 1 se muestran las principales etapas de la separación
del caseinomacropéptido para su posterior detección por electroforesis
en gel de poliacrilamida SDS.
 |
|
| Figura 1 | Etapas en la separación del caseinomacropéptido
(CMP), liberado por la acción enzimática de la quimosina sobre
la k-caseína. Stages in the separation of the casenomacropeptide (CMP) liberated by the enzymatic effect of chymosin on k-casein. |
3.- Condiciones del análisis
Todos los reactivos fueron de calidad analítica reconocida.
Se realizó la electroforesis en gel de poliacrilamida SDS-PAGE según
la metodología desarrollada por de Laemmli (1970),
con modificaciones.
a) Composición del gel
Se utilizó una solución al 15 % (p/v) de concentración
de acrilamida y N-N' Metileno bis acrilamida en una relación 37,5:1 sobre
un amortiguador TRIS- HCL 1,5 M pH 8,8, a la cual se le añadió
dodecil hidrógeno sulfato de sodio (SDS) en concentración de 1%.
Para la obtención del gel, la mezcla fue polimerizada con la adición
de persulfato de amonio 0,6% y un porcentaje igual de N-N',N',N'tetrametil-etileno
diamino (TEMED).
b) Electroforesis
La electroforesis continua se realizó en un equipo "Mini Protean
II Slab Cell de la marca BIO-RAD (Bio-Rad Laboratories, California 94547. USA),
con una fuente de poder LKB modelo 2197.
Las placas de corrimiento se elaboraron con separadores de 1,5 mm, utilizando
peinetas de 10 pozos.
Las muestras se cargaron en húmedo depositando 50 ul de cada una. La
corrrida se efectuó a 200 volts con un miliamperaje de 85-100.
Se usó como amortiguador (Tampón) TRIS-Glicina pH 8,3. Se corrió
la electroforesis por 40 minutos.
c) Fijación, teñido y desteñido
Después de terminada la electroforesis, se trataron los geles durante
24 horas en solución fijadora, preparada con 2 propanol (250 ml), ácido
acético glacial (100 ml) y posteriormente diluida en agua (a 1000 ml).
El teñido se efectuó con una solución de azul de Coomassie
(0,3 g), metanol (50 ml), ácido acético glacial (10 ml) y agua
(a 100 ml). La tinción se realizó durante 90 minutos a temperatura
ambiente. A continuación los geles fueron lavados con agua destilada
y se trataron con la solución de desteñido (metanol, ácido
acético glacial, agua 6:1:14) hasta obtener un contraste nítido.
Los geles fueron conservados en ácido acético al 7 %.
4.- Proteólisis bacteriana
Se estudió la proteólisis bacteriana de psicrótrofas en
leche refrigerada para detectar posibles interferencias de los péptidos
resultantes, los cuales podrían proporcionar resultados falsos positivos
respecto a la presencia de suero.
Se utilizó Pseudomona aeruginosa ATCC 27853 para inocular leche recién
pasteurizada, la cual fue mantenida a 6°C por un periodo de 72 horas.
Se efectuó el recuento de psicrótrofas según la norma FEL-IDF:
101 A (1991), y el recuento total de mesófilas en leche no pasteurizada
según la norma FIL-IDF: 100 B (1991).
El grado de proteólisis se determinó mediante el procedimiento de Hull (1947), en los tiempos 0, 24, 48 y 72 horas. A la solución obtenida del filtrado de la muestra se le adicionó el reactivo de fenol preparado según Folin y Ciocalteau (1927), y se cuantífico su transmitancia en un espectrofotómetro [marca Spectronic 21 D (Milton Roy)] ajustado a 650 nm.
Separación de Caseinomacropéptidos. El filtrado obtenido en TCA al 8% de concentración final, para precipitar la totalidad de las proteínas del suero, según lo recomendado por Olieman y van den Bedem (1983), fue sometido a una nueva precipitación con TCA al 15% de concentración final, lo cual permitió precipitar los Caseinomacropéptidos no glicosilados y una fracción no determinada de glicomacropéptidos de bajo contenido en azúcares.
Lieske y Konrad (1996), lograron establecer la disminución de la absorbencia a 217 nm, en los filtrados de macropéptidos, a concentraciones crecientes de TCA, desde el 2% al 12% de concentración final. Al nivel del 12% de TCA registraron una absorbencia, a 217 nm, de alrededor de 0,05, lo cual indica una gran separación por precipitación de los caseinomacropéptidos. Olieman y van den Bedem (1983), observaron que a temperaturas bajas (15°C) se incrementaba la cantidad de glicomacropéptido coprecipitado.
Con el propósito de facilitar la precipitación de los caseinomacropéptidos se optó, en el presente trabajo, por mantener la muestra con TCA al 15% y a la temperatura de 4 a 6°C durante dos horas, para luego centrifugar a 7000 G durante 10 minutos. El precipitado, previo lavado con solución de etanol-éter, fue resuspendido en solución amortiguadora 0,05 M TRIS- HCl + 1mM EDTA- NA2, pH 7,2, para su posterior análisis por electroforesis. Ver figura 1.
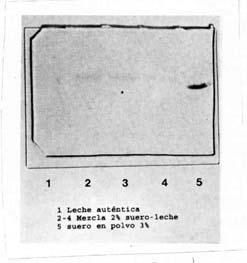
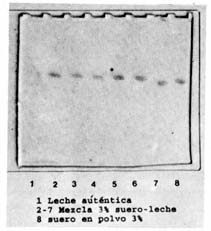
Mezcla leche auténtica-suero en polvo. Los foretogramas de muestras de suero en polvo (Sp), leche auténtica (La), controles positivo y negativo, y mezclas de leche auténtica, adicionada de 2% (3 repeticiones) y 3% (6 repeticiones) de suero en polvo se presentan en las figuras 2 y 3 respectivamente. Se puede apreciar que para cada nivel de suero agregado a la leche, las bandas revelan la aparición de los caseinomacropéptidos (CMP) indicadores de la presencia de suero. Así mismo se observa que en las muestras de leche auténtica no se presenta señal del CMP.
Un ensayo con 6 repeticiones y agregado de suero en polvo a la leche, en niveles del 1, 2 y 3%, se presenta en el cuadro 1. Las pruebas de control positivo (suero en polvo 3%) y control negativo (leche auténtica) fue tratada con tres repeticiones. Al reducir al 1 %, la adición de suero en polvo a la leche auténtica no se observó la banda típica del CMP.
| Cuadro 1. | Mezclas de leche auténtica (La) con adiciones de
suero en polvo (Sp) al 1% (MS1) 2% (MS2)
y 3% (MS3). Mixture of authentic milk (La) with added cheese whey powder (Sp) at 1% (MS1) 2% (MS2) and 3% (MS3). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
MS1 : Mezcla Leche - Suero
en Polvo 1%; MS2: Mezcla Leche - Suero en Polvo 2%
MS3 : Mezcla Leche - Suero en Polvo 3%; Sp: Suero en Polvo (control positivo); La: Leche auténtica (control negativo); (+): Presencia de Caseinomacropéptido (CMP); (-): Ausencia de Caseinomacropéptido (CMP) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|
| Figura 2. | Separación del caseinomacropéptido (CMP)
de mezcla de leche auténtica con 2% (m/v) de suero en polvo agregado
(PAGE-SDS). Separation of the caseinomacropeptide (CMP) from the mixture of authentic milk with 2% of added cheese whey powder (PAGE-SDS) |
 |
|
| Figura 3. | Separación del caseinomacropéptido (CMP)
de mezcla de leche auténtica con 3% (m/v) de suero en polvo agregado
(PAGE-SDS). Separation of the caseinomacropeptide (CMP) from the mixture of authentic milk with 3% of added cheese whey powder (PAGE-SDS). |
Leche en polvo. Un análisis quincenal y durante 4 meses (8 repeticiones) a muestras de leche en polvo comercializadas en la Ciudad de México por siete plantas lecheras, se presenta en el cuadro 2.
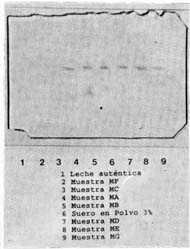
Se puede observar que la metodología propuesta es sensible, para detectar niveles de suero en polvo incorporado a la leche en polvo en niveles desde el 2% (m/m). En algunos casos no se detectó presencia de suero en polvo en las muestras analizadas y en otros fue necesario diluir la muestra (6:1) para obtener bandas normales en el gel de poliacrilamida. En la figura 4 se presenta la repetición N° 1 de los muéstreos quincenales. Se puede observar que las muestras MF y MC no presentan la banda típica del CMP, como fue el caso de las otras muestras analizadas en esta misma repetición.
 |
|
| Figura 4. | Separación del caseinomacropéptido (CMP)
de muestras de leche en polvo comercial. Separation of the caseinomacropeptide (CMP) from comercial powder milk samples. |
| Cuadro 2. |
Presencia de suero en polvo en leche en polvo comerciales. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (+) Positivo (>2% Sp) ; (++) Altamente positivo (Dilución 6:1); (-) Negativo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Proteólisis por psicrótrofas. El crecimiento de las bacterias psicrótrofas (Pseudomona aureoginosa ATCC 27853.) y de las bacterias mesófilas se muestra en el cuadro 3. Se puede observar un crecimiento definido de las psicrótrofas en la leche pasteurizada enfriada (6°C) presentando un recuento inicial de 8,5 x 103 UFC/ml, el cual se elevó a 4,3 x 107 UFC/ml después de 72 horas. El crecimiento de mesófilos, presentó un recuento inicial de 3,8 x 104 el cual incrementó a 4,1 x 105.
La proteólisis realizada por estos microorganismos se muestra en el cuadro 4. La actividad de las proteasas bacterianas queda de manifiesto en un nivel inicial de 36 x 10-3 mg de tirosina por 5 ml de alícuota, el cual se fue incrementando gradualmente hasta un nivel máximo de 70 x 10-3 mg de tirosina por 5 ml de alícuota, según metodología de Hull (1947).
El foretograma obtenido de las muestras de leche inoculadas con Pseudomonas aureoginosa ATCC 27853, se presenta en la figura 5, en la que se puede observar que no existen péptidos que puedan proporcionar falsos positivos en relación a la fracción.del caseinomacropéptidos (CMP) precipitados con TCA al 15%, lo cual concuerda con lo reportado por Pinto et al., 1991.
Olieman y van den Bedem (1983), inocularon Pseudomonas fluorescens 22 F en leche entera termizada la que fue mantenida a 4°C, alcanzando niveles de 3,7 x 106 ufc/ml al cuarto día. Encontraron que con un nivel de 3 x 105 ufc/ml se producen péptidos que pueden llevar a resultados falsos positivos en la metodología por SE-HPLC por ellos recomendada.
| Cuadro 3. | Recuento de baceterias Psicrótrofas (FIL-IDF 101
A: 1991), en leche pasteurizada inoculada con Pseudomona aeruginosa ATCC
27853 y de bacterias mesófilas (FIL-IDF 100 B: 1991). County of Psychrotrophic bacterias (FIL-IDF 101 A: 1991), in pasteurized milk innoculated with Pseudomona aeruginosa ATCC 27853 and with mesophylic bacterias (FIL-IDF 100 B: 1991). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * UCF/ml Unidades Formadoras de Colonias por ml. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cuadro 4. | Acción proteolítica generada por bacterias
Psicotrófas en leche refrigerada. Valores de tirosina liberada. (mg/5ml
de alicuota). Hull (1947). Proteolitic action generated by Psychrotrophic bacterias in refrigerated milk. Values for tyrosin liberated (mg/5ml of aliquot), Hull (1947) |
||||||||||||||||||||||||
|
|||||||||||||||||||||||||
 |
||
| Figura 5. | Separación del caseinomacropéptido (CMP)
de muestras de leche inoculadas con Pseudomonas aeruginosa ATCC 27853.
Tiempo (b) de incubación a 6ºC: 0, (1-2); 24, (3-4); 48, (5-6);
72 (7-8); control suero positivo, (9-10). Separation of the caseinomacropeptide (CMP) from milk samples innoculated with Pseudomonas aeruginosa ATCC 27853. Time (b) of incubation at 6ºC: 0, (1-2); 24, (3-4); 48, (5-6); 72 (7-8); control cheese whey positive, (9-10). |
|
Según los resultados obtenidos se puede concluir:
a) El método propuesto es confiable para separar, por electroforesis (PAGE-SDS), el caseinomacropeptido liberado por acción de quimosina sobre la k-caseína. Esto permite detectar, con carácter cualitativo, la presencia de suero de quesería en leche fresca de rebaños (bronca) y leche en polvo, en niveles superiores al 2% (m/v).
b) El método no presenta interferencias en la detección del caseinomacropeptido liberado en el suero, por otros péptidos generados por proteólisis de psicrótrofas (Pseudomonas) en leches enfriadas.
CE. 1981. Reglamento 2 188/81. Diario Oficial de las Comunidades Europeas L 213/1, 28 de julio de 1981.
CE. 1986. Reglamento 625/78. Diario Oficial de las Comunidades Europeas L 342/11, 5 de diciembre de 1986.
FOLIN, O. y V. CIOCALTEAU. 1927. Tyrosine and tryptophane determination in proteins. J. Biol. Chem. 73: 627-650.
HILL, R..J., M. NAUGHTON y R.G. WAKE. 1970. The mayor genetic variant macropeptides of k-casein. A comparison of their amino-acid contents mid tryptic peptides. Biochim. Biophys. Acta. 200 : 267 - 274.
HOOYDONK, VAN A.C.M. y C. OLIEMAN. 1982. A rapid and sensitive high-performance liquid cromatography method of following the action of chymosin in rnilk. Neth. Milk Dairy J. 36: 153-158.
HULL, M. E. 1947. Studies on milk proteins. II. Colorimetric determination of the partial hydrolisis of the proteins in milk. J. Dairy Sci. 30 (11): 881-885.
INTERNATIONAL DAIRY FEDERATION. 1991. Milk and milks products- Enumeration of microorganisms- Colony count at 30ºC. FIL-IDF 100 B: 1991. Brussels, Belgium. 3 pp.
________________________.1991. Liquid milk - Enumeration of Psychrotrophic microorganisms - Colony count at 6.5ºC. FIL-IDF 101 A: 1991. Brussels, Belgium.3 pp.
JOLLES, R, C. ALAIS y J. JOLLES. 1961. Etude compareé des caseinoglicopeptides formés par action de la présure sur les caséines de vache, de brevis et de chévre. I. Etude de la partie peptidique. Biochim. Biophys. Acta 51: 309 - 314.
JOSEPHSON, R.V., D.J. MOLLOWAY y J. WARTHESEN. 1980. Cheese whey detection in frozen deserts. J.Dairy Sci. 63: 1356-1360.
KONING, P. J. DE., J. ELISSES y M. DE VRIES.1966. A method for the detection of small percentages of whey powder in milk powder. Neth. Milk Dairy J. 20: 203 -212.
KONING, P.J. DE y P.J. VAN ROOIJEN. 1971. Estimation of whey proteins in casein co-precipitate or in mixtures with milk powder by the use of a modifies ninhydrin reaction. Milchwissenschaft 26(1): 1-6.
LAEMMLI, U.K. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature 227 (15): 680-685.
LÉONIL J. y D. MOLLÉ. 1991. A method for determination of macropeptide by cation-exchange fast protein liquid chromatography and its use for following the action of chymosin in milk. Joumal of Dairy Research 58: 321-328.
LIESKE, B y G. KONRAD.1996. A new method to estimate caseinomacropeptide and glycomacropeptide from trichloroacetic acid filtrates. Milchwissenschaft 51 (8): 431- 435.
MÉXICO. SECOFI. SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL. 1994. Estadísticas básicas. Dirección General de Política de Comercio Exterior . México.
OLIEMAN, C. y J.W. VAN DEN BEDEM. 1983. A sensitive HPLC method of detecting and estimating rennet whey total solids in skim milk powder. Neth. Milk Dairy J. 37: 27-36.
OLIEMAN, C. y J.A.M. VAN RIEL. 1989. Detection of rennet whey solids in skim milk powder and buttermilk powder with reversed-phase HPEC. Neth. Milk.Dairy J. 43: 171-184
PINTO C. M., S. CASADINI, C. BRITO, L. H. MOLINA y L.E. ISRAEL. 1991. Detección de sólidos totales de suero de quesería en leche pasteurizada y leche en polvo por electroforesis en gel de poliacrilamida-SDS. Alimentos 3 (16): 23-31.
POTGIETER, C. M. 1985. The detection of added whey powder in milk powder. I. Investigation into the application of the free sialic acid method recommended by the European Economic Community. S. Afr. J. Dairy Technol. 17 (2): 55-58.
SINKINSON, G. y J.V WHEELOCK.1970. Carbohydrates of the glycopeptides released by the action of rennin on whole milk. Biochim et Biophy Acta 215: 517-521.
WALSTRA, P. y R. JENNESS. 1984. En: Dairy Chemistry and Physics, John Wiley and sons, New York.
WARREN, L. 1959. The thiobarbituric acid assay of sialic acid. J. Biol. Chem. 234: 1971.
WHEELOCK, J. V. y D J. KNIGHT. 1969. The action of rennet on wholemilk. J. Dairy Res. (36): 183-190.
ZALAZAR, C.A., C.A. MERIDANE y S. PALMA. 1992, Las adulteraciones de la leche en polvo para consumo humano. Revista Argentina de Lactología. 4 (6): 57-62.