Renate Schöbitz , Marcelo Marín , Mariela
Horzella y Erwin Carrasco.
Instituto de Ciencia y Tecnología de los Alimentos. Facultad de Ciencias Agrarias.
Universidad Austral de Chile, Casilla: 47, Valdivia, Chile.
E - mail: rschobit@mercurio.uach.cl
Recepción de originales 5 de octubre de 2001
Listeria monocytogenes in raw milk and cheese made from unpasteurized milk.
Key words: Listeria monocytogenes, raw milk, cheese unpasteurized
milk.
The objective of the present study was the detection of the human pathogen
Listeria monocytogenes in raw milk received at dairy plants and in fresh
cheese samples made from unpasteurized milk. For this purpose 50 milk samples
were collected from silos of dairy plants located in the VIIIth,
IXth and Xth regions of Chile. Also 25 cheese samples
were purchased from street vendors in the city of Valdivia. For the isolation
of L. monocytogenes, 25 mL or g of the sample was inoculated into a
preenrichment broth, followed by an inoculation on selective media. For the
identification of the Listeria species, biochemical tests were performed
as described in the Bacteriologial Analytical Manual (F.D.A.).
Results of the analysis indicated the presence of L. monocytogenes in
11 raw milk samples (22%). The number of positive samples was higher in the
IXth region as compared to the other two regions, in spite of a lower
number of samples collected. The cheese manufactured in different locations
within the Xth region did not show the presence of the pathogen.
It is concluded that L. monocytogenes is present in a high percentage
of the milk received at different dairy plants. The negative results found
in cheese manufactured from unpasteurized milk could indicate that the bacterium
is present in a lower percentage in milk proceeding from small farmers.
Palabras claves: Listeria monocytogenes leche cruda, queso artesanal.
El presente estudio tuvo dos objetivos, detectar la presencia de la bacteria
patógena Listeria monocytogenes en leche recepcionada en plantas lecheras
y determinar el nivel de contaminación con la bacteria en quesos frescos artesanales.
Para ello, se recolectaron 50 muestras de leche de silos de acopio de plantas
ubicadas en las regiones VIIIª, IXª y Xª del país y 25 muestras de quesos comercializados
en puestos ambulatorios de la ciudad de Valdivia. Para el aislamiento de L.
monocytogenes se trabajó con 25 mL o g de muestra respectivamente, sembrados
primero en un caldo de preenriquecimiento, seguido de una siembra sobre agar
selectivo. La identificación se realizó mediante pruebas bioquímicas para la
diferenciación de especies, según descrito en el Bacteriological Analytical
Manual (F.D.A.).
Los resultados de los análisis de leche arrojaron la presencia de L. monocytogenes
en 11 muestras, equivalente a un 22%. El número de aislamientos fue superior
en la IXª región, pese a recolectarse allí un número más bajo de muestras
(11), en relación a las dos otras regiones (19 y 20 respectivamente). En las
muestras de queso provenientes de diferentes localidades dentro de la Xª región
no se detectó la presencia de la bacteria. Se concluye que L. monocytogenes
se encuentra en un alto porcentaje de las leches recepcionadas en planta.
Los resultados negativos encontrados en queso podrían indicar una menor presencia
del patógeno en las leches de pequeños productores.
La pasteurización de la leche es un efectivo tratamiento térmico para la destrucción
de los microorganismos patógenos. Sin embargo el hábito de consumir leche cruda
y la elaboración de quesos con leches no tratadas, han causado la presentación
de cuadros de enfermedades transmitidas por los alimentos (ETA) a nivel mundial.
Los brotes de ETA hasta la década de los años 70’ eran atribuidos principalmente
a patógenos clásicos tales como Staphylococcus aureus, Salmonella spp.
y Bacillus cereus. Sin embargo, durante los últimos 10 a 15 años se han
aislado además, como agentes responsables los denominados "patógenos emergentes",
que incluyen a bacterias tales como Listeria monocytogenes, Campylobacter
jejuni y Escherichia coli O157 : H7 (Ryser, 1998).
De todos estos microorganismos, L. monocytogenes ha alertado a las autoridades
sanitarias por la gravedad con que se presenta el cuadro de la ETA, que en
un 30% de los casos causan la muerte del individuo y donde en la mayoría de
los casos el alimento involucrado ha sido de origen lácteo (Vivas,
1999). La listeriosis, puede ocurrir en adultos y niños en buen estado de
salud, constituyendo las mujeres embarazadas un grupo de alto riesgo, en las
cuales esta bacteria puede inducir abortos o nacimientos prematuros, que tienen
como secuelas la hidrocefalia y deficiencia mental (Beltrán, et
al., 1991). Otro grupo altamente susceptible son las personas inmunocomprometidas
y de la tercera edad (Scott y Bernard, 1999).
El patógeno tiene como característica su capacidad para desarrollarse a temperaturas
de refrigeración, en presencia de altas concentraciones de cloruro de sodio.
Presenta además, mayor resistencia térmica en comparación a otras bacterias
patógenas no esporuladas (Vivas, 1999). Su resistencia a altas
temperaturas, llevó a considerar la necesidad de aumentar los estándares de
pasteurización de la leche. Ello debido a un brote de listeriosis ocurrido en
EE.UU. de N.A. en 1983, asociado al consumo de leche pasteurizada (Fleming
et al., 1985). Sin embargo, numerosos estudios posteriores demostraron que
la pasteurización a 72 °C durante 15 o más segundos, son suficientes para destruir
el bajo número de células de L. monocytogenes habitualmente presentes
en leche cruda. El aislamiento de la bacteria en productos lácteos pasteurizados
obedecería por lo tanto a un proceso deficiente o a una recontaminación post
tratamiento térmico
(Bradshaw et al., 1885, Farber et al., 1988,
Fedio y Jackson, 1989).
Entre los factores que contribuyen a la resistencia térmica de L. monocytogenes
están, un sistema de proteínas que se activa frente al shock térmico, al ser
expuesta la bacteria a temperaturas subletales previo al tratamiento térmico
(Fedio y Jackson, 1989, Farber et al., 1992).
Este aspecto debería tenerse en cuenta al utilizar la termización como mecanismo
para destruir bacterias saprófitas, previo a la pasteurización. Se ha encontrado
también que L. monocytogenes presenta mayor resistencia a las altas temperaturas,
mientras mayor sea su permanencia en la leche cruda bajo condiciones de refrigeración
(Pitt et al., 1999 (b)). Otro factor importante es el contenido
graso del alimento, observándose mayor resistencia térmica al encontrarse el
patógeno en crema y leche entera (Doyle et al., 2001).
Existe cierto concenso en cuanto a que L. monocyogenes no podrá ser
eliminada completamente del ambiente en un industria de alimentos, o de los
alimentos procesados ( Pitt et al., 1999 (a)). Es por ello
que países como Canadá y naciones de la Unión Europea han establecido como máximo
límite de tolerancia 100 ufc/g, para alimentos sin tratamiento térmico previo
al consumo, en los cuales la bacteria no pueda multiplicarse. Las autoridades
sanitarias de EE.UU. de N.A. en cambio, han impuesto un límite de tolerancia
cero para el patógeno en todos los alimentos (Pitt et al., 1999
(a), Scott y Bernard, 1999). En Chile, la reglamentación sanitaria
(Chile, 1998) no incluye la detección o el recuento de esta
bacteria en alimentos sin embargo, industrias exportadoras de alimentos, como
las plantas procesadoras de salmones y algunas industrias lácteas están haciendo
el análisis para satisfacer los requerimientos de exportación.
Como un aporte al conocimiento del nivel de contaminación con L. monocytogenes
de la leche cruda procesada a nivel industrial, el presente estudio tuvo como
objetivo determinar la presencia de L. monocytogenes en muestras de leche
recepcionada en diferentes plantas del centro - sur del país. Además se determinó
el grado de contaminación con L. monocytogenes en muestras de quesos
frescos artesanales elaborados a partir de leche cruda, comercializados en
forma ambulatoria.
Para el presente estudio se analizaron 50 muestras de leche cruda proveniente
de silos de acopio de plantas lecheras ubicadas en las regiones VIIIª, IXª y
Xª 1). Las muestras fueron enviadas al Laboratorio de Microbiología
del Instituto de Ciencia y Tecnología de los Alimentos (ICYTAL) conservadas
a una temperatura de 6 - 10 °C y analizadas dentro de 48 Hrs. También se analizaron
25 muestras de queso fresco artesanal, comercializado en puestos de venta ambulantes
en la ciudad de Valdivia, provenientes de diferentes localidades de la Xª región.
La metodología de análisis utilizada para las muestras de leche y queso fue
la descrita en el Bacteriological Analytical Manual por Hitchins
(1995). Se trabajó con muestras de 25 mL de leche y 25 g de queso respectivamente.
Para el aislamiento de L. monocytogenes se utilizó agar OXA (Oxford agar,
Oxoid) y agar LPM ( (Difco). A este último se le adicionó esculina y citrato
de amonio férrico en iguales proporciones a las del agar OXA, para facilitar
la visualización de colonias sospechosas. Para la identificación de colonias
sospechosas, se repicaron un mínimo de cinco, en placas de agar soja tripticasa
con extracto de levadura (0,6%) (Difco). A partir de estos cultivos puros se
realizaron las pruebas diferenciales para la identificación del género Listeria
y de las especies correspondientes: tinción de Gram, reacción de catalasa, motilidad
en fresco, hemólisis de sangre de cordero, hemólisis mediante el test de CAMP,
reducción de nitrato y las pruebas de fermentación de los azúcares manitol,
xilosa y ramnosa (Hitchins, 1995).
Cuadro 1: Distribución porcentual de las muestras de leche cruda según procedencia.
Table 1: Distribution of raw milk samples according to their origin.
REGIÓN OCTAVA NOVENA DÉCIMA TOTAL
1 Muestras recolectadas para el proyecto Fondecyt 1961046
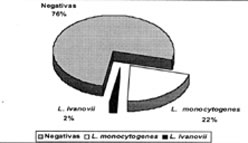
En el Cuadro 1 se presenta la distribución de muestras de leche obtenidas por regiones y se observa que éstas se recolectaron en números similares en las regiones VIIIª y Xª, siendo inferior la cantidad para la IXª región. Los resultados de los análisis bacteriológicos indicaron que, de las 50 muestras de leche cruda, 11 (un 22%) fueron positivas a la presencia de L. monocytogenes y en una (un 2%), se aisló L. ivanovii , sin detectarse otras especies del género Listeria (Figura 1). La frecuencia de presentación de L. monocytogenes encontrada fue superior a la de países europeos, donde se ha aislado a L. monocytogenes en un porcentaje que varía entre 0% y 6,0 %, con excepción de España, país en el cual se ha encontrado la bacteria en leche cruda en un rango que varía entre un 3,6% (Gaya et al., 1998) y un 45% (Pitt et al., 1999 (a)). En Canadá y EE.UU. de N.A. las cifras de detección son similares a los países europeos y varían entre un 0% y 12% (Hayes et al., 1986, Steele et al., 1997, Pitt et al., 1999 (a)). En Méjico Luisjuan-Morales et al.(1995) en cambio, no aislaron L. monocytogenes a partir de leche cruda, identificando sin embargo otras especies del mismo género.

| Figura 1: proporción demuestras positivas a Listeria
monocytogenes y Listeria ivanovii en el total de leches analizadas. Figure 2: Percentage of raw milk samples positive to Listeria monocytogenes and Listeria ivanovii. |
La detección de L. monocytogenes en leche cruda constituye un peligro potencial para el consumidor. Su presencia demuestra la ubicuidad del patógeno y su capacidad para multiplicarse a bajas temperaturas. La contaminación de la leche puede originarse a través de la alimentación de las vacas con ensilaje de mala calidad, en el cual la bacteria se multiplicó durante la maduración. También puede originarse a través de vacas con mastitis subclínica, o por presencia del patógeno en el ambiente del lugar de ordeño o sobre las superficies de los estanques de recepción de leche en la planta lechera, entre otros factores (Fenlon et al., 1989, Perry y Donnelly, 1990, Peeler y Bunning, 1994). Existe además entre la población humana, hasta un 10 % de individuos portadores asintomáticos de L. monocytogenes, especialmente en aquellas personas relacionadas al rubro ganadero, lo cual aumenta las fuentes potenciales de contaminación de la leche (Kerr y Lacey, 1992). La mayor proporción de muestras positivas a L. monocytogenes encontradas en la IXª región (Figura 2), podría deberse a uno o más de los factores citados anteriormente. Mediante un estudio epidemiológico y un mayor número de muestras podrían conocerse las causas por las cuales se aisló en mayor número la bacteria en esa región. No existe claridad aún sobre el número de células necesarias para la presentación del cuadro. Sin embargo, por tratarse en este caso de un alimento consumido por grupos de riesgo de la población, su presencia debería reducirse al máximo en la leche cruda. El tratamiento térmico deficiente de la leche, favorecerá la sobrevivencia de L. monocytogenes y llevará a la contaminación de los productos lácteos que con ella se elaboren.
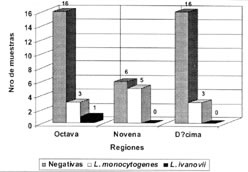 |
Figura 2: Distribución
regional de muestras con presencia de Listeria monocytogenes en el
total de leches analizadas. Figure 2: Regional distribution of milk samples positive to Listeria monocytogenes. |
Según lo señalado por Fenlon et al. (1989), no existe relación
entre la calidad higiénica de la leche y la presencia en ella de L. monocytogenes,
detectándose también el patógeno en leche con bajos recuentos bacterianos. Ello
quedó de manifiesto por los brotes de listeriosis ocurridos a mediados de los
años 80’ en Suiza (Bachmann y Spahr, 1995), donde los alimentos
involucrados correspondieron a quesos blandos tipo Camembert y Brie, elaborados
a partir de leche cruda. En estos quesos el pH llega a valores superiores a
pH 6,5 durante la maduración lo cual favorece el rápido desarrollo de L.
monocytogenes (Fenlon y Wilson, 1989, Spahr
y Url, 1994).
En el presente estudio no se detectó la presencia de la bacteria en quesos frescos
cuyo pH, en el momento del análisis alcanzaba, valores entre 4,8 y 5,3 (datos
no presentados), habiendo transcurrido entre 7 y 15 días desde su elaboración
(Cuadro 2). Según Spahr y Url (1994) y Bachmann
y Spahr (1995), la rápida acidificación de la masa del queso por producción
de ácido láctico es el principal factor responsable de la inhibición o destrucción
de microorganismos patógenos. L. monocytogenes tiene la capacidad
de multiplicarse a valores de pH cercanos a 6,0 y resistir hasta un pH de
5,0 o más bajo (Buchanan et al., 1989, Spahr
y Url,1994), por lo tanto al no ser detectada en muestras de queso con un
pH cercano a 5,0, la bacteria podría haber sobrevivivido, sin multiplicarse
y por lo tanto no ser aislada durante los análisis de queso. Los resultados
negativos encontrados en este trabajo podrían también estar indicando un bajo
nivel de contaminación inicial de la leche utilizada para la elaboración de
los quesos, por tratarse en este caso de pequeños productores, cuyas vacas no
son sometidas al mismo manejo de productores mayores y por lo tanto la presencia
de L. monocytogenes en la leche podría ser menor.
.
| Cuadro 2: Procedencia de muestras de queso y tiempo
transcurrido desde su elaboración. Table 2: Origin of the cheese samples and days since production time |
| LOCALIDAD |
Nº MUESTRAS |
MATERIA PRIMA |
DÍAS DESDE ELABORACIÓN |
| Malalhue | 3 |
Leche cruda |
7 a 14 |
| Lanco | 6 |
Leche cruda |
7 a 14 |
| Río Bueno | 6 |
Leche cruda |
10 a 14 |
| Panguipulli | 2 |
Leche cruda |
10 a 14 |
| Paillaco | 3 |
Leche cruda |
12 a 15 |
| Castro | 5 |
S.I. |
S.I. |
| Total | 25 |
|
|
El porcentaje de muestras de leche cruda positivas a la presencia de L. monocytogenes es elevado si se comparan los resultados con cifras de países de la Unión Europea o EE.UU. de N.A. La presencia del patógeno en leche cruda representa un peligro potencial para el consumidor frente al hábito de consumir leche cruda o quesos elaborados a partir de leches no tratadas térmicamente. Un proceso de pasteurización deficiente puede favorecer la sobrevivencia de L. monocytogenes en leche. Los resultados negativos encontrados en quesos frescos elaborados con leche cruda, pueden indicar la inhibición del patógeno por las condiciones bajas del pH en el queso fresco, o una menor presencia de L. monocytogenes en leches de pequeños productores.
BACHMANN, H. P. y SPAHR, U., 1995. The fate of potentially pathogenic bacteria in swiss hard and semihard cheeses made from raw milk. J. Dairy Sci., 78: 476-483.
BELTRAN, C., GIL, R., CASTILLO, A. y VALDES, S., 1991. Meningoencefalitis bacterémica por L. monocytogenes en un adulto inmunocompetente. Rev. Méd. Chile, 119: 436-439.
BRADSHAW, J.G., PEELER, J.T, CORWIN, J.J, y HUNT, J.M., 1985. Thermal resistance of Listeria monocytogenes in milk. J. Food Prot ., 48 (9): 743-745.
BUCHANAN, R., STAHL, H. y WHITING, R., 1989. Effects and interactions of temperature, pH, atmosphere, sodium chloride, and sodium nitrite on the growth of Listeria monocytogenes. J.Food Prot., 52 (12): 844-851.
CHILE. MINISTERIO DE SALUD. 1998, Nuevo reglamento sanitario de los alimentos, Ediciones Publiley, Santiago, Chile. 208 p.p.
DOYLE, M.E., MAZZOTTA, A., WANG, T., WISEMAN, D. y SCOTT, V., 2001. Heat resistance of Listeria monocytogenes. J.Food Prot., 64 (3): 410-429.
FARBER, J.M., SANDERS,G. W., SPEIRS, J.I., D’AOUST, J., EMMONS, D,B., y MCKELLAR, R., 1988. Thermal resistance of Listeria monocytogenes in inoculated and naturally contaminated raw milk. Int. J. Food Microbiol., 7:277-286.
FARBER, J.M., DALEY, E., COATES, F., EMMONS, D, B., y McKELLAR, R., 1992. Factors influencing survival of Listeria monocytogenes in milk in a high-temperature short time pasteurizer. J. Food Prot ., 55 (12): 946-951.
FEDIO, W.M. y JACKSON, H., 1989. Effect of tempering on the heat resistance of Listeria monocytogenes. Letters in Microbiol., 9: 157-160.
FENLON, D.R. y WILSON, J., 1989. The incidence of Listeria monocytogenes in raw milk from farm bulk tanks in North-East Scotland. J. Appl. Bacteriol, 66: 191-196.
FLEMING, D.W., COCHI, S. L., Mac DONALD, K. L., BRONDUM, J., HAYES, P. S., PLIKAYTIS, B. D., HOLMES, M. B., AUDUIER, A., BROOME, C. V. y REINGOLD, A. L. (1985). Pasteurized milk as a vehicle of infection in an outbreak of listerosis. N. Eng. J. Med. 312: 404-407.
GAYA, P., SANCHEZ, J., MEDINA, M. y NUÑEZ, M. 1998. Incidence of Listeria monocytogenes and other Listeria species in raw milk produced in Spain. Food Microbiol. 15: 551-555.
HAYES, P., FEELEY, J.C., GRAVES, L., AJELLO, G., y FLEMING, D., 1986. Isolation of Listeria monocytogenes from raw milk. Appl. Environm. Microbiol, 51 (2): 438-440.
HITCHINS, A. D., (1995): Listeria monocytogenes , in Food and Drug Administration, Bacteriological Analitical Manual, 8th edition, AOAC International, Arlington, VA., p. 10.01 - 11.08.
KERR, K. G. y LACEY, R. W. 1992. Higiene y seguridad alimentaria. Revisiones sobre ciencia y tecnología de los alimentos. Ed. Acribia, Zaragoza, España, pp. 21-41.
LUIS JUAN-MORALES, A., ALANIZ, R., VÁSQUEZ, M.E. y ROSAS, B., 1995. Prevalence of Listeria monocytogenes in raw milk in Guadalajara, Mexico. J. Food Prot., 58 (10): 1139-1141.
PELEER, J., y BUNNING, V. K., 1994. Hazard assessment of Listeria monocytogenes in the processing of bovine milk. J. Food Prot., 57 (8): 689-697.
PERRY, C. y DONNELLY, C., 1990. Incidence of Listeria monocytogenes in silage and its subsequent control by specific and nonspecific antagonism. J.Food Prot., 53 (8) : 642-647.
PITT, W., HARDEN, T. y HULL, R. (a), 1999. Listeria monocytogenes in milk and dairy products. The Australian J. Dairy Technol., 54: 49- 65.
PITT, W., HARDEN, T. y HULL, R. (b), 1999. Antibacterial activity of raw milk against Listeria monocytogenes. The Australian J. Dairy Technol., 54: 90-93.
RYSER, E. T., (1998): Public health concerns, in E. Marth y J. Steele: Applied dairy microbiology, Marcel Dekker inc., New York, p. 263- 404.
SPAHR, U. y URL, B., 1994. Behaviour of pathogenic bacteria in cheese - a synopsis of experimental data. Bulletin of the IDF, 298: 2 - 16.
SCOTT, J. y BERNARD, D., 1999. Principios para el control de Listeria monocytogenes. Perspectivas de la industria de alimentos. La alimentación latinoamericana, (230): 17-22.
STEELE, M., McNAB, W., POPPE, C., GRIFFITHS, M., CHEN, S., DEGRANDIS, S., FRUHNER, L., LARKIN, C., LYNCH, J. y ODUMERU, J., 1997. Survey of Ontario bulk tank raw milk for food-borne pathogens. J.Food Prot., 60 (11): 1341-1346.
VIVAS, L., 1999. Listeriosis: problema en desarrollo. ILE, Enero-Febrero : 86-90.