Agro Sur, Vol. 33 N° 1, 2005, pp. 48-57
CIENCIA PECUARIA
CONTROL DEL DESARROLLO DE BACTERIAS ACIDO BUTIRICAS EN QUESO TIPO GOUDA EMPLEANDO DIFERENTES CONCENTRACIONES DE NITRATO Y TEMPERATURAS DE MADURACION
Renate Schöbitz T.1, Carolina Uribe M.1, Luz H. Molina C.1, Fernando Espina U.2
1
Instituto de Ciencia y Tecnología de los Alimentos, Facultad de
Ciencias Agrarias, Universidad Austral de Chile. Casilla 47, Valdivia
Chile, E-mail: rschobit@uach.cl
2 PROLESUR S. A., Planta Los Lagos, Décima
Región, Chile.
Recepción de originales: 13 de agosto de 2004
ABSTRACT
Prevention of butyric acid bacteria growth in Gouda type cheese at different nitrate concentrations and storage temperatures.
The objective of this study was to determine the effect of the ripening temperature and sodium nitrate concentration on the growth of butyric acid bacteria (BAB) in Gouda type cheese. Cheese was manufactured with different nitrate concentrations (0 %, 0,015 %, 0,020 % and 0,030 %) and stored at three temperatures (4 °C, 10 °C or 16 °C). At time zero and after 6, 12 and 18 weeks, the Most Probable Number (MPN) of BAB was determined (Fryer and Halligan, 1976). For each storage time and temperature, three cheeses were manufactured. The experiment was repeated three times. Results showed a low spore MPN in milk, however, after 6 weeks the BAB had grown in the cheese without nitrate. A temperature of 16 °C was favorable for the growth of BAB, with MPN of >1100/g in the cheeses without nitrate. At lower temperatures, the growth of the BAB was inhibited without nitrate (MPN <10/g). Nitrate was important for the inhibition of BAB, at 16 °C, however no differences were found among the different concentrations assayed, probably due to the low initial spore count in milk. The BAB identification showed higher percentages of isolation of C. tyrobutyricum than C. butyricum and C. sporogenes. It was concluded that a ripening temperature of ≤ 10 °C was an effective barrier to inhibit the growth of BAB, even without the addition of nitrate. At 16 °C the BAB were also inhibited, when nitrate was added, however significant growth occurred in the treatment without nitrate, at this temperature.
Key words: butyric acid bacteria, growth inhibition factors, Gouda type cheese.
RESUMEN
El presente trabajo tuvo por objetivo determinar el efecto de la temperatura de maduración y la concentración de nitrato sobre el desarrollo de las bacterias ácido butíricas (BAB) en queso tipo Gouda. Se elaboraron quesos con cuatro concentraciones de nitrato (0 %, 0,015 %, 0,020 % y 0,030 %), los cuales se almacenaron a tres temperaturas (4 °C, 10 °C y 16 °C), durante 6, 12 o 18 semanas. Para cada tiempo y temperatura de maduración se elaboraron tres quesos, en tres fechas diferentes. Se determinó el Número Más Probable (NMP) de bacterias ácido butíricas (BAB) utilizando la técnica de Fryer y Halligan modificada. Se encontró un bajo número inicial de esporas de BAB en la leche, sin embargo, a las seis semanas ya se observó el desarrollo de estas bacterias en los quesos sin nitrato. La maduración a 16 °C fue favorable para el crecimiento de BAB, obteniéndose en los tratamientos sin nitrato valores de NMP superiores a 1,100 /g, en cambio a las demás temperaturas solo en algunas muestras hubo desarrollo de BAB. El nitrato fue efectivo para inhibir el desarrollo de BAB, incluso a 16 °C, no encontrándose diferencias en el nivel de inhibición entre las tres concentraciones estudiadas. Esto probablemente se debió al bajo número inicial de esporas en la leche. La identificación de las BAB mostró una mayor presencia de C. tyrobutyricum que de C. butyricum y C. sporogenes. Se concluye que la maduración de queso tipo Gouda a ≤10 °C es una barrera efectiva para inhibir el crecimiento de BAB, incluso sin la adición de nitrato. A 16 °C las BAB también fueron inhibidas en presencia de nitrato, sin embargo hubo un desarrollo significativo en el tratamiento sin nitrato.
Palabras claves: factores de inhibición, bacterias ácido butíricas, queso tipo Gouda.
INTRODUCCION
En la fabricación de queso se producen tradicionalmente dos tipos de alteraciones o defectos de textura provocados por fermentaciones gaseosas anormales, conocidas como hinchazón temprana y tardía del queso. La hinchazón temprana o precoz, que ocurre al principio de la maduración se debe fundamentalmente a la proliferación de bacterias coliformes. Los quesos presentan ojos de pequeño diámetro de cavidad lisa y brillante (Suárez y Colomo, 1990). El defecto de la hinchazón tardía se manifiesta después de semanas o meses de maduración en los quesos de pasta semidura como Gouda, Emmental y Provolone, entre otros (Dasgupta y Hull, 1989). Se caracteriza por una hinchazón anormal, cavernosa y maloliente, de sabores desagradables que puede hacer estallar a los quesos. Los microorganismos responsables son bacterias esporuladas anaerobias pertenecientes a los clostridios del grupo butírico que fermentan el ácido láctico con producción de ácido butírico, dióxido de carbono e hidrógeno (Su e Ingham, 2000).
Clostridium tyrobutyricum es la especie aislada con mayor frecuencia en quesos que presentan hinchazón tardía, encontrándose además otras especies del género Clostridium como C. butyricum, C. sporogenes y C. beijerinckii. Sin embargo, como principal microorganismo responsable del defecto se ha descrito a C. tyrobutyricum, atribuyéndose a las otras especies un rol secundario (Su e Ingham, 2000, Klijn et al., 1995). Estos microorganismos se desarrollan en ensilajes de mala calidad, encontrándose una elevada concentración de esporas en las fecas de las vacas alimentadas con estos ensilajes, llegando a la leche a través de los pezones contaminados con las fecas (Herlin y Christiansson, 1993, Rammer, 1996). El número crítico de esporas de bacterias ácido butíricas en la leche para que se presente el defecto en el queso es variable. Según FIL/IDF (1987) son necesarias 5 a 10 esporas por litro de leche, en cambio Fryer y Halligan (1976), señalan que la presencia de una espora por mL es suficiente para que se produzca el defecto en quesos tipo Gouda madurados a 12 °C. Otra fuente de contaminación son los saladeros; se ha demostrado que durante la permanencia de los quesos en ellos, las esporas de C. tyrobutyricum y C. sporogenes sobreviven a las condiciones de salinidad, durante 60 días a 15 °C (Su et al., 2000).
Como una medida para reducir la carga de esporas en la leche para la elaboración de queso se ha utilizado la bactofugación, con lo cual se logra eliminar hasta un 96 % de las esporas presentes (Ballester, 1994). Para inhibir el desarrollo de las esporas de las bacterias butíricas durante la maduración del queso, se adicionan a la leche sustancias como el nitrato de potasio, lisozima o nisina utilizadas solas o en combinación con bajas temperaturas de maduración (Gilles y Fryer, 1984).
Adicionar nitrato de potasio o nitrato de sodio es una medida muy eficaz para prevenir la hinchazón tardía en quesos; la concentración máxima utilizada puede ser de 20 a 30 g por 100 L de leche (Scott, 1991). Un exceso de nitrato puede inhibir el desarrollo de los fermentos lácticos y detener el proceso de maduración, produciéndose sabores desagradables y una coloración rojiza en el queso. El nivel máximo permitido para el queso en Chile no debe ser superior a 500 mg/kg (Chile, 2003). El nitrato presente en el queso es reducido a nitrito por acción de la enzima de la leche xantina oxidasa, o por nitrato reductasas provenientes de algunos microorganismos. La acción antimicrobiana del nitrito se atribuye al ácido nitroso y los óxidos que se forman a partir de él (Spahr y Url, 1994; Gloria et al., 1997). Durante la maduración los valores de nitrato se reducen en el queso, proceso que es variable y dependiente de la tecnología utilizada en la elaboración del mismo (Molina et al., 1999).
La tendencia a nivel mundial es reducir el consumo de nitratos y nitritos debido a un posible efecto carcinogénico del nitrito y sus derivados. Es así como en Francia, Grecia e Italia no se permite la adición de nitrato a la leche para la elaboración de queso, mientras en Alemania y Holanda el máximo permitido es de 15 g de nitrato de potasio por 100 kg de leche (Burt et al., 1997, Glaeser, 1989). En Chile la apertura de la industria de alimentos a mercados internacionales obliga a las queserías que desean exportar, a adoptar normativas internacionales y por lo tanto deberán considerar métodos alternativos a las concentraciones de nitrato actualmente utilizadas en la elaboración de queso.
El objetivo del presente estudio fue determinar el efecto de distintas concentraciones de nitrato de sodio y diferentes temperaturas de maduración sobre el desarrollo de bacterias ácido butíricas en queso tipo Gouda.
MATERIALES Y METODOS
Elaboración del queso tipo Gouda.
Para cumplir con los objetivos del trabajo se elaboró queso tipo Gouda, según las pautas de la empresa PROLESUR S.A., agregando nitrato de sodio en las proporciones de 0 %, 0,015 %, 0,020 % y 0,030 % a leche pasteurizada. Para el proceso se emplearon tinas redondas de acero inoxidable de doble pared, automatizadas, con una capacidad de 15.000 L. Al término de la etapa de salado (22 % de NaCl (20 °Bé) en el saladero), los quesos fueron envasados al vacío.
El diseño experimental utilizado fue de bloques completos al azar. Los tratamientos estudiados fueron tres temperaturas de maduración (4±2 °C, 10±2 °C y 16±2 °C), tres tiempos de almacenamiento (6, 12 y 18 semanas), cuatro concentraciones de nitrato, con tres repeticiones. Para cada experimento se elaboraron tres quesos por tiempo de maduración, para cada temperatura. Además, se incluyó un queso por cada concentración de nitrato para los análisis microbiológicos correspondientes al tiempo cero. El experimento se repitió en tres fechas distintas durante el mes de noviembre de 2001.
Para el análisis de los datos, los resultados del NMP se transformaron en log 10 para una mayor homogeneidad de los valores. Los datos obtenidos se analizaron mediante un análisis de varianza multifactorial y se utilizó la prueba de Tukey, con un nivel de confianza del 95 %, para comparar temperaturas de maduración y concentraciones de nitrato.
En la empresa PROLESUR S.A. normalmente la maduración del queso tipo Gouda se realiza entre 10 °C y 12 °C durante un tiempo aproximado de 30 días.
Toma de muestra para los análisis microbiológicos.
Leche pasteurizada. Las muestras se obtuvieron desde las tinas, inmediatamente después de finalizada la agitación, recolectándose asépticamente aproximadamente 100 mL en un frasco estéril. Se tomaron tres muestras por fecha de elaboración.
Queso. La toma de muestra se realizó según especificaciones de la Norma FIL/IDF (1995), modificada; en lugar de tomar una muestra con sacabocados, se cortó una rebanada de 2 cm de ancho de la parte central del bloque de queso de 17 kg, que incluía la superficie externa. Cada muestra tenía un peso aproximado de 300 g. En total se tomaron 360 muestras, las cuales se envasaron al vacío y trasladaron en cajas térmicas, junto con la leche, al Instituto de Ciencia y Tecnología de los Alimentos de la Universidad Austral de Chile, no transcurriendo más de ocho horas entre la toma de muestra y el análisis.
Enumeración de bacterias ácido butíricas (BAB) en medio RCM – Lactato mediante la técnica del Número Más Probable (NMP)
De las muestras de leche se extrajeron alícuotas de 10 mL, las cuales se colocaron en frascos estériles para el tratamiento térmico. Con el mismo propósito, de las muestras de queso, se cortaron trozos pequeños de distintas áreas, hasta completar 100 g. De cada muestra de queso se obtuvo una submuestra de 11 g, la cual se colocó en una bolsa Stomacher y se homogeneizó durante 2 min a velocidad alta, con 99 mL de buffer citrato al 2 % calentado a 45 °C, como diluyente (APHA, 1992). Posteriormente el homogeneizado se traspasó a un frasco estéril para el tratamiento térmico, el cual se realizó en baño maría a 80 °C durante 10 min.
El análisis se realizó según el método descrito por Fryer y Halligan (1976) modificado, para la detección y enumeración de esporas de Clostridium tyrobutyricum. Al método original se le redujo el volumen de muestra sembrado y se utilizó un protocolo diferente al descrito por los autores para la identificación de las BAB. El caldo RCM-lactato (Reinforced Clostridial Médium), se preparó según la siguiente formulación: extracto de carne 10 g; extracto de levadura 3 g; tripticasa 10 g; jarabe de lactato de sodio al 70 % 20 mL; cloruro de sodio 5 g; acetato de sodio x 3 H2O; 0,8 g, agar-agar 2 g. Los ingredientes se disolvieron en 1 L de agua desionizada y el pH se ajustó a 6,1±0,1. El caldo se distribuyó en tubos de 16 x 150 mm en un volumen de 10 mL por tubo y se esterilizó en autoclave a 115 °C durante 10 min. Previo a la inoculación, los tubos con caldo de cultivo se sometieron a ebullición en baño maría durante 10 min y se enfriaron a una temperatura inferior a 42 °C para eliminar el oxígeno.
Para la siembra de la leche se inoculó 1 mL de la muestra sin diluir y las diluciones 10-1 y 10-2 (APHA, 1992), en series de tres tubos con caldo RCM-lactato. Los tubos posteriormente se sellaron con 2 mL de un tapón de agar-agar al 2 % y fueron incubados a 37 °C en anaerobiosis (sistema gas pack, OXOID) durante 7 días.
Para el queso, a partir de la muestra calentada (dilución 10-1) se hicieron diluciones adicionales (10-2 y 10-3) en buffer citrato al 2 % calentado a 45 °C (APHA, 1992). La incubación de los tubos se realizó en anaerobiosis (sistema gas pack, OXOID) a 37 °C durante 7 días. El desarrollo de las BAB se comprobó a través de la producción de gas en los tubos, lo cual se visualizó por el levantamiento del tapón de agar. A partir del número de tubos positivos (con producción de gas), se obtuvo una clave y se determinó el NMP de BAB por g ó mL de muestra (APHA, 1992). El límite de detección de la técnica de NMP al inocular 1 ml de leche es < 0,3/mL y en el queso de <3,0/g. Para graficar los resultados de los valores negativos en queso a éstos se les asignó el valor 0,5.
Pruebas para la identificación de los microorganismos productores de gas.
A partir de los tubos en los que se detectó presencia de gas por la técnica del NMP, fue posible obtener material para inocular en forma de estría placas con agar RCM-lactato, las cuales se incubaron bajo condiciones de anaerobiosis (sistema gas pack, OXOID) a 37 °C por 7 días. Los microorganismos aislados se sometieron a las pruebas que se describen a continuación.
Prueba de la catalasa. Esta prueba se utilizó para diferenciar los microorganismos anaerobios facultativos como Bacillus de los anaerobios estrictos como Clostridium. La prueba se realizó sobre un portaobjetos con peróxido de hidrógeno al 5 % (Jonsson, 1990).
Fermentación de azúcares. Para diferenciar las especies Clostridium tyrobutyricum, Clostridium butyricum y Clostridium sporogenes, se empleó la prueba de fermentación de los azúcares lactosa, glucosa y maltosa. Como medio base se utilizó caldo tioglicolato sin dextrosa, preparado según la siguiente formulación: peptona de caseína, 10 g; extracto de levadura, 5 g; L(+) cisteína 0,5 g; cloruro de sodio 2,5 g; tioglicolato de sodio 0,5 g. El pH del caldo se ajustó a 7,1±0,2 y se distribuyó en alícuotas de 5 mL, en tubos de 16 x 100 mm. Posteriormente se esterilizó a 121 °C / 15 min. Los azúcares se prepararon en una solución al 6 % y se esterilizaron por filtración (0,22 μm). A cada tubo con el medio base estéril, se le adicionaron asépticamente 0,5 mL de la solución de azúcar. Los tubos se inocularon con 0,1 mL de un inóculo preparado a partir de una colonia suspendida en buffer fosfato (APHA, 1992), se agitaron suavemente, para no incorporar oxígeno y se sellaron con un tapón de 1 cm de Vas - Par (mezcla de 50 % vaselina y 50 % parafina estéril). La incubación se realizó en anaerobiosis a 37 °C por 3 días. Para la lectura a cada tubo se le adicionaron dos gotas del indicador azul de bromotimol al 1 %, indicando un viraje al amarillo una reacción positiva (Summanen et al., 1993).
Identificación de cepas catalasa positivas. Un número determinado de cepas que dieron una reacción positiva a la prueba de la catalasa se sometieron a pruebas de identificación para el género Bacillus como son, la prueba de Voges Proskauer, reacción de la yema de huevo, fermentación de manitol y producción de indol, de acuerdo al esquema de Gordon et al. (1973).
RESULTADOS
El análisis microbiológico de la leche pasteurizada utilizada como materia prima para la elaboración de los quesos, mostró un descenso en el NMP de BAB en el tiempo, obteniéndose para la primera fecha de elaboración valores de NMP de 0,3/mL, 0,4/mL y 0,7/mL respectivamente. En las tres muestras correspondientes a la segunda fecha de elaboración se obtuvieron NMP de 0,3/mL, no siendo detectadas BAB en la última fecha de elaboración (NMP < 0,3/mL).
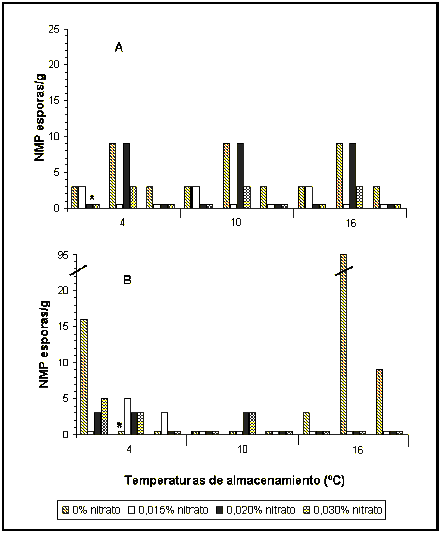
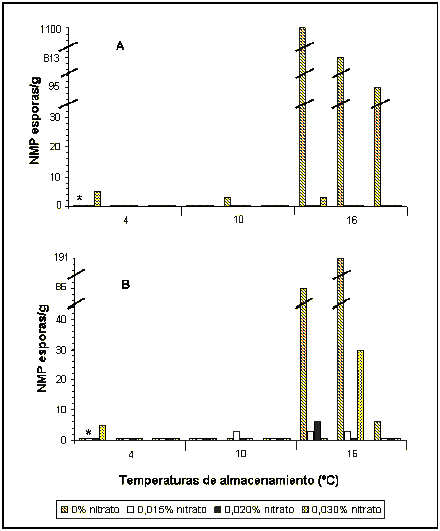
El bajo número inicial de esporas en la leche no permitió visualizar durante la maduración el posible efecto de las distintas concentraciones de nitrato utilizadas sobre el desarrollo de las esporas de BAB en queso. Los resultados del NMP para el tiempo cero dieron valores en el rango de NMP <3,0/g hasta NMP 9,0/g. Cabe señalar que para esta etapa se analizó un queso por dosis de nitrato y los resultados se utilizaron como valor inicial de las tres temperaturas. En la Figura 1 se observa un aumento. Después de 6 semanas de maduración, del NMP de BAB en los quesos sin nitrato a 16 °C, manteniéndose para los demás tratamientos los valores cercanos al inicial. A las 12 semanas se obtuvo un aumento significativo en los quesos sin nitrato a 16 °C, en relación a las fechas anteriores (Figuras 1 y 2), con valores cercanos o iguales a NMP 1100/ g. En los quesos con 18 semanas de maduración, para el mismo tratamiento se observó un descenso en el número de BAB, con valores que fluctuaron entre NMP 6,0/g y 191/g. Para los quesos con diferentes dosis de nitrato no se detectó en la mayoría de ellos el desarrollo de BAB (< 3,0/g) después de 12 semanas de maduración.
La temperatura de almacenamiento de los quesos, fue otro factor que contribuyó de manera importante a la inhibición del desarrollo de BAB en queso. Esto se desprende claramente de las Figuras 1 y 2, donde se observa que a 4 °C y 10 °C, incluso en los quesos sin nitrato, sólo en forma esporádica en algunas muestras se detectó valores de NMP de 3,0/g. En cambio en los quesos almacenados a 16 °C, en todas las fechas de elaboración se encontró la presencia de BAB. Esto fue particularmente notorio en los tratamientos con 0 % de nitrato, almacenados a 16 °C, en los cuales después de 12 semanas de almacenamiento se obtuvo el mayor desarrollo de estas bacterias. A las 18 semanas se presentó un descenso en el desarrollo de BAB en el tratamiento con 0 % de nitrato, sin embargo con 0,030 % de nitrato se obtuvo un NMP de 30/g, valor que fue superior a los encontrados en fechas anteriores, para ese tratamiento a la misma temperatura.
Las pruebas para la identificación de BAB en caldo RCM-lactato dieron como resultado un 38,54 % de cepas correspondientes a la especie C. butyricum seguido de la especie C. tyrobutyricum con un 23,95 % de las cepas (Cuadro 1). En la categoría designada como otros, se ubicaron los microorganismos esporulados productores de gas, no pertenecientes a las BAB y que podían ser bacterias anaerobias facultativas o anaerobias estrictas. En los quesos del tiempo cero y con 6 semanas de maduración se observó el predominio de C. butyricum sobre C. tyrobutyricum (datos no presentados), sin embargo con el transcurso del tiempo esto varió, como se observa en la Figura 3, en la cual se presentan los porcentajes de distribución de los microorganismos identificados a las 12 y 18 semanas de maduración. Se observa que tanto a las 12 como a las 18 semanas el mayor número de BAB aisladas correspondió a C. tyrobutyricum sobre C. butyricum y C. sporogenes. Se destaca también a las 18 semanas un mayor número de cepas identificadas como otros microorganismos. De las cepas identificadas como no pertenecientes a las especies de Clostridium en estudio, a 19 se les realizó la prueba de la catalasa, resultando 12 de ellas catalasa negativas y siete catalasa positivas. Estas últimas fueron identificadas como cepas de Bacillus cereus y Bacillus polymixa mediante el esquema de Gordon et al. (1973).
Microorganismos
identificados |
Nº de cepas |
Porcentajes |
Clostridium butyricum |
37 |
38,54 |
Clostridium tyrobutyricum |
23 |
23,95 |
Clostridium sporogenes |
17 |
17,70 |
Otros (catalasa
positivos y negativos) |
19 |
19,79 |
Total |
96 |
100 |
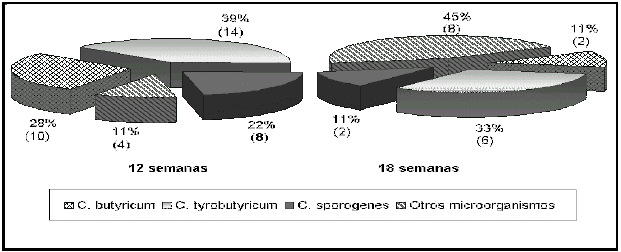 |
Figura
3. Bacterias ácido butíricas aisladas de queso tipo Gouda
con 12 y 18 semanas de maduración. Figure 3. Butyric acid bacteria isolated from Gouda type cheese with 12 and 18 weeks of ripening. |
DISCUSIÓN
La información disponible sobre el mínimo de esporas en la leche para la presentación de un problema de hinchazón tardía en queso es variable. De acuerdo con lo señalado por Fryer y Halligan (1976) una espora de C. tyrobutyricum/mL de leche sería suficiente, en cambio Klijn et al. (1995), recomiendan utilizar leche que contenga un número inferior a 0,1 esporas/mL, para prevenir el problema. En el presente estudio el máximo de esporas encontradas en la leche pasteurizada fue de NMP 0,7/mL y el valor más bajo de NMP < 0,3/mL, límite de detección de la técnica al sembrar 1 mL de leche. El número de esporas encontradas por lo tanto fue bajo, probablemente por realizarse los muestreos en primavera, época en la cual el ganado ya no es alimentado con ensilaje, principal fuente de contaminación de la leche con bacterias esporuladas anaerobias (Su e Ingham, 2000). Sin embargo, antecedentes de la literatura indican que la presencia de 0,005 a 0,01 esporas/mL de leche son suficientes para que se presente el defecto en queso Gouda elaborado sin nitrato (Stadhouders, 1990). Esto demuestra que toda la leche utilizada en este estudio presentaba algún nivel de riesgo para los quesos, en particular en el tratamiento sin nitrato (0 %). Con ello queda de manifiesto además que el límite de detección de la técnica del NMP (< 0,3/mL) no fue suficientemente bajo, para detectar valores de BAB en niveles críticos para elaborar queso sin nitrato. Este inconveniente se confirmó con los resultados obtenidos en la tercera fecha de elaboración, donde no se detectó la presencia de BAB en la leche, sin embargo en los quesos del tiempo cero y madurados a 16 °C sin la adición de nitrato, se encontraron elevados valores de NMP de bacterias esporuladas anaerobias. Estos resultados reflejan también la efectividad del nitrato adicionado a la leche, para prevenir el desarrollo de BAB y con ello detener o retardar el defecto de la hinchazón tardía en quesos como el Gouda y Edam (Gloria et al., 1997).
Actualmente existe la tendencia a reducir el consumo de nitratos, prohibiéndose su adición a la leche destinada a la elaboración de quesos en países como Estados Unidos de N.A. Francia, Grecia e Italia (Molina et al., 1999, Stadhouders, 1990). Debido a estas restricciones resulta particularmente importante buscar otros métodos para inhibir la germinación de esporas en quesos semiduros. Una alternativa es la maduración de los quesos a bajas temperaturas, la cual se evaluó en este trabajo. Los resultados obtenidos mostraron una clara inhibición del desarrollo de BAB a 4 °C y a 10 °C, incluso en los quesos sin nitrato. Similares resultados obtuvieron Su e Ingham (2000) y Gilles y Fryer (1984), quienes utilizando temperaturas de maduración entre 5 °C y 8 °C, inhibieron la germinación de esporas de Clostridium y C. tyrobutyricum específicamente. Sin embargo, se ha señalado que al utilizar temperaturas de maduración iguales o inferiores a 8 °C, se corre el riesgo de obtener queso con defectos en el aroma y sabor (Dasgupta y Hull, 1989).
En los quesos madurados a 16 °C el NMP de esporas comenzó a aumentar a partir de la sexta semana de maduración, observándose en éstos el defecto de la hinchazón tardía. La reducción en el número de BAB a las 18 semanas de maduración a 16 °C respecto a las 12 semanas, probablemente se debió a la difusión de sal hacia la parte central del queso, lo cual resultó inhibitorio para el desarrollo de las BAB.
Las tres concentraciones de nitrato utilizadas tuvieron el mismo efecto inhibitorio sobre el desarrollo de las BAB a través del tiempo. Sin embargo, pudo haber ocurrido una pérdida de efectividad del nitrato durante el transcurso del tiempo. Molina et al. (1999), encontraron una degradación significativa del nitrato durante la maduración del queso Gouda, la cual, según los autores, fue independiente de la concentración inicial utilizada. Stadhouders (1990), señala que la degradación del nitrato ocurre principalmente durante las seis primeras semanas de maduración y se debe en parte al desarrollo microbiano en la superficie del queso. Otro factor importante sería la temperatura de maduración, ya que se ha determinado que a mayor temperatura la degradación es más rápida. Esto podría explicar el resultado obtenido en el queso con 0,03 % de nitrato, que a las 18 semanas de maduración a 16 °C tuvo valores de NMP de 23/g, 23/g y 43/ g respectivamente.
La identificación de las BAB mostró un mayor porcentaje de C. butyricum en los quesos al tiempo cero y a las seis semanas de maduración, comparado con C. tyrobutyricum. Sin embargo, después de 12 y 18 semanas de maduración hubo un mayor porcentaje de aislamientos de C. tyrobutyricum. Ello concuerda con lo que ocurre normalmente en el queso, ya que el defecto de la hinchazón tardía se presenta después de varias semanas e incluso meses de maduración (Marth y Steele, 1998) y el principal microorganismo responsable es C. tyrobutyricum (Klijn et al., 1995). Las especies C. butyricum y C sporogenes, en este estudio se aislaron en menor número a las 12 y 18 semanas de maduración, en relación a C. tyrobutyricum. Ambos microorganismos son capaces de producir gas en queso, sin embargo, de acuerdo con Su e Ingham (2000), su participación sería secundaria en el defecto de la hinchazón tardía. Cabe señalar que la mayoría de las cepas de Clostridium fueron aisladas a partir de quesos almacenados a 16 °C con 0 % de nitrato, por encontrarse en este grupo el mayor número de muestras positivas, que presentaron gas en los tubos. Ello se debe a que las esporas de Clostridium para germinar y desarrollarse requieren de temperaturas iguales o superiores a 12 °C (Stadhouders, 1990) lo cual, junto con la ausencia de nitrato favoreció el desarrollo de Clostridium en los quesos estudiados.
El empleo de caldo RCM con lactato de sodio como fuente de carbono y un medio de cultivo confirmativo, fue descrito por Fryer y Halligan (1976), como efectivo para el aislamiento e identificación de C. tyrobutyricum. Sin embargo, estudios posteriores demostraron que el caldo RCM es de baja selectividad, desarrollándose también en él otras especies de Clostridium y especies anaerobias facultativas del género Bacillus (Jonsson, 1990, Ingham et al., 1998). La baja selectividad del medio de cultivo también se observó en este trabajo, donde se identificaron diferentes especies de Clostridium y bacterias esporuladas catalasa positivas del género Bacillus, correspondientes a B. cereus y B. polymixa. Se descarta en este caso el desarrollo de microorganismos no esporulados, ya que las muestras de leche y de queso fueron sometidas a un tratamiento térmico antes de la siembra, con el cual se habrían destruido las formas vegetativas de las bacterias presentes.
Teniendo presente las limitaciones del medio de cultivo y la baja precisión del NMP, el método es de utilidad para el análisis de rutina de leche al aumentar su sensibilidad con la siembra de un mayor volumen inicial de muestra.
CONCLUSIONES
- Los resultados del trabajo permiten obtener las siguientes conclusiones:
- Todas las concentraciones de nitrato evaluadas fueron efectivas para inhibir el desarrollo de las BAB, probablemente debido al bajo número inicial de esporas presentes en la leche.
- La temperatura de maduración fue un factor importante para inhibir el desarrollo de las BAB, resultando efectivas las dos temperaturas más bajas, incluso en los tratamientos sin nitrato.
- Un bajo número inicial de esporas de BAB en leche fue suficiente para producir el defecto de hinchazón tardía en queso tipo Gouda, sin la adición de nitrato.
AGRADECIMIENTOS
Este trabajo de investigación fue financiado por la Empresa PROLESUR S. A., Los Lagos, Décima Región, Chile.
BIBLIOGRAFIA
AMERICAN PUBLIC HEALTH ASSOCIATION (APHA). 1992. (R. Marshall, Ed.). Compendium of methods for the microbiological examination of foods. 16th Edition. American Public Health Association. Washington D.C. 546 pp.
BALLESTER, J. 1994. La microfiltración, un medio eficaz de reducción de bacterias y esporas en la leche. Revista Española de Lechería, Junio: 40-41.
BURT, R., BLÜTHGEN, A., HEESCHEN, W.H. 1997. Nitrate, nitrite, nitrosamines. In: Monograph on residues and contaminants in milk and milk products. Bulletin of the International Dairy Federation. Special Issue 970 : 74 - 78.
CHILE. MINISTERIO DE SALUD. 2003. Reglamento Sanitario de los Alimentos. Decreto Supremo Nº 977. Editorial Textos Jurídicos Ltda. Santiago. Chile. 170 pp.
DASGUPTA, A., HULL, R. 1989. Late blowing of Swiss cheese: Incidence of Clostridium tyrobutyricum in manufacturing milk. The Australian Journal of Dairy Technology, November: 82-87.
FRYER, T., HALLIGAN, A. 1976. The detection of Clostridium tyrobutyricum in milk. New Zealand Journal of Dairy Science and Technology, 11:132.
GILLES, J., FRYER, T. 1984. The effect of storage temperature on “Late blowing” in Gouda Cheese. New Zealand Journal of Dairy Science and Technology 19: 83-85.
GLAESER, H. 1989. Use of nitrate in cheese production. Dairy Industries International, 54 (11): 19-23.
GLORIA, M., VALE, S., VARGAS, O., BARBOUR, J., SCANLAN, R. 1997. Influence of Nitrate levels added to cheese-milk on nitrate, nitrite, and volatile nitrosamine contents in Gruyere cheese. Journal of Agriculture and Food Chemistry, 45: 3577-3579.
GORDON, R., HAYNES, W. HORNAY, C. 1973. The genus Bacillus. Agricultural Research Service. United States. 283 p.
HERLIN, A., CHRISTIANSSON, A. 1993. Cheeseblowing anaerobic spores in bulk milk from loosehoused and tied dairy cows. Milchwissenschaft, 48 (12): 686-690.
INGHAM, S., HASSLER, J., TSAI, Y-W., INGHAM, B. 1998. Differentiation of lactate-fermenting, gasproducing Clostridium spp. isolated from milk. International Journal of Food Microbiology 43:173-183.
INTERNATIONAL DAIRY FEDERATION (FIL/ IDF). 1995. Milk and Milk Products. Methods of sampling. IDF Standard 50:B: 14-17.
INTERNATIONAL DAIRY FEDERATION. 1987. The use of lysozyme in the prevention of late blowing in cheese. Bulletin N° 216: 1-16.
JONSSON, A. 1990. Enumeration and confirmation of Clostridium tyrobutyricum in Silages using Neutral Red, D-Cycloserine, and Lactate Dehydrogenase Activity. Journal of Dairy Science 73: 719-725.
KLIJN, N., NIEUWENHOF, F., HOOLWERF, J., VAN DER WAALS, C., WEERKAMP, A. 1995. Identification of Clostridium tyrobutyricum as the Causative Agent of Late Blowing in Cheese by Species- Specific PCR Amplification. Applied and Environmental Microbiology 61 (8): 2919-2924.
MARTH, E., STEELE, J. (Ed.). 1998. Applied Dairy Microbiology. Marcel Dekker Inc. New Cork. 516 pp.
MOLINA, L., GALLARDO, E., BRITO, C., PINTO, M., MOLINA, I. 1999. Efecto de la maduración en el contenido de nitratos y nitritos en quesos semiduros. Agro Sur 27(2): 112-126.
RAMMER, C. 1996. Quality of grass silage infected with spores of Clostridium tyrobutyricum. Grass and Forage Science 51:88-95.
SCOTT, R. 1991. Fabricación de queso. Editorial Acribia. Zaragoza. España. 520 pp.
SPAHR, U., URL, B. 1994. Behaviour of pathogenic bacteria in cheese. A synopsis of experimental data. Bulletin of the International Dairy Federation Nº 298: 2-16.
STADHOUDERS, J. 1990. Prevention of butyric acid fermentation by the use of nitrate. Bulletin of the International Dairy Federation N° 251: 40-46.
SU, Y-C., INGHAM, S. 2000. Influence of milk centrifugation, brining and ripening conditions in preventing gas formation by Clostridium spp. in Gouda cheese. International Journal of Food Microbiology 54: 147-154.
SUAREZ , J. A., COLOMO, B. 1990. Control de esporulados butíricos. Madrid. Industria Láctea Española (ILE), 141: 33-39.
SUMMANEN, P., BARON, E., CITRON, D., STRONG, C, WEXLER, H., FINEGOLD, S. 1993. Wadsworth Anaerobic Bacteriology Manual. Fifth Edition. Belmont C. A: Star. 895 p.