Agro Sur 35 (2): 52-54 2007
PROPAGACIÓN in vitro DE Lobelia bridgesii HOOK & ARN, ESPECIE ENDÉMICA DE LA PROVINCIA DE VALDIVIA, CHILE
IN VITRO PROPAGATION OF Lobelia bridgesii HOOK & HARN AN ENDEMIC SPECIES OF VALDIVIA PROVINCE, CHILE
Jara, G., y Seemann, P.
Facultad de Ciencias Agrarias, Universidad Austral de Chile, Casilla 567, Valdivia, Chile. E-mail: pseemann@uach.cl.
INTRODUCCIÓN
Lobelia bridgesii es una planta herbácea con flores que forman un racimo terminal de pétalos de color rosado claro, perteneciente a la familia Campanulaceae, perenne, y endémica, catalogada como “vulnerable”, de distribución restringida a la XIV Región (Provincia de Valdivia, 39º44`S a 39º53`S), donde crece en un área de alrededor de 50 km alrededor de la Bahía de Corral, desde el nivel del mar hasta los 450 m de altura. A pesar de que presenta una distribución muy restringida, esta especie no se encuentra incorporada a Programas de conservación in situ, cultivándose en el Arboretum de la UACh y durante los últimos años en Gran Bretaña e Irlanda (Hechenleitner et al. 2005). Motivado por esta situación Zurita (1993), realizó un estudio para propagar, mediante esquejes, cultivo de tejidos y por semillas, esta y otras especies endémicas de la Provincia de Valdivia, obteniéndose sólo regeneración de brotes y callos y no de raíces. Debido a sus propiedades alucinógenas y anestésicas, Marambio et al. (1999) realizaron el aislamiento e identificación de dos alcaloides extraídos de las partes aéreas en dos especies de Lobelia. El objetivo del presente trabajo fue realizar el enraizamiento in vitro de brotes de Lobelia bridgessi, de tal forma de proponer un protocolo completo para la propagación in vitro de esta especie.
MATERIALES Y METODOS
El material vegetal utilizado corresponde a explantes multinodales con dos o tres nudos aislados a partir de brotes in vitro, mantenidos en medio MS (Murashige y Skoog, 1962) adicionado con 1,0 mgL-1 de 6-benzilaminopurina.
Un explante multinodal fue sembrado en frascos con 10 ml de medio de cultivo MS, en forma aséptica. Los tratamientos utilizados fueron el medio de cultivo MS con sus macrosales al 100% y 50% en estado sólido, gelificado con 2,0 g L-¹ de gelrite y líquido, adicionado con 0,5 mg L-¹ de Acido Nafalén Acético (ANA) y 0,5 mg L-¹ de Acido Indol Acético (AIA), en forma separada, de tal forma de completar ocho tratamientos, con 18 repeticiones cada uno. Los frascos se mantuvieron en cámara de crecimiento con una intensidad lumínica de 50 μmolm-2s-1, 16 horas luz y 23ºC. A los 15 días se evaluó la formación de raíces y a los 30 días el número y longitud de raíces, brotes y grado de enraizamiento, según escala de 0 (sin raíces) a 3 (máxima formación de raíces).
RESULTADOS Y CONCLUSIÓN
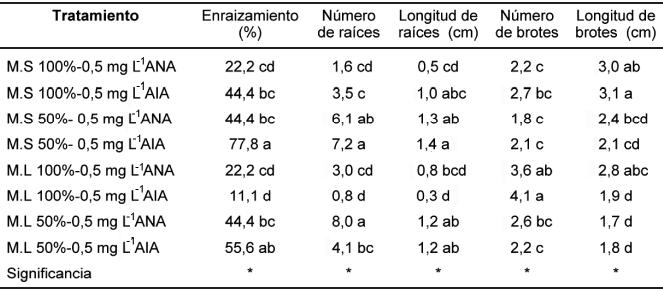
A los 15 días de iniciado el cultivo se presentaron brotes enraizados con diferencias significativas entre los tratamientos, los que fueron aportadas por los brotes cultivados en el medio sólido al 50%, con un 77,8% y en el medio de cultivo en estado líquido con un 55,6%, ambos adicionados con 0,5 mgL-1 de AIA. Independientemente del estado físico del medio de cultivo (sólido o líquido) el mejor tratamiento resultó ser el 50% de las macrosales adicionado con 0,5 mg L-¹ de AIA. A los 30 días de cultivo, el mayor número de raíces se presentó en el medio líquido al 50% (8,0 raíces/ explante) y sólido al 50% (7,2 raíces/explante), adicionado con 0,5 mg L -¹ de ANA y con 0,5 mg L-¹ de AIA, respectivamente, sin diferencias estadísticas entre ambos tratamientos. Por otra parte la longitud de las raíces se comportó mejor en el medio de cultivo al 50%, sólido y con 0,5 mg L-¹ de AIA, aunque sin diferencias al resto de los tratamientos, donde se empleó el 50% de las macrosales. De la misma forma como se indujo la formación de raíces, la brotación fue eficiente en todos los tratamientos, en forma significativa en medios con las macrosales al 100% (Cuadro 1).
 |
| * M.S: Medio de cultivo sólido; M.L: Medio de cultivo líquido |
La mayor cantidad de plantas con raíces grado 3, se obtuvo en el medio de cultivo con la reducción de las macrosales al 50%, adicionado con 0,5 mgL-1 de ANA o AIA (Cuadro 2). Mediante estos resultados es posible proponer un protocolo de multiplicación de Lobelia bridgesii, a partir de explantes multinodales en medio MS adicionado con BAP durante 30 días para luego transferirlos a medio de cultivo reducido al 50% adicionado con 0,5 mgL-1 de ANA o AIA, en estado sólido o líquido.
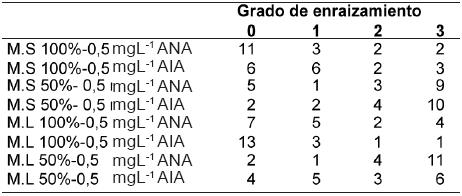 |
*
M.S: Medio de cultivo sólido; M.L: Medio de cultivo líquido. Nº repeticiones
total=18 |
REFERENCIAS
HECHENLEITNER, V. P.; GARDNER, M. F.;THOMAS, P.I.; ECHEVERRÍA.C; ESCOBAR, P. BROWNLESS, P.; MARTÍNEZ. C. 2005. Plantas Amenazadas del Centro-Sur de Chile Distribución, Conservación y Propagación. Universidad Austral de Chile y Real Jardín Botánico de Edimburgo. Valdivia. 188 pp.
MARAMBIO, O.; MONSALVE, E.; SCHMEDA-HIRSCHMANN. G. DNA Binding alkaloids from Lobelia bridgesii HOOK ET ARN and Lobelia tupa L. Bol. Soc. Chil. Quím. [online]. set. 1999, vol.44, no.3 [citado 31 Octubre 2007], p.385-389. Disponible en la World Wide Web: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0366-16441999000300016&lng=es&nrm=iso. ISSN 0366-1644.
ZURITA, A. 1993. Propagación de tres especies arbustivas valdivianas con problemas de conservación. Tesis Facultad de Ciencias Agrarias, Universidad Austral de Chile, Valdivia. 89 p.