AGRO
SUR 36(3) 137-146 2008
DOI:10.4206/agrosur.2008.v36n3-03
CIENCIA
DE LOS ALIMENTOS
Lactobacillus
helveticus CNRZ 32: ATENUACIÓN Y PROPIEDADES ENZIMÁTICAS PARA USAR EN QUESOS
COMO CULTIVO ADJUNTO
Lactobacillus
helveticus CNRZ 32: Attenuation and enzymatic properties for use as a secondary
culture to produce cheese
Carmen
Brito C., Sandra Bock S., Renate Schöbitz T., Mariela Horzella R. y Luz Haydeé
Molina C.
Instituto
de Ciencia y Tecnología de los Alimentos. Facultad de Ciencias Agrarias. Universidad
Austral de Chile.
Casilla 47. Valdivia. Chile. cbrito@uach.cl.
ABSTRACT
The
viability and enzymatic behaviour (proteolytic, lipolytic and glycolytic) of
Lactobacillus helveticus CNRZ 32 treated at high and low temperatures
were studied. The treatments were carried out with the aim of reducing its glycolytic
capacity while maintaining its proteolytic and lipolytic enzyme characteristics.
These characteristics are necessary for it to be potentially used as a secondary
culture to accelerate cheese ripening. The culture was attenuated at 68ºC for
18 s (A) or at -18ºC x 24 h (B), and the culture viability and remaining enzymatic
capacity for proteolysis, lipolysis and glycolysis in milk were compared with
those of the untreated culture.
The high heat treatment of the culture achieved the best relationship between
reducing the strain glycolytic capacity while maintaining the proteolytic and
glycolytic capacities. The culture L. helveticus CNRZ 32 following treatment
appears to be a good potential secondary culture to accelerate the cheese ripening
process.
Key
words: Lactobacillus helveticus CNRZ 32, attenuation, enzymatic
properties.
RESUMEN
Se
estudió el comportamiento en viabilidad y capacidades enzimáticas (proteolíticas,
lipolíticas y glicolíticas) de Lactobacillus helveticus CNRZ 32, sometido
a tratamientos de alta y baja temperatura. Ambos tratamientos se realizaron
para reducir su capacidad glicolítica con el fin de conocer su potencial uso,
como cultivo adjunto, que agregue complejos enzimáticos requeridos para acelerar
la maduración de quesos. El cultivo fue atenuado a 68ºC x 18 s (A) y a -18ºC
x 24 h (B), luego de lo cual se midió: viabilidad del cultivo y actividad enzimáticas
remanentes a) proteásica, b) lipásica y c) glicolítica en leche, lo que se comparó
con la cepa sin atenuar (SA). El tratamiento térmico alto de atenuación logró
el mejor balance entre disminuir la capacidad glicolítica de la cepa y mantener
las capacidades enzimáticas proteolíticas y lipolíticas, teniendo como resultado
un interesante potencial de uso del L. helveticus CNRZ 32, atenuado (como
cultivo adjunto) en aceleración de maduración de quesos.
Palabras
claves: Lactobacillus helveticus CNRZ 32, atenuación,
propiedades enzimáticas.
INTRODUCCIÓN
Debido
a la importancia económica de la maduración del queso, actualmente se está intensificando
la búsqueda de implementación de metodologías destinadas a la aceleración de
dicho proceso.
El
empleo de microorganismos adicionales para acelerar la maduración, permite añadir
al queso un sistema enzimático completo y equilibrado, que por encontrarse en
el interior de las células quedará retenido en la matriz del producto, tras
la lisis celular. Sin embargo, la adición de cultivos adjuntos específicos,
que aumentan las concentraciones de células viables a niveles superiores a las
normales, puede conducir a una fermentación anormalmente rápida durante el proceso.
Consecuentemente es necesario lograr que las células añadidas en forma adicional
al cultivo tradicional (estárter), no presenten alta actividad glicolítica hasta
que la lactosa haya sido consumida en forma regular por el cultivo estárter
de la variedad (McSweeney, 2004; McSweeney & Fox; 2004, Upadhyay, et
al., 2004).
Diversos
autores, han experimentado agregando cepas de cultivos atenuados específicos
(adjuntos), en diferentes variedades de quesos, particularmente en la elaboración
de tipos de reducida grasa y los elaborados a partir de leche ultrafiltrada,
con el objetivo de realzar el sabor o para reducir el amargor que suele presentarse
en éstos (Johnson, 2003, Collins, et al., 2004; Castañeda, et al,
1990; Callagan & Roos, 2004).
La
literatura señala que los cultivos lácticos y su balance de enzimas pueden ser
modificados mediante tratamientos de atenuación, producto de lo cual las propiedades
de degradación proteolítica requeridas para acelerar la maduración, no se ven
afectadas en forma importante, disminuyendo en cambio su capacidad de formar
ácido, lo que permite evitar interferencias en el proceso normal de producción
de quesos. Entre las metodologías de atenuación que se han intentado para la
modificación de la actividad bioquímica de los cultivos lácticos, se encuentran:
tratamiento térmico alto, tratamiento térmico bajo, uso de solventes
orgánicos, entre otros (Cogan, 2003; El Soda, 2003, Fox, 2003, Rattray, 2003;
Chamba, 2004, Parente & Cogan, 2004).
El
objetivo general de este estudio fue conocer el comportamiento de la cepa Lactobacillus
helveticus CNRZ 32, en cuanto a su viabilidad y capacidad enzimática en
leche, posterior a ser sometida a procesos de atenuación alto y bajo, con el
fin de visualizar su potencial uso en aceleración de maduración de quesos chilenos.
MATERIAL
Y MÉTODO
Cepa
y métodos de atenuación.
La
cepa láctica termófila L. helveticus CNRZ 32, procedente del Centre Nationale
de Recherche Zootecnique, (Jouy - en - Josas, Francia), fue activada desde su
estado liofilizado, en tubos con 5 mL de leche en polvo descremada (reconstituída
al 10% de sólidos totales) y esterilizada por tindalización en frascos estériles,
a 85°C por 30 min y mantenido a 37°C x 24 h en estufa de incubación
termorregulada. Luego se propagó dos veces al 2% en 10 mL de LPD, y se incubó
a 37°C x 12 h, posteriormente se procedió a refrigerarla por un máximo de
dos semanas, para finalmente someterla a los tratamientos de atenuación alto
y bajo, como medio de incubación se utilizó leche en polvo descremada.
Tratamiento
térmico Alto (A): El tubo con 10 mL de LPD conteniendo la cepa se sometió
a temperaturas de 68°C x 18 s, elevando rápidamente la temperatura (1,2
a 1,8 min) por inmersión del tubo en agua hirviendo. Al alcanzar 68°C, se
transfirieron a un baño regulado a 68°C y se mantuvieron por 18 s, luego
el tubo se sumergió en un baño de agua con hielo bajando rápidamente la temperatura
(30 a 36 s), (Frey et al., 1986).
Tratamiento
térmico bajo (B): El tubo con 10 mL de LPD conteniendo la cepa, se depositó
en la cámara congeladora de un refrigerador (-18°C), se mantuvo a -18ºC
por 24 h y se descongeló sumergiéndolo en un baño termorregulado a 40°C
(Aly, 1990).
El
estudio de atenuación de la cepa de L. helveticus CNRZ 32 se realizó
en dos etapas.
Primera
etapa del estudio: su objetivo fue controlar los efectos de la atenuación
sobre la viabilidad de la cepa y las actividades enzimáticas glicolítica, lipolítica
y proteásica, en leche.
Los
parámetros de control de la cepa recién atenuada y las metodologías aplicadas
en esta etapa del estudio, fueron las siguientes:
* Actividad
proteásica: Método de LINDEN et al., modificado por Romero y
Olano, 1993.
* Actividad
lipásica: Metodología de Sigma lipase subtrate.
* Porcentaje
de atenuación: Recuento de L. helveticus. FIL-IDF 149: 1991.
* Actividad
de enzimas glicolíticas: Método de El Abboudi et al., (1991),
determinación de pH al cabo de 8 h de incubación a 37°C a partir de leche
a pH 6,4.
* Determinación
de pH según NCh 1671. Of 79. (Chile, 1979).
Segunda
etapa: su finalidad fue comparar las características de funcionalidad enzimática
durante un período de tiempo en diferentes condiciones de manejo (pH y temperatura)
de la cepa previamente atenuada por los tratamientos térmicos alto y bajo, frente
a un control sin atenuar. Para ello la cepa atenuada fue inoculada en leche
en polvo entera e incubada bajo diferentes condiciones de temperatura y pH.
Se realizaron determinaciones enzimáticas a las 8 h de incubación que permitieron
conocer su capacidad proteolítica, lipolítica y glicolítica en leche, tanto
en las condiciones óptimas de acción del microorganismo como en otras más drásticas,
semejantes a las condiciones de maduración de quesos, donde se pretende aplicarlos
posteriormente.
Para
el estudio de atenuación el cultivo se incubó por 14,5 h a 37°C, donde alcanzó
un crecimiento entre 8 x 108 y 1 x 109 UFC/mL, luego de
lo cual se agregó a tres tubos de 10mL cada uno, para someterlos a los tratamientos
alto, bajo y un testigo de la cepa sin atenuar denominadas A, B y SA respectivamente.
La
evolución de las propiedades enzimáticas se estudió al cumplirse 8 h bajo diferentes
condiciones constantes de incubación: temperaturas de 35 y 25 ºC y pH de 5,2;
5,4 y 6,4.
Condiciones
de evaluación del comportamiento de los cultivos atenuados en la segunda etapa.
Temperatura:
T1: fue cercana a la óptima de desarrollo de L. helveticus,
que corresponde a 35°C y a las condiciones del procesamiento del queso y,
T2, fue de 25°C, que, aunque no siendo óptima en relación a la
temperatura de desarrollo de la bacteria, permite estudiar su comportamiento
a condiciones un poco más cercana a etapas posteriores a la elaboración de quesos:
postprensado, enfriamiento y maduración (Oliviera & Brito, 2006).
pH:
Se usó, pH1: 5.2, similar al pH normal del queso a su entrada
a maduración; pH2: 5,4; correspondiente al pH normal al término de
maduración de quesos semiduros como el Chanco (NCh 2090 Of1999) y pH3:
6,4; pH normal de la leche, a modo de tratamiento testigo. Dichos valores se
encuentran en rangos de pH cercanos al desarrollo de esta cepa aunque su óptimo
es de pH 5,85 (Castañeda et al., 1990).
Metodología
aplicada en la segunda etapa:
*
Proteólisis: Método TNBS,
método de Fields, modificado por Spadaro, descrito por McKellar (1981).
*
Lipólisis: Método de Frankel y Tarassuk modificado en el procedimiento
de extracción por Pillay et al. (1980).
* pH:
Método potenciométrico NCh 1671. Of 1979. (Chile, 1999)
En
ambas etapas, se hicieron tres repeticiones de cada tratamiento y las muestras
fueron analizadas en duplicado.
Análisis
estadístico.
Primera
etapa: se realizó un análisis de varianza simple. En el caso de existir
diferencias significativas (P ≤ 0,05) se procedió a aplicar el Test de
Rango múltiple de Tukey HSD al 95% de confianza para observar diferencias entre
tratamientos.
El
diseño experimental de la primera etapa corresponde a un diseño en bloques de
una variable estudiada en tres niveles.
Segunda
etapa, el diseño experimental corresponde a un diseño en bloques de
tres variables estudiadas, que corresponden a: tratamiento
alto, tratamiento bajo de atenuación y testigo (cepa sin atenuar).
Los
resultados fueron analizados mediante un Análisis de Varianza Multifactorial
de tres vías y Análisis de Regresión Lineal sobre cada una de las respuestas
estudiadas.
RESULTADOS
Y DISCUSIÓN
Primera
Etapa del estudio: Viabilidad y actividad enzimática relativa del L. helveticus
CNRZ32 atenuado por tratamientos alto y bajo, respecto al cultivo sin atenuar.
En
Figura 1, se observa que la viabilidad bacteriana en los tratamientos
Alto (A) y Bajo (B) es menor al control sin atenuar (SA), cuyo análisis de varianza
presenta diferencias significativas (p=0,0004).
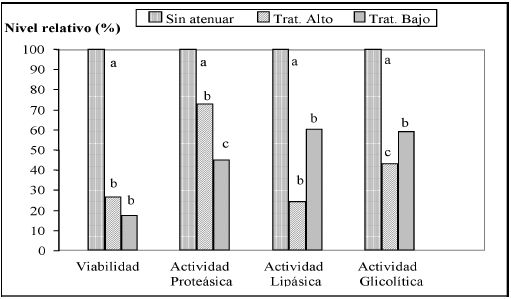 |
| |
Figura
1. Viabilidad, actividad proteásica, lipásica y glicolítica en leche,
del L. helvéticus CNRZ 32 atenuado por tratamiento térmico Alto,
Bajo y sin atenuar.
Figure
1. Viability, proteolytic, lipolytic and glycolytic activity in milk of
L. helveticus CNRZ 32 under high and low attenuated heat treatment
and untreated culture. |
De
acuerdo al Test de Tukey, los tratamientos con atenuación obtuvieron un 73,4%
de mortalidad para el tratamiento A y un 82,5% para el tratamiento B, siendo
estadísticamente similares entre ellos. Frey et al., (1986), obtuvieron
resultados semejantes con respecto al tratamiento alto de atenuación (69ºC/15
s), con una reducción de viabilidad del 65%, además, fue similar a lo obtenido
por Johnson, et al., (1995),
quienes reportaron una reducción de un 85% en la viabilidad de células tratadas
por secado spray a 80°C.
A
pesar que no se presentaron diferencias significativas respecto a la viabilidad
entre los tratamientos Alto y Bajo, en la actividad proteásica se observó una
reducción de sólo un 27.2% en el tratamiento Alto frente al testigo (SA), la
que resulta significativamente menor al tratamiento de atenuación bajo, que
alcanzó pérdidas en su actividad proteásica de un 55.1%. Las diferencias entre
tratamientos concuerdan también con los resultados obtenidos por Frey et
al., (1986), respecto a la actividad dipeptidásica de L. helveticus sometido
a un tratamiento de 69°C/15 s, y a congelación a -20°C por una semana,
cuyos resultados en actividad dipeptidásica fue significativamente menor en
este último respecto a la obtenida por la cepa atenuada a altas temperaturas,
la que resultó similar al control.
Con
respecto a la actividad lipásica de los cultivos, se observa que existen diferencias
entre tratamientos (p=0,0002). Así, el cultivo sometido a -18°C/24 h presenta
una reducción menor en la actividad lipásica, correspondiente a un 39.8%, mientras
que el tratamiento térmico alto la redujo en un 75,6%.
En
la actividad glicolítica de la cepa, se observan diferencias significativas
entre los tres tratamientos, con un valor p=0,0000. De acuerdo a los resultados
del Test de Tukey, los tratamientos produjeron una disminución significativa
de la actividad glicolítica frente al control, con una reducción de un 57% para
la cepa sometida a tratamiento Alto, frente al tratamiento térmico Bajo que
sólo tuvo un 40,9% de reducción.
Los
resultados obtenidos concuerdan con lo estudiado por Frey et al., (1986),
sobre la actividad ≤-galactosidásica de L. helveticus CNRZ 32,
quienes señalan que el calentamiento redujo considerablemente la actividad,
mientras que el enfriamiento a -20°C no causó pérdidas importantes de ésta.
Segunda
Etapa del Estudio: Capacidad proteolítica, lipolítica y glicolítica del Lb.
helveticus CNZR32 atenuado y sin atenuar, incubados bajo diferentes condiciones
de pH y temperatura, cercanas a las condiciones normales de procesamiento de
quesos.
Evolución
de la proteólisis. En la Figura 2, se observa el grado
de proteólisis de los tres tratamientos (8 h de incubación), donde existen diferencias
significativas con un valor de p=0,0160 en la interacción ABC, siendo significativo
el efecto combinado de pH inicial, temperatura de incubación y tratamiento de
atenuación sobre la proteólisis desarrollada.
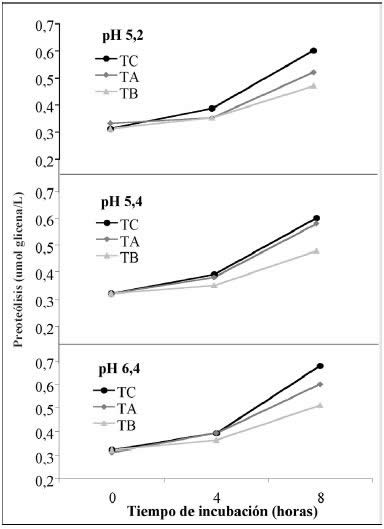 |
| |
Figura
2. Actividad glicolítica, lipolítica y proteolítica de L. helveticus
CNRZ 32 atenuado y sin atenuar, en leche a 25 y 35ºC.
Figure 2. Proteolytic, lipolytic and glycolytic activity of attenuated
L. helveticus CNRZ 32 and untreated culture in milk at 25 and 35ºC |
Los
resultados obtenidos en esta etapa coinciden con los de la etapa I, en que el
mayor grado de proteólisis es desarrollado por el tratamiento control seguido
del tratamiento A (Alto) y por último el tratamiento B (Bajo), todos significativamente
diferentes entre sí, como se dio en el gráfico de interacción.
De
acuerdo al Análisis de Regresión Múltiple, existe un efecto significativo del
P.D. inicial sobre el grado de proteólisis desarrollado después de la incubación,
siendo este mayor a medida que el pH de ajuste del medio de incubación se acerca
al valor neutro. Sin embargo es muy significativo el efecto de la temperatura
de incubación siendo notablemente mayor el grado de proteólisis cuando se incuba
a 35°C que a 25ºC, (Fig. 3) esto se debe a que esta temperatura
es más cercana a
la óptima de crecimiento de L. helveticus y de la producción de enzimas
proteolíticas por la propia cepa. Lo anterior concuerda con los resultados obtenidos
por Ezzat et al., (1982), quienes determinaron que el máximo de actividad
enzimática fue desarrollado a un pH 6.0 de incubación. En general, estudios
realizados con enzimas proteolíticas de L. helveticus han determinado
que presentan su máxima acción en valores de pH cercanos al neutro y a temperaturas
elevadas, las que se aproximan a las óptimas de su desarrollo.
 |
| |
Figura
3. Proteólisis producida por L. helveticus CNRZ 32 atenuado por
tratamiento térmico alto y bajo y cepa sin atenuar, en leche a pH de 5.2,
5.4 y 6.4 en un período de 8 hrs.
Figure
3. Proteolysis produced by L. helveticus CNRZ 32 attenuated
with high and low heat treatment and the culture without treatment in
milk at pH 5.2, 5.4 and 6.4 during 8 hrs. |
Se observa que existe una tendencia al incremento
de la proteólisis a lo largo de la incubación, que es progresiva en el tiempo
para los tres niveles de atenuación. De acuerdo al Análisis de Regresión, la
acción conjunta de los factores tiempo - temperatura de incubación, explican
el desarrollo de la proteólisis en un 61,7% para el tratamiento control, en
61,8% para el tratamiento A y en 58,1% para B (r2= 0,617, 0,618 y
0,581, respectivamente) los restantes porcentajes
se deberían a otros factores, como por ejemplo nivel de organismos viables.
Si bien la proteólisis desarrollada a 35°C
es considerablemente mayor, esta también evoluciona bien a la temperatura menor
estudiada (25°C), en consecuencia se visualizan buenas perspectivas de obtener
los efectos buscados en la maduración de quesos al aplicar estas cepas en su
producción. Además, durante la elaboración se alcanzaron temperaturas cercanas
a la óptima de desarrollo de esta cepa desde la etapa de premaduración de leche
y durante todo el tratamiento en tina en el procesamiento de quesos duros y
semiduros tales como los quesos chilenos Chanco y Gauda (Oliveira & Brito,
2006).
La intensificación y profundización de los cambios
bioquímicos degradativos, como la proteólisis, obtenidos al adicionar cultivos
atenuados, permite lograr una maduración más rápida y realzar propiedades organolépticas
en quesos, tales como sabores, textura, etc. En consecuencia algunos autores
han probado distintas cepas, previamente atenuadas por congelación, en el procesamiento
de diversas variedades de quesos (Spangler et al., 1989; KIM et al.,
1994), también se han estudiado cepas atenuadas por calor, (Castañeda, et
al., 1990; Skeie et al., 1995; Drake et al., 1996; 1997; Fox,
2003; Callagan & Roos, 2004 ) reportando generalmente resultados promisorios
por ambos tratamientos.
En este estudio, realizado en leche, se obtuvo
un elevado contenido de nitrógeno aminoacídico al agregar la cepa de L. helveticus
CNRZ32 junto al cultivo iniciador, similar situación fue reportada por Drake
et al. (1996), así mismo, se observó, tanto en éste como en otros estudios,
que hay problemas derivados de la alta actividad glicolítica al agregarlo sin
atenuar (Callagan & Roos, 2004).
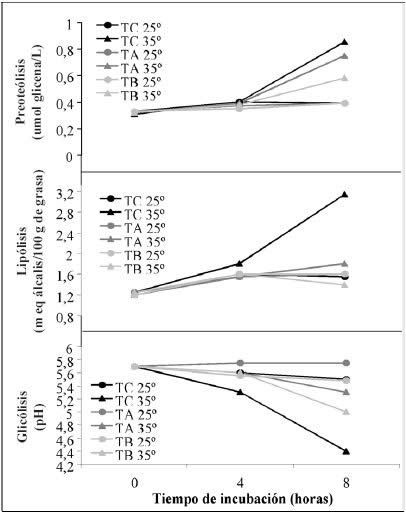
Evolución de la lipólisis. De
acuerdo al análisis de varianza multifactorial, dentro del tiempo de incubación
(8 h) de L. helveticus CNRZ 32 bajo diferentes condiciones de
temperatura, pH y atenuado por dos métodos distintos, se obtuvieron diferencias
significativas en el grado de lipólisis debido a la interacción de los tres
efectos (p=0,0000).
La Figura 4 muestra la evolución
del grado de lipólisis a los diferentes tiempos de incubación estudiados,
según los tratamientos de atenuación y los diferentes valores de pH a los que
fueron ajustados y mantenidos los medios.
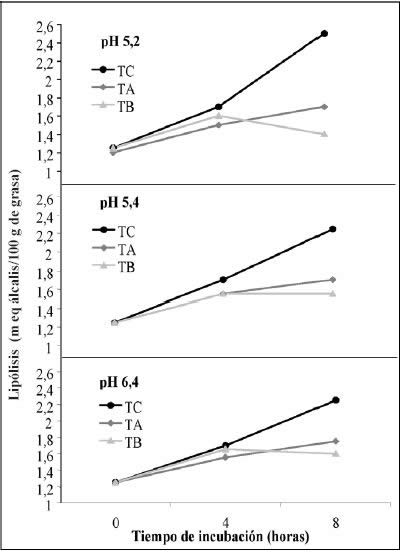
|
| |
Figura
4. Lipólisis producida por L. helvéticus CNRZ 32 atenuado por tratamiento
térmico alto y bajo y cepa sin atenuar, en leche a pH de 5.2, 5.4 y 6.4
en un período de 8 hrs.
Figure 4. Lipolysis produced by L. helvéticus CNRZ 32 attenuated
with high and low heat treatment and the culture without treatment in
milk at pH 5.2, 5.4 and 6.4 during 8 hrs. |
De acuerdo al gráfico de Interacciones e Intervalos
Tukey, se observó que, luego de las 8 h de incubación, el mayor grado de lipólisis
lo alcanzó el cultivo control a los tres niveles de pH. El análisis de regresión
lineal señala que el pH inicial no tuvo efectos significativos sobre la lipólisis
en el período de incubación estudiado. Además, a las 8 h de incubación a 35ºC,
el nivel de lipólisis desarrollado por el control es notablemente superior,
luego bastante más bajo se encuentra el tratamiento alto, también ligeramente
superior al tratamiento bajo.
El Análisis de Regresión para el tiempo de incubación (8 h)
muestra que el efecto de la temperatura es altamente significativo para el control
(p=0,0000 y R2= 93,4%), siendo la lipólisis desarrollada a 35°C
notablemente superior a la desarrollada a temperaturas más bajas. Semejante
comportamiento obtuvo El Soda, (2003), quien indica que la producción de estearasas
intracelulares por L. helveticus no sometido a tratamiento de atenuación,
presenta un óptimo de temperatura de 40 a 45°C, la cual se reduce a sólo
una pequeña actividad estereolítica al incubarlo entre 30 y 35°C.
En el presente estudio, en los tratamientos de atenuación,
el grado de lipólisis presenta diferencias significativas en la interacción
entre los tiempos de incubación, temperatura y pH inicial, con un valor p =
0,0053 para el control y p = 0,0043 para el tratamiento bajo. El tratamiento
alto presenta diferencias significativas en la interacción tiempo - temperatura
y en el efecto principal “pH”. Además el análisis de Regresión Múltiple muestra
que para el tratamiento control son significativos los efectos tiempo y temperatura,
los que combinados explican en un 69,8% el desarrollo de la lipólisis.
La evolución de la lipólisis en el tratamiento alto, resulta
altamente significativo al 99% (p=0,0000), y es explicado por la combinación
de las tres variables en un 72,8% (R2=0,728), por lo tanto, a medida
que alguna de las tres variables presenta un aumento, se incrementa también
el grado de lipólisis. En cambio, en el caso del tratamiento bajo la evolución
de la lipólisis es explicada sólo en un 26% por un aumento del pH y de tiempo
de incubación y, al disminuir la temperatura, el 74% restante del modelo puede
deberse a factores no considerados en este estudio, consecuentemente resulta
difícil predecir la evolución de la lipólisis para este tipo de atenuación.
De acuerdo a los resultados obtenidos en el estudio con leche,
al agregar L. helveticus CRNZ 32, atenuado por tratamiento térmico
alto en quesos semiduros chilenos, como Chanco ó Gauda (3 - 4 semanas de maduración),
cabría esperar un aumento en el grado de lipólisis, pero no se podría asegurar
que se produzca en niveles tales que puedan ser detectables en análisis específicos
o bien en niveles que pudieran producir efectos sensoriales beneficiosos en
Chanco y Gauda, particularmente por la corta maduración normal que presentan
estos quesos.
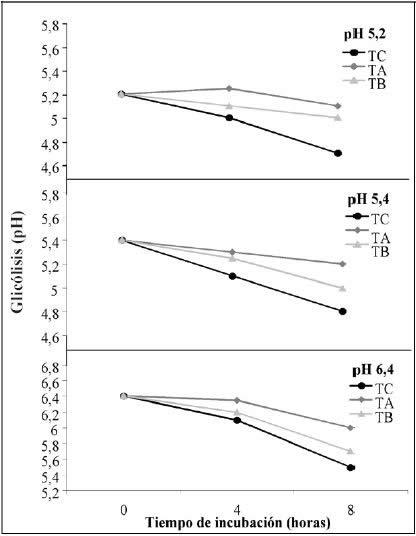
Evolución de la glicólisis (pH). El descenso
del pH, fue progresivo en la medida del avance del tiempo de incubación para
los tres tratamientos y en todos los niveles de pH al que fueron ajustados los
medios (Fig. 5)
 |
| |
Figura
5. Glicólisis producida por L. helveticus CNRZ 32 atenuado por
tratamiento térmico alto y bajo y cepa sin atenuar, en leche a pH de 5.2,
5.4 y 6.4 en un período de 8 hrs.
Figure 5. Glicolysis produced by L. helveticus CNRZ 32 attenuated
with high and low heat treatment and the culture without treatment in
milk at pH 5.2, 5.4 and 6.4 during 8 hrs. |
Dentro del tiempo de incubación estudiado (8 h) en L. helveticus,
se observa según el análisis de Varianza Multifactorial, que existen diferencias
significativas debido a la interacción de los tres efectos (p=0,0000). Dentro
de este tiempo los valores más altos de pH corresponden al tratamiento alto,
seguido del tratamiento bajo y por último el control, todos diferentes entre
sí según intervalos Tukey al 95%.
En la Figura 3 se observa que se presentan
efectos similares bajo las dos temperaturas de incubación, siendo estadísticamente
diferentes entre sí en los dos niveles estudiados, donde se obtienen valores
de pH significativamente inferiores al incubar a 35°C.
Por otra parte hubo interacción significativa (p=0,0000) entre
el tiempo, temperatura de incubación y el pH inicial del sustrato, por lo tanto
los tres factores fueron dependientes en sus efectos sobre la diferencia de
pH, lo que se evidenció en una Regresión Multifactorial muy significativa dentro
de cada nivel de atenuación r2: 82,921; 92,346 y 89,771, para el
tratamiento control, alto y bajo, respectivamente.
Dado que la actividad proteolítica en los quesos está influenciada
en gran medida por su pH, elevados valores de éste aumentan la actividad de
los microorganismos, así como la producción y el accionar de sus enzimas acelerando
los procesos de degradación, en cambio a pH inferiores a 5,0 se reduce notablemente
la velocidad de degradación de los componentes (Brito et al., 2000).
Por ello es que una glicólisis intensa, ocurrida durante el proceso por causa
del cultivo adjunto, incidiría muy negativamente sobre la actividad proteolítica
en la maduración del queso, retardando las degradaciones normales y por ende,
el desarrollo del sabor y textura típicos, por ello es necesario que estas cepas
presenten una baja actividad ≤-galactosidásica. En esta investigación,
y de acuerdo a lo determinado en la primera etapa del presente estudio, el tratamiento
alto de atenuación presenta la menor actividad glicolítica y consecuentemente,
el menor descenso de pH en el tiempo en comparación al control y al tratamiento
bajo de atenuación.
Los resultados obtenidos en esta investigación, con relación
a la evolución del pH en el tiempo, concuerdan con lo obtenido por Johnson et
al. (1995) quienes al elaborar queso Cheddar de bajo tenor graso adicionado
de L. helveticus tratado a 67°C/10 s, no obtuvieron efectos significativos
en el desarrollo de la fermentación, frente a un control sin adición.
Los resultados del estudio de la glicólisis a través de la
evolución de la acidez, manifestaron un comportamiento absolutamente coherente
con el pH. Además, el pH inicial y la temperatura de incubación estuvieron altamente
relacionados con el tiempo en cuanto a la responsabilidad en el aumento de acidez
por la adición del cultivo en estudio.
Por todo lo anterior se esperaría que L. helveticus CNRZ
32, tratado por atenuación alta, al ser adicionado en el proceso de quesos semiduros,
produzca un mínimo descenso del pH, inferior que al adicionar esta cepa sin
atenuar o atenuada por tratamiento bajo, aunque esta última también debería
acidificar menos que el testigo. Lo anterior se debe particularmente a que las
cepas que fueron atenuadas por el tratamiento alto presentan la menor actividad
≤-galactosidásica, reflejada en el nivel de acidificación, significativamente
inferior a los demás tratamientos correspondientes a igual temperatura (35°C).
Más aún, a 25°C la glicólisis se observa totalmente ausente, debido a la
combinación del tratamiento de atenuación con la temperatura de incubación,
en que L. helveticus no encuentra sus condiciones óptimas de desarrollo.
CONCLUSIONES
El tratamiento térmico a 68°C/18 s aplicado sobre la cepa
de Lactobacillus helveticus CNRZ 32 para realizar su atenuación, permite
obtener en leche fluida, el mejor balance entre disminuir la capacidad enzimática
glicolítica y mantener las propiedades enzimáticas proteolíticas y lipolíticas
propias de la cepa, consecuentemente se propone esta metodología de atenuación
al aplicar dicha cepa en producciones que requieren acelerar ó intensificar
los procesos degradativos de maduración como es el caso de los quesos de larga
maduración, los reducidos en grasa, aquellos elaborados con leche concentrada
y otros.
El tratamiento de congelación (-18°C durante 24 h), surge
también como alternativa de atenuación de la cepa L. helveticus CNRZ
32, al presentar menor capacidad de acidificación que el control (sin atenuar),
aunque es evidente que presenta menor eficiencia que la misma cepa tratada por
tratamiento térmico alto en relación a la retención de su capacidad degradativa
frente a la reducción de su capacidad glicolítica desarrollada en leche.
AGRADECIMIENTOS
Al Centre Nationale de Recherche Zootecnique, (Jouy - en -
Josas, Francia), por proveer la cepa de Lactobacillus, a la Dirección de Investigación
DID UACh por proveer fondos para realizar la Investigación.
BIBLIOGRAFÍA
ALY, M.E. 1990. Utilization of Freeze – shocked Lactobacilli
for Enhancing Flavor Development of Ras Cheese. Narhrung 34: 329-335.
BRITO, C.; ASTETE, M.A.; PINTO. M.; MOLINA. L. H. 2000. Maribo
cheese manufactured with concentrated milk: Characteristics, Maturation and
Yield. International Journal of Dairy Technology 53(1): 6-12.
BOCK, S. 1999 Atenuación de Lactobacillus helveticus y
estudio de sus propiedades de glicólisis, proteólisis y lipólisis. Tesis Ingeniero
en Alimentos. Universidad Austral de Chile, Valdivia 112 p.
CALLAGAN, M. L.; ROOS, R. P. 2004. Starter Cultures: Genetics.
In: Fox, P.F., Mc Sweeney, P.H.L.; Cogan, T.M.; Guinee, T.P. (Eds.).
Cheese: Chemistry, Physics and Microbiology. 3th Edit. Vol.1. Cork,
Elsevier Ltd. pp. 149-161.
CASTAÑEDA R., VASSAL L., GRIPON J.C., ROUSSEAU, M. 1990. Accelerated
Ripening of a Saint-Paulin Cheese Variant by Addition of Heat-Shocked lactobacillus
Suspensions. Netherland Milk Dairy Journal 44: 49-62.
CHAMBA, J-F. 2004 Secondary and Adjunct Cultures. In:
Fox, P.F., Mc Sweeney, P.H.L.; Cogan, T.M.; Guinee, T.P. (Eds.).Cheese: Chemistry,
Physics and Microbiology. 3th Edit. Vol. 1. Cork, Elsevier pp. 191-206
CHILE, INSTITUTO NACIONAL DE NORMALIZACION INN. 1999. Productos
lácteos. Queso Chanco. Requisitos. Norma Chilena 2090 Of 99.
CHILE, INSTITUTO NACIONAL DE NORMALIZACIÓN. INN. 1979. Leche
y productos lácteos. Determinación de pH. Norma Chilena 1671 Of 79.
COLLINS,Y .F; McSWEENEY, PLH; WILKINSON, M .G. 2004. Lipolysis
and catabolism of Fatty acids in cheese. In: Fox, P.F., Mc Sweeney, P.H.L.;
Cogan, T.M.; Guinee, T.P. (Eds.). Cheese: Chemistry, Physics and Microbiology.
3th Edit. Vol. 1. Cork, Elsevier pp. 373–389.
COGAN, T.M. 2003. Microbiology of cheeses. In: Roginski,
H.; Fuquay, J.W.; Fox, P.F. (Eds.). Encyclopedia of Dairy Sciences. London Academic
Press pp. 306-314
DRAKE, M.A.; BOYLSTON T.D.; SPENCE, K.D.; SWANSON, B.G.1996.
Chemical and Sensory Effects of a Lactobacillus Adjunt in Cheddar Cheese. Food
Research International 29: 381-387.
DRAKE M.A.; BOYLSTON T.D.; SPENCE K.D.; SWANSON, B.G. 1997.
Improvement of Sensory Quality of Reduced Fat Cheddar Cheese by a Lactobacilli
Adjunct. Food Research International 30: 35-40.
EL ABBOUDI, M.; PANDIAN, S.; TRÉPANIER, G.; LEE B.H. 1991.
Heat-shocked Lactobacilli of Cheddar Cheese Ripening. Journal of Food Science
56: 948-953.
EL SODA, M. 2003. Accelerate Cheese Ripening. In: Roginski,
H.; Fuquay, J.W.; Fox, P.F. (Eds.). Encyclopedia of Dairy Sciences. London,
Academic Press. pp. 327–329.
EZZAT, N.; EL SODA, M.; DESMAZEAUD, M.J.; ISMAIL, A.1982. Peptide
Hydrolases from Thermobacterium Group of Lactobacilli. II. Physiological factors
and enzyme production. Milchwissenschaft 37: 666-668.
FOX, P. F. 2003. Biochemistry of cheese ripening. In:
Roginski, H.; Fuquay, J.W.; Fox, P.F. (Eds.). Encyclopedia of Dairy Sciences.
London, Academic Press. pp. 320–326.
FREY, J.P.; MARTH, E.H.; JOHNSON, M.E.; OLSON, N.F.1986. Heat-and-Freeze-shocking
cause Changes in Peptidase and Protease Activity of Lactobacillus helveticus.
Milchwissenschaft 41: 681-684.
INTERNATIONAL DAIRY FEDERATION. FIL/IDF 149. 1991. Lactic acid
starters. Standard of identity. Belgium. 8p.
JOHNSON ,J.A.C.; ETZEL, M.R.1995. Properties of Lactobacillus
helveticus CNRZ 32 Attenuated by Spray Drying, Freeze Drying of Freezing.
Journal of Dairy Science 78: 761-768.
JOHNSON M E. 2003. Low - Fat cheese. In: Roginski,
H; Fukai, J. W.; Fox, P.F., Mc Sweeny , P.H.L., Cogan, T.M; Guinee, T.P. (Eds.).
Encyclopedia of Dairy Sciences. London, Academic Press. pp. 438–444.
JOHNSON, J.A.C.; ETZEL, M.R.; CHEN, C.M.; JOHNSON, M.E.1995.
Accelerated Ripening of Reduced-fat Cheddar Cheese using four attenuated Lactobacillus
helveticus CNRZ 32 Adjunt. Journal Dairy Science 78: 769-776.
KIM M.S.; KIMS.C.; OLSON, N.F.1994. Effect of Commercial Fungal
Proteases and Freeze-Shocked Lactobacillus helveticus CDR 101 on Accelerating
Cheese Fermentation. II. Proteolysis. Milchwissenschaft 49: 442-445.
MCKELLER, R, C. 1981. Development of off-favors in UHT and
pasteurized milk as a function of proteolysis. Journal of Dairy Science 64:
2139-2145.
Mc SWEENEY, P. L. 2004. Biochemistry of Cheese Ripening: Introduction
and Overview. In: Fox, P.F., Mc Sweeney, P.H.L.; Cogan, T.M.; Guinee,
T.P. (Eds.).Cheese: Chemistry, Physics and Microbiology. 3th Edit.
Vol. 1. Cork, Elsevier pp. 347–360
McSWEENEY, P. L.; FOX, P F. 2004 Metabolism of Residual Lactose
and of Lactate and Citrate. In: Fox, P.F., Mc Sweeney, P.H.L.;
Cogan, T.M.; Guinee, T.P. (Eds.). Cheese: Chemistry, Physics and Microbiology.
3th Edit. Vol.1. Cork, Elsevier pp. 361–371
OLIVEIRA ,M. N.; BRITO, C. 2006. Brined Cheeses and Analogues
of Latin American Chapter 7. In: Tamime, A Y. (Ed.) Brined cheeses.
Society of Dairy Technology Series. London Blackwell publishing. pp. 211–248.
PARENTE, E; COGAN, T. M. 2004. Starter Cultures: General Aspects.
In: Fox, P.F., Mc Sweeney, P.H.L.; Cogan, T.M.; Guinee, T.P. (Eds.).
Cheese: Chemistry, Physics and Microbiology. 3th Edit. Vol.1. Cork,
Elsevier. pp. 123-147.
PILLAY, T., MYRH, A.N.; GRAY, J.L., BIGGS, D.A. 1980. Lipolysis
in milk. II. Effect of milking systems. Journal of Dairy Science 63: 1219-1223.
RATTRAY, F.P.2003.Secondary Cultures. In: Roginski,
H.; Fuquay, J.W.; Fox, P.F. (Eds.). Encyclopedia of Dairy Sciences. London Academic
Press. pp. 275–281
ROMERO, A.; OLANO, C. 1993. Modificación de un método para
determinar la actividad proteásica en leches fluidas. Trabajo presentado en
el X Congreso de la Sociedad de Ciencia y Tecnología de los Alimentos. (SOCHITAL)
Pucón. Chile.
SKEIE. S.; NARVHUS. J.; ARDÖ, Y.; ABRAHAMSEN, R. 1995. Influence
of liposome-encapsulated Neutrase and Hest-treated Lactobacilli on the Quality
of Low-fat Gouda-type Cheese. Journal of Dairy Research 62: 131-139.
SPANGLER, P.L.; EL SODA, M.; JOHNSON, M.E.; OLSON N.F.; AMUNDSON,
C.H.; HILL JR, C.G. 1989. Accelerated Ripening of Gouda Cheese made from ultrafiltered
Milk using a Liposome Entrapped enzyme and Freeze shocked Lactobacilli. Milchwissenschaft
44: 197-264.
UPADHYAY, V.K; Mc SWEENEY, P.L; MAGBOUL, A. A; FOX P .F. 2004
Proteolysis in Cheese during ripening. In: Fox, P.F., Mc Sweeney,
P.H.L.; Cogan.
Recepción
de originales: 7 de julio 2008




