AGRO
SUR 37(1) 60-83 2009
DOI:10.4206/agrosur.2009.v37n1-07
ARTÍCULOS ORIGINALES
ESTRUCTURA POBLACIONAL Y DIVERSIDAD GENÉTICA DE REBAÑOS BOVINOS DE CARNE DEL SUR DE CHILE
Population structure and genetic diversity of bovine meat herds of Southern Chile
MĒ Gabriela Pizarro (1), Fernando Mujica (2), Ricardo Felmer (3)
(1)
Universidad Católica de Temuco, kalufour@yahoo.es.
(2) Universidad Austral de Chile, Casilla
567,
Valdivia.
(3) Instituto de Investigación Agropecuaria,
Carillanca. Casilla 58 D, Temuco.
ABSTRACT
The genetic variability observed in domesticated animal species is progressively disappearing due to breed replacement and introgressions aimed at improving productivity and quality. These actions have eroded important adaptation traits, such as disease resistance and tolerance to harsh environments, usually found in local breeds. Currently, there is not sufficient information to understand the relationships among bovine breeds locally adapted and those of exotic origin and recently introduced. In the last decades, a number of genetic markers have become available to study the genetic diversity in a number of domestic animal species. In the present work, 10 microsatellite markers were used to study the genetic diversity and population structure of 212 bovine individuals (eight genotypes) distributed in several geographical Chilean zones. The microsatellites were amplified using PCR and the fragments were separated electrophoretically using the sequencer ABI PRISM 310. The results showed a clear evidence of population structure among eight bovine genotypes found in southern Chile. Estimate the genetic variability through the calculation of gene frequency allowed heterozigosity per locus to be determined, which varied between 0.61 SPS115 to 0.85 TGLA227. The average heterozigosity of the population was 0.73. According to the PIC, all loci studied were informative, with values that ranged from 0.58 SPS115 to 0.84 TGLA227, with an average population of 0.70. It was concluded that among the microsatellite markers analyzed there was a high degree of polymorphism; the number of alleles per locus in the population varied between nine for the SPS115 marker and 19 for the TGLA122 and INRA23 markers, respectively. In this way, the genetic analysis carried out revealed a high hybridization between beef breeds with subsequent probability of 0.99 and an average Fst (Index of genetic differentiation) in the population of 0.1371 (13.7%), which confirm the high genetic variation existing in the populations studied.
Key words: bovine, microsatellites, PCR, heterozigosity, polymorphism, genetic diversity.
RESUMEN
La variabilidad genética presente en especies animales domesticadas ha desaparecido progresivamente debido, en gran parte, a la sustitución de razas y cruzamientos dirigidos destinados a incrementar la productividad y calidad de los productos animales. Lo anterior, ha erosionado características adaptativas presentes en razas locales, tales como resistencia a enfermedades y tolerancia a climas adversos. Actualmente, no existe información suficiente que permita comprender las relaciones genéticas entre los genotipos bovinos localmente adaptados y aquellos exóticos introducidas con posterioridad al país. En las últimas décadas ha existido un notorio aumento en la disponibilidad de marcadores genéticos destinados al estudio de la diversidad genética de especies domesticadas. En este estudio, 10 marcadores microsatélites fueron utilizados para estudiar la diversidad genética y estructura poblacional en un total de 212 individuos (ocho genotipos) distribuidos en diferentes zonas geográficas del país. Los microsatélites fueron amplificados mediante reacciones PCR y los fragmentos amplificados separados electroforéticamente en un secuenciador automático ABI PRISM 310. El estudio describió la estructura poblacional y diversidad genética en ocho genotipos. La determinación de la variabilidad genética mediante el cálculo de frecuencia génica permitió estimar la heterocigosidad por locus que varió entre 0,61 para el marcador SPS115 y 0,85 para el marcador TGLA227, obteniéndose una heterocigocidad media de la población de 0,73. Según el PIC (Contenido de información polimórfica) todos los loci estudiados fueron informativos, encontrándose que para la población de animales analizados los rangos variaron entre 0,58 para el marcador SPS115 y 0,84 para el marcador TGLA227, con un promedio de la población de 0,70. Se concluyó así que dentro de los marcadores microsatelitales analizados se encuentra un alto grado de polimorfismo, variando el número de alelos por locus en la población entre nueve para el marcador SPS115 a 19 para los marcadores TGLA122 e INRA23. De esta forma, el análisis genético realizado evidenció una elevada hibridización entre las razas de carne, con una probabilidad posterior de 0,99 y un promedio de Fst (Indice de diferenciación genética) en la población de 0,1371 (13,7%), lo que confirma una alta variación genética entre las poblaciones analizadas.
Palabras clave: bovinos, microsatélites, PCR, heterocigocidad, polimorfismo, diversidad genética.
INTRODUCCIÓN
El proceso constante de domesticación y mejoramiento genético de animales ha permitido la selección de fenotipos con mejores atributos que han formado una población en constante crecimiento. La variabilidad o diversidad genética hace posible la adaptación de los animales a enfermedades, parásitos, diversas condiciones climáticas, de alimentación y otros factores como las cambiantes exigencias del mercado (Mujica, 2005). La pérdida de la diversidad genética no sólo pone en riesgo la desaparición de ciertas razas tradicionales o nativas, sino que además limita los progresos del mejoramiento genético a desarrollarse en el futuro (Barker, 1999). La genética molecular ofrece actualmente una serie de herramientas que pueden aplicarse para facilitar la identificación y registro de individuos (Cornide, 2002), en la determinación del grado de consanguinidad (Wright, 1969) y diversidad genética existente entre y dentro de las distintas poblaciones animales, así como también en la estimación de las distancias genéticas (Nei, 1987; Weir, 1996; Beaumont et al., 1998) presentes entre las poblaciones animales y en la definición de sus orígenes y procesos evolutivos (Nagamine y Higuchi, 2001). Para el desarrollo y futuro de una industria animal altamente productiva y competitiva en el entorno mundial, la evaluación, el aprovechamiento y la conservación de la biodiversidad presente en las poblaciones animales resulta fundamental. Por lo tanto, es importante establecer esquemas de evaluación sistemáticos de la capacidad productiva de las poblaciones locales, tanto en aquellas consideradas como razas exóticas, criollas o nativas. Esta información es crucial para la selección de los individuos que pueden formar parte de un futuro banco nacional de los recursos genéticos animales. En tal sentido, la explosión del conocimiento del genoma y las innovaciones tecnológicas que acompañan este conocimiento (marcadores moleculares) han abierto la posibilidad para la caracterización de la diversidad genética de poblaciones animales, y al mismo tiempo para la selección directa de animales que lleven la mejor combinación de genes, facilitando de esta forma las decisiones en programas de mejoramiento y selección de genotipos.
De esta forma, el objetivo de este estudio fue evaluar la diversidad genética y estructura poblacional de ocho genotipos de bovinos del Sur de Chile, empleando para ello un panel de 10 marcadores microsatélites específicos del bovino. La comparación de estos genotipos permitirá contribuir al conocimiento genético de la especie, aportando información sobre las variantes alélicas, genotípicas, heterocigosidad por locus, contenido de información polimórfica (PIC) y la estimación de la diversidad genética en poblaciones de ganado destinados a la producción de carne y leche. Con esta información, se espera entonces establecer una base genética que permitirá la comparación de estas razas con otras razas que han sido o que están siendo actualmente introducidas en el país.
MATERIALES Y MÉTODOS
Muestreo de animales
Se recolectaron 212 muestras de pelo correspondientes a animales de ocho genotipos bovinos de la Región de La Araucanía, Región de Los Lagos y Región de Aysén General Carlos Ibáñez del Campo, entre las que se incluyeron el Overo Colorado de Vilcún (OCV, 25 Animales), Overo Colorado de Coyhaique (OCC, 15 Animales), Clavel de Carne Chileno (CC, 18 Animales), Angus Rojo (AR, 16 Animales), Hereford (HERF, 27 Animales), Charoláis (CH, 20 Animales), Overo Negro (ON, 52 Animales) y Holstein Friesian (HF, 39 Animales). Los animales fueron debidamente identificados mediante el número de crotal asignado por el productor y un número de laboratorio correlativo asignado por el investigador. Las muestras de pelo (mayor a 20 unidades) se obtuvieron, con la ayuda de un alicate, directamente desde el lomo, cruz, flancos y/o paleta de animal, teniendo el cuidado de que contenga el folículo piloso que es donde se encuentran las células nucleadas y por lo tanto el ADN. Estas muestras fueron almacenadas en bolsas individuales de papel debidamente rotuladas y llevadas para su análisis al Laboratorio de Biotecnología Animal de INIA - Carillanca. Las muestras fueron conservadas a 4° C hasta su procesamiento.
Extracción del ADN a partir de muestras de pelo
El protocolo usado para este estudio fue establecido previamente en el Laboratorio de Biotecnología Animal de INIA - Carillanca. Se seleccionaron 10 pelos con folículo piloso visible de cada animal, los cuales se lavaron brevemente con agua destilada y se cortaron a 1 cm del bulbo. Estas muestras se dispusieron en un tubo Eppendorf, al cual se le agregaron 100 uL de "tampón de lisis de pelo" (Tween 20 0,5 %, NP-40 0,6%, MgCl2, 5 mM, Tris-HCL 10 mM, pH 8,3, KCl 50 mM) y 0,6 uL de proteinasa K (20 mg mL-1). Las muestras se incubaron a 60° C por 1 h en un termomixer (Eppendorf) con agitación de 800 r.p.m. y luego durante 15 min a 99°C, para inactivar la proteasa. Antes de ser utilizada para su amplificación mediante PCR, se centrifugó la muestra por 2 min a 14.000 r.p.m., para separar las impurezas.
Elección de microsatélites y amplificación mediante la técnica de PCR
Para el análisis genético se utilizaron 10 micro-satélites recomendados por la Sociedad Internacional de Genética Animal (ISAG; http://www.isag.org.uk/) (ETH3, TGLA122, TGLA227, BM1824, ETH10, ETH225, BM2113, INRA23, SPS115, TGLA126), los que fueron marcados con los fluoróforos Hex, Fam y Ned para su análisis en el secuenciador automático. Para el análisis de microsatélites se utilizó la técnica de PCR (Reacción en cadena de la polimerasa) la que permite amplificar grandes cantidades de una región particular de ADN, a partir de una pequeña cantidad original de ADN, gracias al uso de dos secuencias cortas e informativas de oligonucleótidos, denominadas "partidores" que son específicos de la región que se quiere amplificar. Estos microsatélites se amplificaron en tres reacciones múltiplex en un termociclador (Perkin Elmer modelo 9700), para evitar la manipulación de un mayor número de muestras, disminuyendo así el riesgo de contaminación. Cada reacción de PCR (volumen final 20 uL) contenía entre 20 ng a 100 ng de ADN genómico, utilizado como templado, dNTPs 100 uM, MgCl2 1,5 mM, partidores (0,1 mM a 0,3 mM dependiendo del partidor), tampón de PCR 1 X y 1 U de ampliTaqGold ADN polimerasa (Applied Biosystems). Las condiciones de reacción incluyeron una etapa inicial de denaturación del ADN por 5 min a 94° C, seguido de 35 ciclos de amplificación consistentes en: denaturación por 1 min a 94° C, hibridación por 1 min a 55° C (o 62° C dependiendo del partidor) y elongación por 1 min a 72° C, para terminar con una etapa de extensión de 10 min a 72° C.
Análisis de microsatélites en secuenciador automático
El análisis de los microsatélites amplificados por PCR se realizó mediante un secuenciador automático de electrofóresis capilar y detección fluorescente ABI PRISM 310 de Applied Biosystems. El sistema discrimina los fragmentos de ADN por tamaño y por la fluorescencia que emite el fluoróforo. Los resultados se analizaron por medio del software de análisis GeneScan (Applied Biosystems).
Análisis genético de los datos
Una vez recolectados los datos en el secuenciador ABI PRISM 310, se elaboró una planilla con el cual se incluyó la información de los tamaños y números de alelos obtenidos (genotipos) en los animales, para cada uno de los microsatélites analizados, agrupados de acuerdo a la raza de cada animal. En aquellos casos en que no se pudo disponer de información para un alelo determinado, se le asignó un valor arbitrario (9), valor que sería posteriormente interpretado por el Software de análisis, como dato perdido. La frecuencia alélica se calculó por conteo simple, mediante la división entre el número de alelos obtenidos y la sumatoria de éstos. La heterocigosidad (H) se estimó mediante la formula de Nei y Roychoudhry (1974), mientras que el PIC se calculó según la formula descrita por Botstein et al., (1980). Los datos poblacionales obtenidos fueron analizados mediante los programas PAUP3.0 (Phylogenetic Analysis Using Parsimony) y Structure 2.2. El programa Structure pone en práctica un método a base de modelo de agrupamiento para deducir la estructura de población usando datos genotípicos. Pritchard et al., (2000), y Falush et al., (2003). Sus aplicaciones incluyen la deducción de la presencia de poblaciones distintas, para asignar individuos a las poblaciones, estudiar y estimar frecuencia de alelos de la población en situaciones donde están muchos individuos mezclados. El programa PAUP3.0, fue elaborado por el profesor David L. Swofford (Laboratorio de Sistemática Molecular, Instituto Smithsoniano Washington, DC). Incorpora la gran mayoría de los algoritmos para la elaboración de árboles genéticos y filogenéticos, según los criterios de distancia y parsimonia. Los datos analizados fueron previamente identificados por raza y número asignado por el investigador, los tamaños de alelos obtenidos para cada microsatélite, Las bandas fueron identificadas con un patrón de números de acuerdo a la forma de codificación binaria 0, 1 y -, indicando para cada caso la presencia, ausencia o falta de dato, respectivamente.
RESULTADOS Y DISCUSIÓN
Heterocigosidad y Contenido de información polimórfica (PIC)
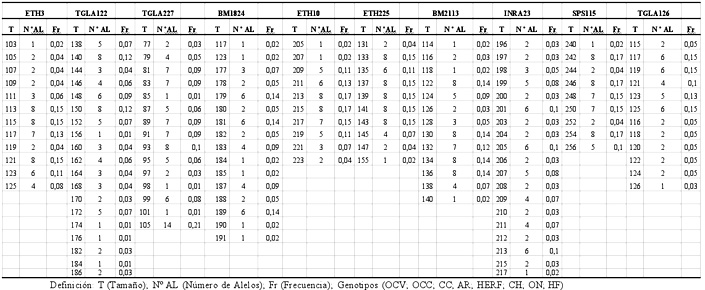
En los 212 animales analizados se encontraron un total de 135 alelos para los 10 loci microsatélites empleados. Como se muestra en el Cuadro 1, todos los microsatélites analizados presentaron polimorfismo, variando el número de alelos por locus en la población entre 9 (SPS115) y 19 (TGLA122 e INRA23). En cuanto a los microsatélites con mayor polimorfismo presente entre las poblaciones, se puede destacar los micro-satélites TGLA122 e INRA23 que presentaron entre tres a 10 alelos más que el resto de los microsatélites. La frecuencia alélica promedio encontrada en la población de las razas fue de 13,5 alelos por locus. Estos datos concuerdan con lo descrito por Brenneman et al. (2006), quienes encontraron un promedio de 12 alelos por locus en razas bovinas y se correlacionan con lo obtenido por otros autores con estos mismos microsatélites (Bedoya et al., 2001; Zamora et al., 2004). Mediante el genotipado de las diferentes razas analizadas se puede destacar que los valores de la heterocigosidad por locus varían entre 0,61 para el microsatélite SPS115 y 0,85 para el microsatélite TGLA227 (Cuadro 2). Estos datos se diferencian con los encontrados por Machugh et al., (1994), quienes obtuvieron valores de heterocigosidad comprendidos entre 0,55 y 0,80 en razas europeas bovinas, aunque en este caso, los autores emplearon un panel distinto de microsatélites. La heterocigosidad media de la población fue 0,73 (Cuadro 2), lo cual está dentro del rango de valores previamente publicados por Moazami-Goudarzi et al., (1997), quienes obtuvieron un valor de 0,70 utilizando 17 microsatélitales en 10 razas de bovinos europeos. Por otro lado resulta superior al valor descrito por Del Bo et al., (2001), en un total de 13 razas europeas del área alpina. Valores similares fueron estimados por Zamorano et al., (1998), en la raza española berrenda en negro.
Microsatélites |
 |
Definición:
T (Tamaño); N° AL (Número de Alelos); Fr (Frecuencia); Genotipos
(OCV; OCC; CC; AR; HERF; CH; ON; HF) |
A nivel de raza, se puede observar en el Cuadro 2 que la heterocigosidad promedio varió entre los rangos 0,66 en la raza CH y 0,76 en las razas OCV y CC, de lo cual se puede inferir que probablemente no existirían problemas de consanguinidad en los grupos de animales estudiados. Con respecto al PIC (contenido de información polimórfica), índice que evalúa la informatividad de cada microsatélite en la población de acuerdo a las frecuencias de sus alelos, se puede observar que todos los loci estudiados fueron altamente informativos, encontrándose rangos entre 0,58 para el marcador SPS115 y 0,84 para el marcador TGLA227, con un promedio de la población de 0,70 (Cuadro 2).
Análisis de parsimonia
De acuerdo al análisis de parsimonia (Figura 1), se pudo establecer que los animales tienden a agruparse en relación a su respectiva raza, formando clusters o grupos, Sin embargo, se encontraron grupos o clusters conformados por individuos pertenecientes a distintas razas de bovino. Un aspecto interesante de destacar es que las razas específicas de carne; AR, CH, HERF y un grupo de animales CC, se encuentran concentradas en un gran cluster o grupo, el cual se diferencia notoriamente del resto de las razas, tales como HF, ON, OCV y OCC, las cuales tienen una tendencia o especialización hacia la producción de leche. Uno de los grupos con mayor grado de pureza en la muestra correspondió al AR, el cual a excepción de dos animales (AR 162 y AR 169), concentró la mayoría de los animales en un único cluster, que a su vez se encontraba claramente diferenciado del resto.
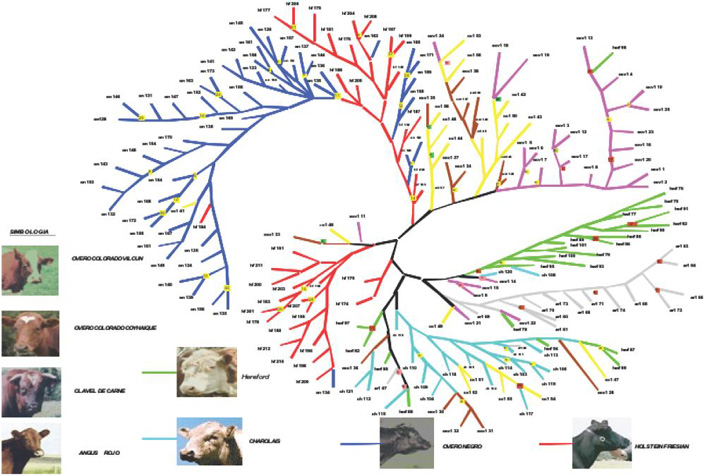 |
Figura
1. Dendograma de siete razas de ganado bovino del sur de Chile. Figure 1. Dendogram of seven races of cattle from the South of Chile. |
Análisis de estructura poblacional
El análisis poblacional realizado a todos los animales empleando el programa Structure, indicó que el número de subpoblaciones que mejor explicaría el patrón genético presente en las razas de bovinos evaluadas fue K=7 (Probabilidad posterior=0,94; Figura 2). Las subpoblaciones encontradas correspondieron, en general, a las razas incluidas en el análisis. Dado que el objetivo general de la investigación era entender la relación genética existente entre las razas de carne, el análisis de estructura poblacional fue repetido sólo en animales pertenecientes a las razas OC, CC, HERF, AR y CH (Figura 3). De acuerdo a este nuevo análisis, las probabilidades de los datos aumentaron hasta K=5 (0,999), estimándose por tanto cinco subpoblaciones para todos los individuos de carne analizados. De esta forma, las seis poblaciones incluidas en este estudio quedaron finalmente distribuidas en cinco clusters o grupos definidos por colores de acuerdo a la siguiente clasificación (Figura 4). En color rojo (Cluster 1) se incluyeron mayoritariamente animales de la raza AR, en verde (Cluster 2) animales de las razas OCC y CC, en azul (Cluster 3), animales de la raza CH, en amarillo (Cluster 4) animales de la raza HERF y finalmente en color rosado (Cluster 5) animales de la raza OCV. De acuerdo a este análisis, se pudo establecer la existencia de dos poblaciones de animales con un alto grado de pureza, correspondientes a las razas AR (Cluster 1) y HERF (Cluster 4), para las cuales el índice de diferenciación genética (Fst) obtenido fue de 0,212 y 0,171, respectivamente. De todas formas, en ambos grupos fue posible también observar animales con un alto grado de influencia de otras razas (>80%), principalmente de CH (Figura 4; barras de color azul en Cluster 1). Por otro lado, se encontró evidencia de panmixia en la población de animales del Cluster 2 (Fst 0,069), confirmando la alta variación genética existente entre los dos grupos de animales que constituyeron este cluster, el cual quedó representado por las razas OCC y CC (Figura 4). En ambos grupos, es posible evidenciar una fuerte influencia de la raza CH (barras de color azul), siendo ésta influencia más fuerte en el CC, sugiriendo que la raza CH contribuyó de forma importante al establecimiento de la base genética, al menos en esta población de individuos analizados. Otro aspecto interesante del análisis, es que el grupo de individuos de la raza OCC quedó en un grupo claramente diferenciado del OCV, lo cual se puede explicar por la lejanía existente entre estos dos grupos de animales de la misma raza y a la nula relación genética de los ancestros que participaron seguramente en el establecimientos de ambos núcleos (Figura 4). El análisis evidenció la presencia de dos grupos de animales correspondientes a las razas OCV y CH, los cuales presentaron un grado intermedio de diferenciación genética (Fst 0,104 y 0,127), quedando representados por los Clusters 5 y 3, respectivamente (Figura 4). Finalmente, el promedio de Fst obtenido en la población fue de 0,137 (13,7%) lo que indicaría una variación genética entre las poblaciones analizadas. Estos datos concuerdan con estudios previos realizados en razas europeas donde se encontraron valores de diferenciación racial de 8%-11% (Mac Hugh et al., 1998, Kantanen et al., 2000, Cañon et al., 2001), aunque se diferencian claramente de un estudio realizado recientemente por Brenneman et al. (2006), quienes obtuvieron un valor promedio de Fst de 0,238 en cuatro razas bovinas (Angus, American Brahman, Senepol y Romosinuano).
Figura
2. Análisis de probabilidad posterior de K (subpoblaciones) de toda
la población, incluyendo razas de doble propósito. Figure 2. Probability analysis of subsequent K (subpopulations) for the entire population, including dual-purpose breeds. |
CONCLUSIONES
La variabilidad genética estimada para los microsatélites permitió confirmar que dentro de los ocho genotipos estudiados existe polimorfismo, encontrando 135 alelos por locus para los 10 loci microsatélitales analizados, los que variaron según el número de alelos por locus en la población entre nueve para SPS115 y 19 para TGLA122 e INRA23, respectivamente.
∑ El análisis de parsimonia realizado permitió establecer que los animales tienden agruparse en relación a sus respectivas razas formando cluster o grupos claramente diferenciables entre sí. Además, el análisis reveló que las razas Overo Colorado de Vilcún y Overo Colorado de Coyhaique se encontraban en grupos diferenciados.
∑ Según la relación genética, se pueden destacar dos genotipos con un alto grado de pureza, las que corresponden a las razas Angus Rojo y Hereford, en los cuales se obtuvo un índice de diferenciación genética (Fst) de 0,212 y 0,171, respectivamente. Además, se encontró evidencia de panmixia en las razas Overo Colorado de Coyhaique y Clavel de Carne Chileno con una diferenciación genética (Fst) de 0,069, lo que indica la alta variación genética existente entre las poblaciones.
BIBLIOGRAFIA
Baker, C.M.; Manwell, C.1980. Chemical classification of cattle. I. Breed groups. Animal Blooding Groups Biochem Genetics 11: 127-150.
Barker, J.S.F. 1999. Conservation of livestock breed diversity. AGRI 25: 33-43.
Beaumont, M.A.; Ibrahim, K.M.; Boursot, P.; Bruford, M.W. 1998. Measuring Genetic Distance. In Karp, A., Isaac, P.G.; Ingram, D.S. (eds.). Molecular Tools for Screening Biodiversity: Plants and Animals. London, Chapman and Hall. pp. 315-326
Bedoya, G.; Carvajal, L.G.; Bermúdez, N.R.; Moreno, F.L. 2001. Estructura molecular y poblacional del ganado Criollo Colombiano (GCC). Revista Colombiana Ciencia Pecuaria 14: 107-118.
Brenneman, R.A.; Chase Jr, C.C.; Olson, T.A.;Riley, D.G.; Coleman, S.W. 2006. Genetic diversity among Angus, American Brahman, Senepol and Romosinuano cattle breeds. Animal Genetics 38:50-53.
Botstein, D.; White, R.L.; Skolnick, M.H.; Davies, R.W.. 1980. Construction of a genetic linkage map in man using restriction fragment length polymorphisms. American Journal of Human Genetics 32: 314-331.
Buchanan, F.C.; Adams, L.J.; Littlejohn, R.P.; Maddox, J.F.; Crawford, A.M. 1994. Determination of evolutionary relationships among sheep breeds using microsatellites. Genomics 22: 394-403.
Cañon, J.; Alexandrino, P.; Bessa, I.; Carleos, C.; Carretero, Y. ; Dunner, S.; Ferran, N.; Garcia, D.; Jordana, J.; Laloë, D.; Pereira, A.; Sanchez, A.; Moazami-Goudarzi, K 2001. Genetic diversity measures of local European beef cattle breeds for conservation purposes. Genetics Selection and Evolution 33: 311-332.
Cornide, M.T. 2002. Marcadores moleculares: Nuevos horizontes en la genética y la selección de las plantas. La Habana, Cuba, Editorial. Félix Varela. 367 p.
Cushwa, W.T.; Medrano, J.F. 1996. Applications of the random amplified polymorphic DNA (RAPD) assay for genetic analysis of livestock species. Animal Biotechnology 7(1): 11-31.
Cruz-Coke M. R. 2003. Valoración de trabajos clásicos en la historia de la genética. Revista médica Chile 131(2):220-224.
Del Bo, L.; Polli, M.; Longeri, M.; Ceriotti, G.; Looft, C.; Barre-Dirie, A.; Dolf, G.; Zanotti., M. 2001. Genetic diversity among some cattle breeds in the Alpine area. Journal of Animal Breeding Genetics 118: 317-325.
El Portal Veterinario de Chile. 2003a. Razas Charoláis. Disponible en http://www.veternet.cl. Leído el 17 de julio de 2007.
El Portal Veterinario de Chile. 2003b. Razas Holando Europeo. Disponible en http://www.veternet.cl. Leído el 17 de julio de 2007.
Falush, D.; Stephens, M.; Pritchard, J.K. 2003. Inference of population structure using multilocus genotype data: linked loci and correlated allele frequencies. Genetics 164: 1567-1587.
Grosclaude, F. ; Aupetit, R. ; Lefebvre, J. ; Meriaux, J.C. 1990. Essai d'analyse des relations genetiques entre les races bovines françaises â l'aide du polymorphisme biochimique. Genetics 22: 317-338.
Gwakisa, P.S. ; Kemp, S.J. ;Teale. A.J. 1994. Characterization of zebu cattle breeds in Tanzania using RAPD markers. Animal Genetics 25:89-94.
Kantanen, J.; Olsaker, I.; Holm, L. E.; Lien, S.; Vilkki, J.; Brusgaard, K.; Eythorsdottir, E.;Danell, B.; Adalsteinsson, S 2000. Genetic diversity and population structure of 20 North European cattle breeds. Journal of Heredity 91: 446-457.
Machugh, D.E.; Loftus R.T.; Bradley, D.G.; Sharpand, P.M.; Cunningham, P 1994. Microsatellite DNA variation within and among European cattle breeds. Proceeding Biological Sciences 256(1345): 25-31.
MacHugh, D.E.; Loftus, R.T.; Cunningham, P.; Bradley, D.G.. 1998. Genetic structure of seven European cattle breeds assessed using 20 microsatellites markers. Animal Genetics 29: 333-340.
Moazami-Goudarzi, K., Laloe, D.; Furet, J.P.; Grosclaude. F. 1997. Analysis of genetyc relathionships between 10 cattle breeds with 17 microsatellites. Animal Genetics 28: 338-345.
Mujica, F. 2005. Diversidad, conservación y utilización de los recursos genéticos animales en Chile. Instituto de investigación agropecuarias, Osorno, Chile. Boletin INIA N° 137. 124p.
Nagamine, Y.; Higuchi. M. 2001. Genetic distance and classification of domestic animals using genetic markers. Journal of Animal Breeding Genetics 118: 101-109.
Nei, M.; Roychoudhry, A.K. 1974. Sampling variance of heterozygosity and genetic. Genetics 76: 379-390.
Nei, M. 1987. Molecular evolutionary genetics. New York,Columbia University Press, New York. 333 p.
Pritchard, J.K.; Stephens, M.; Donnelly, P. 2000. Inference of population structure using multilocus genotype data. Genetics 155:945-959.
Scherf, B.D. 1995. World watch list for domestic animal diversity. 2nd Edition. Rome, FAO 37 p.
Smith, E.J.; Jones, C.P.; Bartlett, J.; Nestor. K.E. 1996. Use of randomly amplified polymorphic DNA markers for the genetic analysis of relatedness and diversity in chickens and turkeys. Poultry Science 75: 579-584.
Swofford, D.L. 2002. PAUP*: Phylogenetic Analysis Using Parsimony (*and Other Methods), Version 4. Sinauer Associates, Sunderland, Massachusetts.
Tautz, D. 1989. Hypervariability of simple sequences as ageneral source for polymorphism markers. Nucleic Acids Research 12: 4127-4138.
Tuñon, M.J.; Gonzales, P.; Vallejos, M. 1989. Genetics relathionship between 14 native spanish breeds of goats. Animal Genetics 20: 205-217.
Uribe, H.A.; Smulders, J.P. 2004. Estimación de parámetros y tendencias fenotípicas, ambientales y genéticas para características de producción de leche en bovinos overos colorados. Archivo médico veterinario 36: 137-146.
Van Zeveren, A.; Bouquet, Y.; Van Der Weghe, A.; Coppieters.W. 1990. A genetic blood marker study on four pig breeds. I. Estimation and comparison of within-breed variation. Journal Animal Breeding Genetics 107: 04-112.
Weir, B. S. 1996. Intraspecific differentiation. In Hills, D.N. (ed.). Molecular Systematics. 2nd edition, Sunderland, M.A. Smauer Associates. pp 385-403.
Wright, S. 1969. Evolution and the genetics of populations. The theory of gene frequencies, USA, University of Chicago Press. Vol. 2 266 p.
Zamorano, M.J.; Ruiter, J.; Rodero, J.A; Vega-Pla,
J.L. 1998. Análisis genético de marcadores microsatélites en dos poblaciones
de la raza bovina Berrenda en Negro. Archivos de Zootecnia 47: 195-200.
Zamora, M.; Ginés, R.; Afonso, J.M.; Reig, M.; García, L.; Zamorano.
M.J. 2004. Caracterización genética de la raza bovina Canaria utilizando
microsatélites:
estudio preliminar. Archivo Latinoamericano Producción Animal
12: 12-15.
Zanotti, C.; Gandini, G.C.; Leone, P. 1990 Genetic variation and distances of five Italian native sheep breeds. Animal Genetics 21: 87-92.
Recepción originales: 14 de octubre de 2008