Agro
Sur 38(1) 1-7 : 2010
DOI:10.4206/agrosur.2010.v38n1-01
ARTÍCULOS ORIGINALES
AISLAMIENTO E IDENTIFICACIÓN DE HONGOS EN COMPOST ELABORADO A PARTIR DE RESÍDUOS SÓLIDOS URBANOS
ISOLATION AND IDENTIFICATION OF FUNGI IN COMPOST FROM MUNICIPAL SOLID WASTE
Yamilka Pérez Bocourt 1, Rocío Rebollido Ríos 2, Jorge Martínez Silva 3
1 Instituto
de Investigaciones de Sanidad Vegetal, Calle 110 no. 514 % 5ta B y 5ta F. Playa.
Ciudad de La Habana, Cuba. Email yperez@inisav.cu
Tél: (537) 202 2517 Fax: (537) 202-9366.
2 Instituto
Superior de Tecnologías y Ciencias Aplicadas.
3 Facultad
de Biología, Universidad de la Habana.
ABSTRACT
Municipal Solid Waste (MSW) compost is one of the biofertilizers used in Cuban urban agriculture programs. Recently its use has increased. Nevertheless, the information about the species of microorganisms that it contains and their beneficial action is limited. The aim of this work was to determine the fungal species present during the composting process. Several substrates were used: plant waste, paper and cardboard, organic waste, yagruma (Cecropia spp.) leaf, fruit, vegetables and food remains. The substrates were placed in a compost reactor with a capacity of approximately 91 L. Samples were analyzed by serial dilutions. Fungi were isolated using Potato Dextrose Agar (PDA) with antibiotics and incubated at 30 and 40 °C. Species were identified using cultures, morphological characters and taxonomical guides. Several fungal species of interest to Cuban agriculture were found, the most important being: Alternaria alternata, Trichoderma harzianum, T. longibrachiatum and Ulocladium atrum. This is the first time that the latter species has been reported to be present in MSW compost in Cuba.
Key words: compost, Municipal Solid Waste, MSW, fungi, Ulocadium atrum.
RESUMEN
El compost elaborado a partir de Residuos Sólidos Urbanos (RSU), es uno de los biofertilizantes utilizado como alternativa en los programas de agricultura urbana en Cuba. En los últimos años su uso se ha visto incrementado. Sin embargo, la información acerca de las especies microbianas que en él podemos encontrar y la utilidad que estas pueden tener aún no es suficiente. El objetivo de este trabajo fue determinar las especies fúngicas presentes durante el proceso de compostaje. Los sustratos utilizados fueron hierba de jardín, papel y cartón, hojas de yagruma, desechos orgánicos, frutos, vegetales y restos de comida, los que fueron colocados en un reactor de compostaje de 91 L aproximadamente. Las muestras fueron analizadas según el método de las diluciones seriadas, para el aislamiento de los hongos se utilizó Agar Papa Dextrosa (PDA) con antibióticos y fueron incubados a 30 y 40 °C. La identificación de los aislamientos se realizó según los caracteres morfológicos y culturales utilizando claves taxonómicas de identificación. Fueron aisladas varias especies fúngicas de interés para la agricultura cubana, entre las cuales, las más relevantes son: Alternaria alternata, Trichoderma harzianum, T. longibrachiatum y Ulocladium atrum, siendo este último el primer reporte en compost elaborado a partir de RSU en Cuba.
Palabras claves: compostaje, Residuos Sólidos Urbanos, RSU, hongos, Ulocladium atrum.
INTRODUCCIÓN
Los fertilizantes orgánicos son actualmente una alternativa de creciente demanda en la agricultura moderna debido a la concientización de los problemas ambientales y al incremento de la producción de alimentos orgánicos. En Cuba se producen anualmente más de 22495,3 Miles de Toneladas métricas de fertilizantes orgánicos (IIS, 2009) los que se obtienen principalmente a través de los procesos de lombricultura y compostaje. Este último también se utiliza para el tratamiento de residuos sólidos urbanos (RSU) lo que resulta atractivo porque, a través de la descomposición de la basura orgánica, se obtiene abono orgánico y se eliminan parte de los residuos generados en la ciudad cerrando el ciclo de la materia orgánica de forma sostenible (Aguilera, 2005).
Durante el proceso de compostaje la degradación de los sustratos tiene lugar debido a la presencia de varios grupos de microorganismos. Entre los mismos se encuentran los hongos filamentosos, típicamente saprobios, aunque también pueden aparecer patógenos a las plantas y/o animales, y posibles agentes de control biológico (ACB) (Anastasi et al., 2005). La intervención de los hongos en el proceso de compostaje, de forma general, es favorable sin embargo; el análisis de la micobiota presente el compost es una herramienta para evaluar la calidad del mismo, sus riesgos y beneficios.
Los hongos juegan un papel fundamental a lo largo del proceso de compostaje, son capaces de utilizar varias fuentes de carbono, pueden sobrevivir en condiciones extremas y participan activamente en la fase de maduración (Miller, 1996). Estos organismos pueden aparecer en todas las fases del proceso (Ryckeboer et al., 2003), participan en la descomposición de polímeros complejos como son: la celulosa, hemicelulosas, pectinas, lignina permitiendo que las bacterias continúen con la descomposición de los sustratos (Rebollido et al., 2008).
La composición de las comunidades fúngicas presentes en el compost están asociadas a los diferentes sustratos y métodos utilizados en el transcurso de la composta (Peters et al., 2000). El conocimiento de las poblaciones fúngicas que están presentes en este fertilizante orgánico es de vital importancia para determinar su calidad y posibles aplicaciones posteriores, la micobiota presente en el compost es un indicador de la calidad del producto final, pues los hongos pueden favorecer la fertilidad del suelo, estimular el crecimiento de las plantas y sus mecanismos de defensa (Harman, 2006; Contreras-Cornejo et al., 2009), además cuentan con una gran plasticidad metabólica que les permite degradar polímeros complejos como el petróleo, plásticos entre otros, es por ello que actualmente se utilizan en la recuperación de ambientes contaminados (Munnecke y Huysmans, 1998).
Este trabajo se realiza con el objetivo de determinar las especies fúngicas presentes durante un proceso de compostaje a pequeña escala. Estos resultados pueden ser utilizados en otras producciones de compost ya sea a pequeña o gran escala.
MATERIALES Y MÉTODOS
El reactor de compostaje utilizado para este estudio se ubicó en el área del Instituto Superior de Ciencias y Tecnologías Aplicadas (ISCTN), en una nave techada, con dimensiones de 54 cm x 35 cm x 48 cm, lo que representa un volumen de 91 L, éste contenía orificios por sus cuatro lados para permitir la aireación natural. Los sustratos empleados fueron: hierba de jardín 2020 g, papel y cartón 1860 g, hojas de yagruma (Cecropia spp.) 1790 g y desechos orgánicos, frutos, vegetales, desechos de comida, 3310 g. La máxima temperatura alcanzada a lo largo del proceso fue 60,3 °C, el pH del producto final fue 7,5.
Toma y procesamiento de muestras
Se tomaron muestras diarias de 50 g de la mezcla durante la primera semana, luego estos muestreos se realizaron, una vez por semana hasta que se completaron los 100 días que duró el proceso, además se monitoreo la temperatura de la pila de compost y se relacionó con las unidades formadoras de colonias por gramo de sustrato analizado (UFC/g). Dichas muestras fueron procesadas según el método de las diluciones seriadas, y fueron sembradas alícuotas de 100 μl en PDA con sulfato de estreptomicina 0,50 % y rosa de Bengala 0,25 %. Una parte de las placas se incubaron a 28 ± 2 °C, mientras que la otra se incubó a 40 ± 2 °C. A partir de las colonias fúngicas encontradas se realizaron cultivos monospóricos para garantizar la pureza de cada aislamiento obtenido.
Para calcular UFC/g se utilizó la fórmula:
Identificación de los aislamientos y cálculo de la frecuencia relativa.
La determinación específica de los aislamientos se realizó con la ayuda de las siguientes claves taxonómicas de identificación (Raper y Fenell, 1965; Ellis, 1976; Carmichael et al., 1980; Samuels et al., 2009) y consultas a las descripciones originales. Para ello se hicieron preparaciones fijas, en polivinil alcohol y/o lactofenol en los casos en que fue necesario se añadió el colorante azul algodón para teñir la pared celular y lograr el contraste adecuado, para observar las estructuras. Fueron observados de 30-35 conidios, conidióforos, fíalides, clamidosporas, entre otras estructuras por cada espécimen identificado, también se consideró el color, la apariencia y ornamentación de cada una de ellas, además de los caracteres culturales.
La frecuencia relativa de aparición de los diferentes taxones encontrados se calculó según la siguiente fórmula:
Fotografías con microscopía óptica
Las microfotografías se hicieron de las preparaciones permanentes en un microscopio biológico de campo claro Zeiss Axiolab de fabricación alemana, con una cámara Canon japonesa, el objetivo empleado fue 40x.
RESULTADOS
Fueron realizados un total de 15 aislamientos fúngicos a lo largo de todo el proceso, los cuales fueron nombrados e identificados como se muestra a continuación: aislado H8 Aspergillus flavipes Bain y Sart., H4, H10, H12 Aspergillus terreus Thom, H2, H9 Alternaria alternata (Fr.) Keissler, H1 Penicillium sp. 1, H6 Penicillium sp. 2, H14 Penicillium sp. 3, H3, H7, Trichoderma harzianum Rifai, H5, H15 T. longibrachiatum Rifai. H11, H13, Ulocladium atrum Preuss que resultó ser el primer registro en compost de RSU en Cuba (Figura 1).
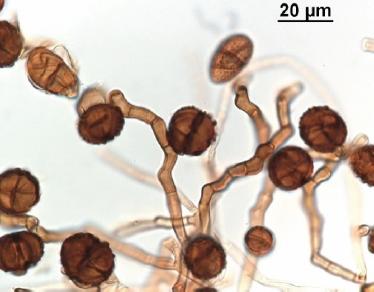 |
Figura
1. Conidios y conidióforos de Ulocladium atrum. Figure 1. Conidia and conidiophores of Ulocladium atrum. |
La sucesión de las poblaciones de hongos durante este proceso se muestra en la Figura 2, donde se aprecia que la mayor cantidad de UFC se presentó al inicio del proceso, en la fase mesofílica, y cae de manera abrupta a medida que aumentan las temperaturas.
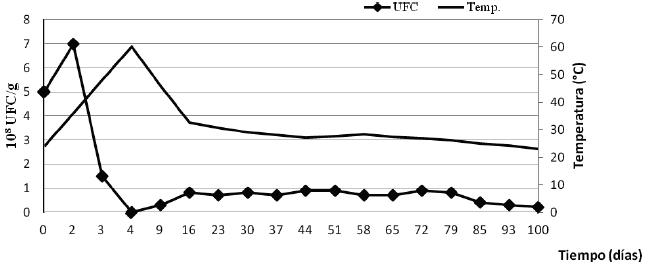 |
Figura
2. Sucesión de las poblaciones de hongos durante el proceso de compostaje
Figure 2. Succession of fungal populations during the composting process. |
Cuando se realizó la identificación de los aislados obtenidos en los diferentes muestreos se observó que solo A. terreus y T. longibrachiatum crecieron a 40 ºC por lo que se consideran termotolerantes. No hubo crecimiento de hongos cuando la pila alcanzó los 60 ºC. El resto de los aislados estuvo presente siempre que las temperaturas fueron inferiores a 40 ºC.
Entre las especies presentes las mayores frecuencias relativas de aparición fueron mostradas por A. terreus con el 22,2 % seguida de T. longibrachiatum que exhibió el 19,6 % mientras que Penicillium sp. fue el menos frecuente con una aparición de 4,3 % como se puede observar en la Figura 3.
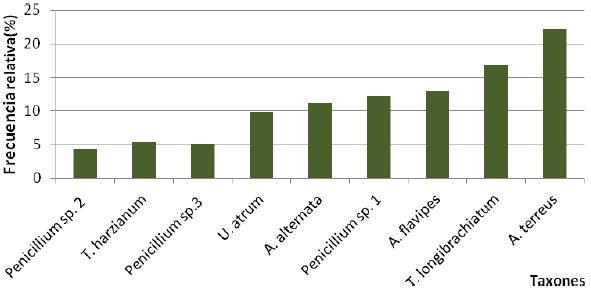 |
| Figura
3. Frecuencias relativas de los taxones aislados en el compost durante
el proceso de maduración. |
DISCUSIÓN
Estos resultados contribuyen a ampliar el conocimiento de la micobiota que participa en los procesos de compostaje a pequeña escala, además de los efectos favorables o no, que pueden tener estos microorganismos una vez que el compost es utilizado como biofertilizante en la agricultura. El incremento de la concentración fúngica evidenciada durante la fase mesofílica del proceso fue influenciado fundamentalmente por la temperatura y el pH. Al inicio del proceso el sustrato se encontraba a temperatura ambiente en este caso comenzó con 24,0 °C y pH 6,8 condiciones favorables para el crecimiento de los hongos. Los restos de comida y vegetales frecuentemente tienen un pH ligeramente ácido entre 4,5-5 que estimula la proliferación de los hongos (Ryckeboer et al., 2003). El 4to día la temperatura alcanzó 60,3 °C y el pH llegó a 8,1 lo que provocó un descenso en la concentración fúngica Figura 2. A partir del día 16 con una temperatura de 32,5 °C y pH 7,3 aumentó la concentración y se mantuvo prácticamente estable hasta el final del proceso.
Durante la fase de maduración e higienización se forman las sustancias húmicas, también pueden ser metabolizadas o inmovilizadas sustancias fitotóxicas, logrando de esta forma un producto estable biológicamente y con baja o nula fitotoxicidad (Varnero et al., 2007).
Desde el punto de vista de las características de cada especie determinada y atendiendo a su participación es necesario señalar que A. flavipes ha sido aislado mayoritariamente de suelos tropicales y subtropicales, materia orgánica en descomposición, y en la fase mesofílica del compost (Upreti y Joshi, 1984). Existen evidencias que demuestran que tiene capacidad al colonizar oosporas de Phytophthora palmivora (E.J. Butler) E.J. Butler y es entomopatógeno de Planococus citri (Risso) (CAB, 2004). Por lo que su presencia en este sustrato se puede considerar beneficiosa.
En cuanto a A. terreus es un hongo cosmopolita, que se aísla con frecuencia de suelo, restos vegetales, compost y vermicompost (Anastasi et al., 2005). Varios autores han informado que puede ser causante de infecciones oportunistas en personas comprometidas inmunológicamente (Hara et al., 1989; Iwen et al., 1998), aspecto este al que debe tenerse en cuenta especialmente por parte del personal que interviene directamente en el proceso. Esta especie se reconoce por su eficiente batería enzimática para degradar compuestos complejos, por lo que se considera favorable su presencia en este sustrato.
A. alternata es muy común, se ha aislado sobre textiles, varias plantas y suelo generalmente como saprobio (Ellis, 1976), sin embargo, tiene gran importancia como agente de pudrición en enfermedades post cosecha de una gran variedad de cultivos: cucurbitáceas (Vakalounakis, 1990), tomate (Bustan et al., 2007), manzana (Reuveni, 2006) entre otros. En Cuba se ha informado entre el grupo de hongos que causa la enfermedad de la panícula sucia del arroz (Neninger et al., 2003), y como patógeno sobre varias especies de pastos y forrajes (González et al., 2006). Es necesario prestar atención ante la presencia de este hongo en este sustrato pues podría ser desfavorable en el cultivo en el cual se utilice como abono.
En cuanto a la presencia de Penicillium spp. también resulta favorable, las especies de este género participan activamente en la mineralización del fósforo orgánico del suelo a través de la producción de fosfatasas ácidas y alcalinas tanto extracelulares como intracelulares (Gómez-Guiñan, 2004), de esta forma posibilitan la absorción de este mineral por las plantas. Además, es conocido que este grupo de hongos también tiene la habilidad de colonizar y degradar gran variedad de sustratos (Domch et al., 1993), lo que contribuye a la fertilidad del suelo.
Referente a T. longibrachiatum las especies de este género son reconocidas a nivel mundial por su actividad antagónica, para lograrlo utilizan varios mecanismos de acción, entre los que se pueden citar la competencia por el espacio y los nutrientes, el micoparasitismo, la antibiosis y la producción de enzimas hidrolíticas (Benítez et al., 2004; Harman, 2006; Woo et al., 2006). Es conocido que las especies de Trichoderma pueden excretar vitaminas al medio que son absorbidas por las raíces de las plantas, y que son capaces de inducir la resistencia sistémica o localizada de las mismas (Benítez et al., 2004; Harman, 2006; Contreras-Cornejo et al., 2009). Esta especie particularmente produce enzimas de los tipos β- glucanasas, xilanasas y celulasas que le confieren una alta plasticidad metabólica, lo que justifica su presencia en ambientes contaminados y con abundante materia orgánica.
La especie U. atrum fue registrada por primera vez en Cuba como saprobio sobre plantas de Saccharum sp. híbrida en la provincia de Holguín (Mercado-Sierra et al., 1997). Anteriormente ha sido informada su presencia en procesos de humificación (Almendros et al., 1985; Minter et al., 2001), pero en Cuba no se ha encontrado anteriormente sobre compost elaborado a partir de RSU.
Estudios recientes han demostrado que U. atrum tiene una potente actividad antifúngica frente a Botritys cinerea Pers. agente causal moho gris de la fresa, B. elliptica (Berk.) Cooke, Alternaria alternata y Magnaporthe grisea (T.T. Hebert) M.E. Barr además tiene una actividad moderada contra Colletotrichum acutatum Simmonds y C. gloesporioides (Penz.) Penz. y Sacc., esto se debe a la producción de un compuesto ciclopeptólido 1 con una alta porción de residuos de aminoácidos N-metilados con acción lopolítica sobre la pared celular (Yun et al., 2007). Otros autores han comprobado su eficacia como biocontrolador del moho blanco del frijol causado por Sclerotinia sclerotiorum (Lib.) de Bary (Huang y Erickson, 2007).
La presencia de estas especies en este sustrato resulta interesante no solo por su participación en el proceso de compostaje sino, porque algunas de ellas pueden ser utilizadas como ACB de varios hongos fitopatógenos, e incrementan el crecimiento vegetal, lo que le confiere otros beneficios al producto obtenido, aspecto este que podría ser objeto de futuros estudios.
CONCLUSIONES
Se determinó un total de seis taxones fúngicos en el compost elaborado a partir de RSU de ellos U. atrum constituye el primer registro para compost obtenido a partir de RSU en Cuba.
La mayores frecuencias relativas de aparición fueron mostradas por A. terreus y T. longibrachiatum.
AGRADECIMIENTOS
Agradecemos la colaboración del Dr. Jorge Martínez Silva de la Facultad de Biología de la Universidad de la Habana y de la Dra. María Ofelia López Mesa del Instituto de Investigaciones de Sanidad Vegetal.
REFERENCIAS
AGUILERA, F.; ARTOLA, A.; SANCHEZ, A.; GEA, M.T.; BARRENA, R. 2005. El compostaje como vía de tratamiento de R.S.U.: Aplicaciones y limitaciones de la tecnología. Ingeniería Química 420: 234-242.
ALMENDROS, G.; MARTINEZ, A.T.; DORADO, E. 1985. Production of green humic-like substances by Ulocladium atrum. Soil Biol Biochem. 17: 257-259.
ANASTASI, A.; VARESE, G.C.; FILIPELLO, V. 2005. Isolation and identification of fungal communities in compost and vermicompost. Mycologia 97: 33–44.
BENÍTEZ, T.C.; RINCÓN, A.M.; LIMÓN, C.; CARBALLO, A. 2004. Biocontrol Mechanisms of Trichoderma Strains. Int Microbiol. 7: 249-260.
BUSTAN, A.; COHEN, S.; ERLICH, O.; TSROR, (LAHKIM) L. 2007. Cladosporium species and Alternaria alternata cause serious post-harvest early calyx decay (PHECD) in truss tomatoes in Israel. NDR. Vol. 15: Feb 2007 to Jul 2007. (Disponible en: http://www.bspp.org.uk/publications/new-disease-reports/reports.php?id=15, consultado 15/12/2009).
CAB International. 2004. Crop Protection Compendium. Wallingford, UK. CAB International.
CARMICHAEL, J.W.; KENDRICK, W.B.; CONNERS, I.L.; SIGLER, L. 1980. Genera of Hyphomycetes. Edmonton, Canadá. The University of Alberta Press. 244 p.
CONTRERAS-CORNEJO, H.A.; MACÍAS-RODRÍGUEZ, L.; CORTÉS-PENAGOS, C.; LÓPEZ-BUCIO, J. 2009. Trichoderma virens, a Plant Beneficial Fungus, Enhances Biomass Production and Promotes Lateral Root Growth through an Auxin-Dependent Mechanism in Arabidopsis. Plant Physiol. 149: 1579-1592.
DOMCH, K.H.; GAMS, W.; ANDERSON, T. 1993. Compendium of soil Fungi. IHW-Verlag, 1264 p.
ELLIS, M.B. 1976. More Dematiaceous Hyphomycetes. Commonwealth Agricultura Bureaux, England. 507 p.
GÓMEZ-GUIÑAN, Y. 2004. Actividad de las fosfatasas ácidas y alcalinas (extracelulares e intracelulares) en hongos de la rizosfera de Arachys hipogea (Papiloneaceae). Rev. Biol. Trop. 52: 287-295.
GONZÁLEZ, G.; LÓPEZ, M.O.; AMAT, Z.; ESTRADA, G.; LÓPEZ, D.; BERNAL, B.; GRANDA, A.; RODRÍGUEZ, G.; FIGUEREDO, L.; PUPO, A.D.; RAMOS, M.; GONZÁLEZ, M.; RUIZ, M.; PÉREZ, I.; NÁPOLES, C.; GARCÍA, G.; SÁNCHEZ, C.R.; BUCHILLÓN, C.; LÓPEZ, M. 2006. Fitopatógenos en los cultivos de pastos y forrajes en Cuba. Fitosanidad 10: 11-18.
HARA, K.S.; RYU, J.H.; LIE, J.T.; ROBERTS, GD. 1989. Diseminated Aspergillus terreus infection in inmunocompromised host. Clin. Proc. 64: 770-775.
HARMAN, G.E. 2006. Overview of Mechanisms and Uses of Trichoderma spp. Phytopathology 96: 190-194.
HUANG, H.C.; ERICKSON, R.S. 2007. Ulocladium atrum as a Biological Control Agent for White Mold of Bean Caused by Sclerotinia sclerotiorum. Phytoparasitica 35: 15-22.
INSTITUTO DE INVESTIGACIONES DE SUELOS (IIS) 2009. Proceso de producción de abonos orgánicos a través del Compostaje y la Lombricultura. En: Curso-Taller nacional sobre manejo de plagas en el sistema de producción. Instituto de Investigaciones de Sanidad Vegetal.
IWEN, P.C.; RUPP, M.E.; LANGNAS, A.; REED, E.C.; HINRICH, S.H. 1998. Invasive pulmonary aspergillosis due to Aspergillus terreus: 12 years experience and review of the literature. Clin. Infect Dis. 26: 1092-1097.
MERCADO-SIERRA, A.; HOLUVÁ-JECHOVÁ, V.; MENA-PORTALES, J. 1997 Hifomicetes demaciáceos de Cuba. Enteroblásticos. Museo Regional de Historia Natural, Monografía 23, Turín. 388 p.
MILLER, F.C. 1996. Composting of Municipal Solid Waste and its components, in: Palmisano A.C.; Barlaz, M. (Edo.). Microbiology of Solid Waste. CRS, USA, Press. pp 115-154.
MINTER, D.W.; RODRÍGUEZ, M.; MENA, J. 2001. eds. Fungi of the Caribbean. An annotated checklist, U.K. PDMS Publishing. 946 p.
MUNNECKE, D.M.; HUYSMANS, K. 1998. Fungal composting processes for polyaromatic hydrocarbons. Annual AAPG Conventions. Salt Lake City, Utah, USA, pp 17-20.
NENINGER, H.; HIDALGO, E.; BARRIOS, L.M.; PUEYO, M. 2003. Hongos presentes en semillas de arroz (Oryza sativa L.) en Cuba. Fitosanidad 7: 1-7.
PETERS, S.; KOSCHINSKY, S.; SCHWIEGER, F.; TEBBE, C. 2000. Succession of microbial communities during hot composting as detected by PCR-Single-Strand-Conformation-Polymorphism-Based genetic profiles of Small-Subunit rRNA genes. Appl. Environ. Microbial. 66: 930-936.
RAPER, K.B.; FENELL, D.S. 1965. The Genus Aspergillus. Ed. USA, Baltimore The Williams y Wilkins Co.686 p.
REBOLLIDO, R.; MARTÍNEZ, J.; AGUILERA, Y.; MELCHOR, K.; KOERNER, I.; STEGMANN, R. 2008. Microbial populations during composting process of organic fraction of municipal solid waste. Appl. Ecol. Environ. Research. 6: 61-67.
REUVENI, M. 2006. Inhibition of germination and growth of Alternaria alternata and mouldy-core development in Red Delicious apple fruit by Bromuconazole and Sygnum. Crop Pretection 25: 253-258.
RYCKEBOER, J.; MEGAERT, J.; COOSEMANS, J.; DEPRINNS, K.; SWINGS, J. 2003 Microbiological aspects of biowaste during composting in a monitored compost bin. J. Appl. Microbiol. 94: 127-137.
SAMUELS, G.J.; CHAVERRI, P.; FARR, D.F.; MCCRAY, E.B. 2009 Trichoderma Online, Systematic Mycology and Microbiology Laboratory, ARS, USDA. (Disponible en: http://nt.ars-grin.gov/taxadescriptions/keys/TrichodermaIndex.cfm, consultada: 22/01/2009).
UPRETI, J.C.; JOSHI, M.C. 1984. Cellulolytic activity of mesophilic and thermophilic fungi isolated from mushroom compost. Indian Phytopathol. 37: 473-476.
VAKALOUNAKIS, D.J. 1990. Host Range of Alternaria alternata f. sp. cucurbitae Causing Leaf Spot of Cucumber. Plant Dis. 74: 227-230.
VARNERO, M.T.; ROJAS, C.; ORELLANA, R. 2007. Índices de fitotoxicidad en residuos orgánicos durante el compostaje. J. Soil Sc. Nutr. 7: 28-37.
WOO, S.L.; SCALA, F.; RUOCCO, M.; LORITO, M. 2006. The Molecular Biology of the Interactions between Trichoderma spp., Phytopathogenic Fungi, and Plants. Phytopathology. 96: 181-185.
YUN, B.S.; KWON, E.M.; KIM, J.C.; YU, S.H. 2007. Antifungal cyclopeptolide from fungal saprophytic antagonist Ulocladium atrum. J. Microbiol. Biotechnol. 17: 1217-1220.
Recepción Originales: 25 de marzo 2010