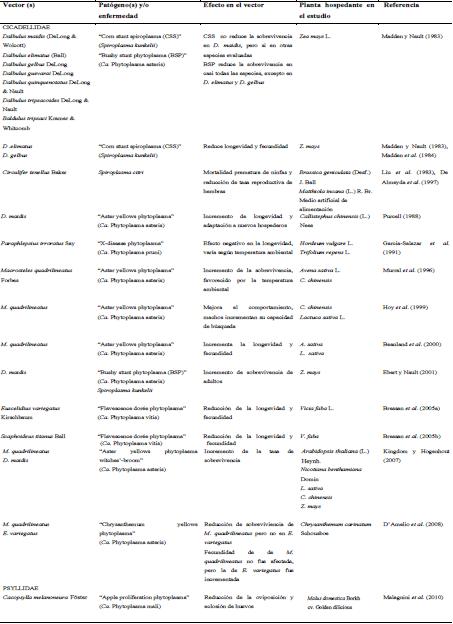
| Cuadro
1. Efecto en el potencial biológico de vectores de Mollicutes
fitopatógenos. |
 |
Agro
Sur Vol. 38(2) 55-67 2010
DOI:10.4206/agrosur.2010.v38n2-01
REVISIÓN DE LITERATURA E INTERPRETACIÓN
MOLICUTES FITOPATÓGENOS TRANSMITIDOS POR INSECTOS: INTERACCIONES Y EFECTOS EN SUS VECTORES
PHYTOPATHOGEN MOLLICUTES TRANSMITTED BY INSECTS: INTERACTIONS AND EFFECTS ON THEIR VECTORS
Nolberto Arismendi S. 1, Roberto Carrillo Ll. 2 , Nancy Andrade S. 2
1
Escuela de Graduados, Facultad de Ciencias Agrarias, Universidad Austral
de Chile.
2
Instituto de Producción y Sanidad Vegetal, Facultad de Ciencias Agrarias,
Universidad Austral de Chile.
ABSTRACT
Phytopathogen mollicutes such as phytoplasmas and spiroplasmas are associated with multiple plant diseases which, in many cases, have economically important effects due to the losses they cause. Research in biology, ecology and phytoplasma/spiroplasma transmission have increased exponentially over the last 20 years, but little information is available regarding interactions and their effects on the transmitters of these pathogens. This review is intended to demonstrate the new advances in this area with up to date information that include relevant cases that have served as models for current studies. Although both spiroplasma and phytoplasma are covered, the information presented is biassed towards the latter, as they have recently been gaining more importance in the country.
Key words: Phytoplasma, spiroplasma, insect vector fitness.
RESUMEN
Molicutes fitopatógenos como espiroplasmas y fitoplasmas están asociados a múltiples enfermedades de plantas, siendo muchas de ellas, de gran importancia económica debido a las pérdidas que provocan. Trabajos sobre biología, ecología y transmisión de estos patógenos se han incrementado exponencialmente en estos últimos 20 años, pero aún se carece de información de las interacciones y sus efectos en quienes los transmiten. Esta revisión pretende dar a conocer avances en este tema con información actualizada, pero también incluyendo casos más relevantes que sirvieron de modelos para los trabajos actualmente desarrollados. Si bien el trabajo abarca espiroplasmas y fitoplasmas, se presenta un sesgo hacia estos últimos, debido a la importancia que han ido cobrando en el país, en este último tiempo.
Palabras claves: Fitoplasma, espiroplasma, potencial biológico de insectos vectores.
INTRODUCCIÓN
La mayoría de los procariontes fitopatógenos no requieren un vector activo para infectar plantas. Para algunas tipos de bacterias patógenas, los insectos vectores pueden ser importantes pero no indispensables para dispersarse a un nuevo hospedero. Para otros procariontes como los de la clase Mollicutes, en los que se incluyen los fitoplasmas y espiroplasmas, los insectos vectores son necesarios para su transmisión, dispersión y multiplicación. La relación entre estos procariontes y sus vectores es más estrecha y compleja la cual puede conducir, en la mayoría de los casos, relaciones específicas entre los molicutes que se transmiten en determinados hospederos. La transmisión persistente y propagativa de estos molicutes les permite sobrevivir en forma prolongada dentro de sus hospederos. Pero esta característica de parásito obligado ha limitado su identificación, como ha ocurrido con los fitoplasmas. En estos molicutes, la obtención de cultivos puros en condiciones in vitro no ha sido posible, lo cual ha conllevado el desarrollo de una serie de técnicas para su detección, identificación, caracterización y las relaciones que pueden presentar con sus insectos vectores. Por otra parte, a la mayoría de los espiroplasmas se han logrado cultivar, lo cual ha permitido realizar estudios más acabados. Así, se ha determinado que las relaciones patógeno-insecto son componentes importantes en la epidemiología de muchas enfermedades en plantas. Además, se ha confirmado que esas relaciones son útiles y a veces esénciales, entre el patógeno y el insecto hospedero. De igual forma, se ha manifestado que insectos considerados vectores, pueden sufrir alteraciones en el potencial biológico por la infección de estos patógenos, las cuales pueden ser favorables, de efecto adverso o simplemente no tener ninguna influencia en el comportamiento (Cuadro 1). Pero también se ha argumentado que dichos efectos pueden estar conjugados con factores ambientales, aislados del patógeno u otro, los cuales pueden intervenir sobre el hospedero, siendo considerados variables muy importantes en la relación insecto-patógeno.
El objetivo de la presente revisión es discutir las interacciones y los efectos que pueden ejercer los molicutes fitopatógenos en sus insectos vectores, pero también conocer algo más de estos patógenos a luz de los reportes recientes y crecientes en Chile, especialmente de fitoplasmas (Herrera y Madariaga, 2003; Fiore et al., 2007; Matus et al., 2008; Gajardo et al., 2009, Andrade et al., 2009; Arismendi et al., 2010), lo cual conduce a poner especial atención en los aspectos biológicos y ecológicos que puedan influir en la transmisión y dispersión de estos patógenos.
GENERALIDADES DE LOS MOLICUTES FITOPATÓGENOS
Las primeras determinaciones de molicutes fitopatógenos coinciden con el desarrollo de técnicas microscópicas y el estudio de enfermedades de inferencia viral. Los primeros molicutes detectados fueron los fitoplasmas a mediados de los 1960. En los trabajos iniciales fueron referidos como microorganismos similares a micoplasmas (“mycoplasma-like-organisms o MLO”) por su similitud morfológica a los micoplasmas, microorganismos parásitos de animales (Lee et al., 2000). Desde entonces, aquellas enfermedades consideradas de origen viral, fueron reevaluadas y muchas de ellas determinadas como de efecto fitoplasmático. A partir de estas determinaciones, la lista de plantas infectadas por fitoplasma ha estado creciendo continuamente, siendo considerados de gran importancia, debido que inducen graves enfermedades en muchas especies de plantas, resultando en pérdidas económicas signifcativas (Bertaccini, 2007). Por otra parte, dentro de los espiroplasmas descritos, sólo tres son considerados fitopatógenos; Spiroplasma citri, S. kunkelii and S. phoeniceum (Regassa y Gasparich, 2006). El primer espiroplasma, S. citri, fue descrito a inicios de 1970 (Saglio et al., 1973), desde entonces, muchos otros espiroplasmas han sido identificados como agentes comensales, simbiontes o patógenos de insectos y animales (Regassa y Gasparich, 2006).
Espiroplasmas y fitoplasmas son un tipo de bacterias caracterizados por un genoma pequeño, bajo contenido de GC y carentes de una pared celular (Cuadro 2) (Bové et al., 2003 y Christensen et al., 2005). Los espiroplasmas están más relacionados con los micoplasmas, microorganismos patógenos en animales y humanos. En cambio, los fitoplasmas son considerados como un clado monoflético dentro de la clase Mollicutes (Lim y Sears, 1992). De cualquier forma, por no ser cultivables, no se les ha asignado formalmente un nombre binomial, estableciendo en su remplazo un taxón provisorio similar a género de “Candidatus Phytoplasma” (“Ca. Phytoplasma”) para aquellos fitoplasmas que han sido descrito molecularmente (IRPCM Phytoplasma/Spiroplasma Working Team -Phytoplasma Taxonomy Group, 2004).
| Cuadro
1. Efecto en el potencial biológico de vectores de Mollicutes
fitopatógenos. |
 |
Como en la mayoría de los molicutes, los fitoplasmas y espiroplasmas se reproducen asexualmente por gemación o fisión binaria (Poncarova-Vorackova et al., 1998 y Miyata y Ogaki, 2006). Estos microorganismos son las únicas bacterias que no tienen una pared celular, lo cual los hace naturalmente resistentes a antibióticos que inhiben la síntesis de esta. Generalmente, en medios artificiales los espiroplasmas presentan una única célula de forma helicoidal (espiral, lo cual le implica el nombre de “spiro”), considerado un componente importante en el desplazamiento de estos microorganismos (Bai, 2004). Pero se ha observado en insectos que la forma puede variar de oval, esférica o helicoidal (Özbek et al., 2003), la cual está determinada por el gen mreB en algunas especies de Spiroplasma, muy similar a lo presente en E. coli (Bové et al., 2003 y Bai et al., 2004). Caso contrario, los fitoplasmas no tienen una forma definida (pleomórficos), cuya condición los favorece para pasar de célula en célula con la ayuda de los fluidos vasculares (Lee et al., 2000; Christensen et al., 2005 y Hogenhout et al., 2008), por lo que sugieren que la ausencia de flagelos u otras estructuras de transporte no son necesarias.
Los molicutes fitopatógenos tienen distintas plantas hospederas. Los espiroplasmas han sido asociados a un rango limitado de plantas, en las que incluyen cítricos, maíz y algunas plantas ornamentales (Bai, 2004). Por otra parte, los fitoplasmas se presentan en un amplio rango de plantas hospederas, incluyendo muchos cultivos de importancia económica alrededor del mundo (Lee et al., 2000). Así mismo, se han reportado infecciones mixtas entre estos molicutes, por ejemplo, S. kunkelii y el fitoplasma del achaparramiento del maíz (“bushy stunt phytoplasma”) comparten la misma planta hospedera (maíz), siendo transmitidos persistentemente por el cicadélido D. maidis (Madden et al., 1984).
| Cuadro
2. Características de los Mollicutes comparado con la bacteria
Escherichia coli. Table 2. Comparison between Mollicutes and Escherichia coli. |
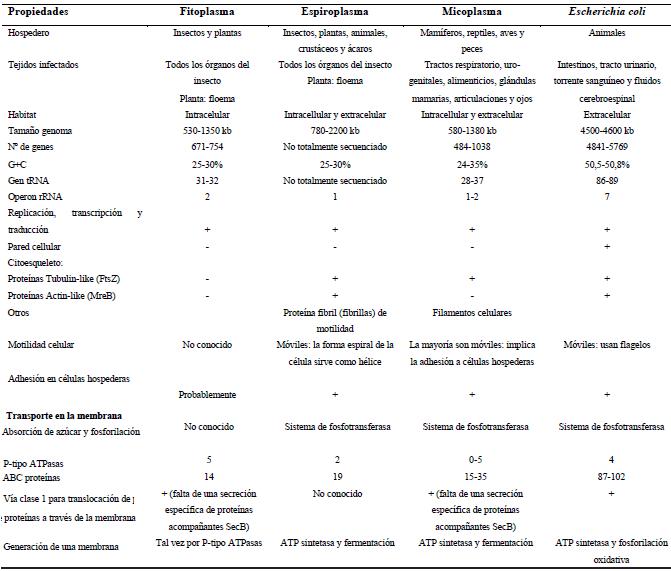 |
| Adaptado de Christensen et al. (2005). |
Tanto los fitoplasmas como los espiroplasmas son microorganismos que se restringen a los tejidos del floema de sus plantas hospederas. El rico contenido de glucosa y fructosa dentro de estos tejidos proveen un suplemento energético (Bai, 2004). Dicha situación provoca un desbalance fisiológico que conduce a la inducción de diversos síntomas en sus plantas hospederas de acuerdo a los grados o mecanismos de virulencia (patogenicidad) del patógeno (Hogenhout y Loria, 2008). Generalmente, los espiroplasmas fitopatógenos inducen clorosis, atrofia con internudos cortos, proliferación de espigas que no maduran y enrojecimiento de estas (Bai, 2004). En contraste, los fitoplasmas causan un variado número de síntomas, por ejemplo; fitoplasmas del grupo “Aster yellows” inducen el retraso y enrollamiento de estructuras, enrojecimiento o amarillamiento de hojas, malformaciones de tipo escoba de bruja, alteraciones florales (transformación de estructuras florales en hojas), clorosis, necrosis, entre otros (Lee et al., 2000).
En estudios previos, ciertos factores fueron reportados y asociados con el desarrollo de enfermedades en plantas causadas por molicutes patogénicos (Daniels, 1983). Frecuentemente, los síntomas causados por fitoplasmas indican una alteración del contenido del floema y un desorden del balance hormonal, por ejemplo, reducción de ácido indolacético, bloqueo de transporte de auxinas, incremento de precursores hormonales, presencia de inhibidores de síntesis de hormonas o alteraciones en el transporte y translocación de hormonas (León et al., 1996; Chang, 1998, Lee et al., 2000 y Bai, 2004). Las alteraciones de las funciones del floema pueden ser causadas por la masiva infección fitoplasmática, la deposición de callosa en el floema, seguido de una necrosis y colapso de los tejidos conductores o los poros celulares y que cuya expresión de síntomas van a depender de la especie de planta y su resistencia (Lee et al., 2000). La deposición de polisacáridos (por ejemplo; callosa), es una respuesta de defensa celular por parte de la planta, pero esta deposición obstruye parcial o totalmente los poros de las células de floema (Lherminier et al., 2003), lo cual podría limitar la circulación normal de fitohormonas, enzimas y carbohidratos.
La infección espiroplasmática (por ejemplo, S. citri) incluye efectos similares a los fitoplasmas, pero también implica otras alteraciones, las cuales incluyen la deposición de toxinas, acumulación de ácido láctico, proteólisis y actividad enzimática de arginina aminopeptidasa (Daniels, 1983; Chang, 1998 y Bové et al., 2003). De igual forma, la clorosis que se presenta en las hojas de plantas infectadas por espiroplasmas y fitoplasmas, se atribuye a la alteración de los pigmentos. La clorofila A, clorofila B y el contenido total de clorofila, como también, el contenido de carotenoides y antocianinas son significativamente menores que en aquellas plantas no infectadas (Chang, 1998 y Bertamini et al., 2003), lo cual sugiere que la infección por estos molicutes causa un estrés generalizado afectando negativamente la actividad fisiológica de plantas hospedantes.
MOLICUTES FITOPATÓGENOS Y SU INTERACCIÓN CON SUS INSECTOS VECTORES
Los espiroplasmas y los fitoplasmas son transmitidos por insectos vectores que se alimentan del floema. Hasta ahora se han relacionado insectos del orden Hemiptera, suborden Homoptera: (Cicadellidae, Cixidae, Cercopidae, Psyllidae y Fulgoridae) como vectores (Bové et al., 2003; Weintraub y Beanland, 2006 y Wilson y Weintraub, 2007). El insecto adquiere estos patógenos de los tejidos del floema, los cuales tienen la capacidad de penetrar la pared celular del intestino medio del insecto para que posteriormente moverse y multiplicarse en grandes cantidades en la hemolinfa, además de otros órganos del mismo insecto. Estos molicutes pueden infectar los tubos de Malpighi, células musculares y nerviosas. También invaden las células de las glándulas salivales, las cuales permiten mediante la saliva, la transmisión de esos molicutes al floema de plantas sanas durante el proceso de alimentación (Bové et al., 2003; Regassa y Gasparich, 2006; Weintraub y Beanland, 2006 y Hogenhout et al., 2008). Una vez que el insecto vector adquiere estos patógenos debe existir un periodo de incubación (periodo latente) para que ese insecto esté habilitado para transmitirlo (Christensen et al., 2005). Este periodo es variable, principalmente por las condiciones térmicas presentes, pero para fitoplasmas, puede durar hasta 80 días (Weintraub y Beanland, 2006) y entre 15 a 20 días para espiroplasma (Bové et al., 2003). Además, estos molicutes son de carácter persistente y propagativo dentro de sus insectos vectores, es decir, una vez que el insecto hospedante los adquiere, estos patógenos se multiplican y mantienen constantemente dentro del vector, siendo potencialmente infectivos por el resto de su vida (Purcell, 1982 y Fletcher et al., 1998), lo cual facilita la dispersión de los patógenos a nuevos hospederos (Bové et al., 2003 y Weintraub y Beanland, 2006).
La transmisión de estos molicutes por insectos, envuelve diferentes niveles de relaciones de especificidad de hospedero-patógeno y probablemente, sea considerada una interacción altamente específica, ya que para que la transmisión ocurra, estos fitopatógenos deben penetrar el intestino y las barreras de las glándulas salivales del insecto. El hecho de no pasar alguna de estas barreras resulta en un fracaso del proceso de transmisión (Fletcher et al., 1998 y Yu et al., 2000). En ese proceso de transmisión, puede presentarse diferentes grados de especificidad, en donde un aislado (“strain”) puede ser transmitido por una o muy pocas especies de vectores, lo cual involucra una relación más estrecha. Pero también, una especie de vector puede transmitir uno a varios aislados de éstos patógenos, lo que conduce a una relación menos específica y con diferentes grados de eficiencia de transmisión (Fletcher et al., 1998). Así se ha demostrado, por ejemplo en fitoplasmas, que no todos los vectores son capaces de transmitir todos los tipos de fitoplasmas, debido a la complejidad de eventos durante el proceso de transmisión y la especificidad entre la proteína de la membrana fitoplasmática (IDP) y la presencia de receptores en células del tracto intestinal u otro órgano del insecto vector (Kakizawa et al., 2006 y Suzuki et al., 2006). Dichas proteínas han sido estrictamente relacionadas con uno o varios fitoplasmas, lo cual sugiere que existe un alto grado de especificidad pero divergente según las características de los grupos (Kakizawa et al., 2006). Dicha situación puede explicar en parte, que numerosos fitoplasmas tienen una baja especificidad-vector, por lo que pueden ser transmitidos por diferentes especies de insectos. Por ejemplo; fitoplasmas del grupo 16SrI (“Aster Yellows”) son transmitidos por al menos 24 especies de cicadélidos (Christensen et al., 2005).
De igual forma, se ha demostrado que los espiroplasmas también presentan mecanismos que les permita favorecer su relación con sus insectos vectores. Existe evidencia que en la mayoría de los espiroplasmas, la espiralina es la proteína más abundante y uno de los principales antígenos en la superficie de la membrana (Bové et al., 2003). Se cree que por estar localizada en la superficie, esta proteína puede jugar un rol importante en la interacción planta-insecto vector, aunque su mecanismo preciso no está totalmente claro (Duret et al., 2003). También se ha visto que otras proteínas, tales como la P89, ubicada en la superficie de S. citri, juega un rol preponderante en la adhesión a las células del vector C. tenellus (Yu et al., 2000). Por otra parte se ha demostrado que otras estructuras similares a fibrillas o pili (complejo de filamentos proteicos en la superficie celular) presentes en S. kunkelii, pueden estar involucrados en la adhesión y virulencia en los insectos vectores (Özbek et al., 2003 y Ammar et al., 2004). Aún más, se ha observado en los extremos de las células de este espiroplasma, estructuras en forma de punta, las cuales pueden ser muy importantes en la penetración de las células epiteliales del intestino medio del vector (Ammar et al., 2004).
En esta relación insecto-espiroplasma, por ejemplo, se ha probado que algunos aislados de S. citri se pueden multiplicar activamente en la hemolinfia, pero no pueden ser transmitidos por su insecto vector a las plantas. Por ejemplo, S. citri cepa “Israel”, pudo mantenerse por 10 años en plantas de vincas (C. rosea) mediante un sucesivo ciclo de injerto y sin incluir el insecto vector (C. tenellus), pero cuando se incluyó el vector en el ciclo de infección, el aislado perdió su habilidad de ser transmitido por C. tenellus, aunque dicho espiroplasma continuó siendo altamente fitopatógeno (Bové et al., 2003). Esto demuestra que barreras dentro del mismo insecto limitan el paso de estos fitopatógenos y que dicha relación entre insecto vector-molicutes y el paso por esas barreras pueden estar controlados por determinantes genéticas (Bové et al., 2003 y Hogenhout et al., 2008).
La transmisión de estos molicutes fitopatógenos a la progenie no está totalmente clara, pero se ha establecido mediante técnicas moleculares, que algunos fitoplasmas pueden ser transmitidos a la progenie del vector (Hanboonsong et al., 2002). Por otra parte, no se han presentado evidencias que la transmisión transovarial sea uno de los mecanismos habituales en los espiroplasmas fitopatógenos. Sin embargo, otras especies de Spiroplasma pueden ser transmitidos en la siguiente generación a través del embrión, los cuales son conocidos como microorganismos que afectan la relación de sexos en la progenie, provocando muchas veces, la muerte de machos en las hembras infectadas (Gasparich, 2002). Ejemplos de ellos son la muerte de machos en Adalia bipunctata L. o Drosophila melanogaster Meigen por el efecto de espiroplasmas (Hurst et al., 1999 y Montenegro et al., 2005), aunque también es debido a la presencia de otras tipos de bacterias como Wolbachia (Hurst y Jiggins, 2000).
EFECTOS DE LOS MOLICUTES FITO-PATÓGENOS EN SUS INSECTOS HOSPEDEROS
La mayoría de los trabajos reportados sobre molicutes fitopatógenos abarcan los efectos que tienen éstos sobre sus plantas hospederas. Situación que es respaldada por la importancia que gozan muchas de estas plantas como cultivos. Pero también, se han reportado trabajos, aunque en menor cantidad, sobre el efecto que ejercen estos molicutes en sus insectos vectores, asociados principalmente, con su potencial biológico. Así se ha demostrado que aislados de fitoplasma del grupo Aster Yellows y uno de sus principales vectores, M. quadrilineatus Forbes, han sido utilizados como un modelo ideal en la determinación de los efectos de estos procariontes en el potencial biológico de este insecto vector. Bealand et al. (2000) determinaron que al exponer a dos aislados de Aster Yellows, uno de éstos, provocaba un incremento en longevidad (o sobrevivencia) y fecundidad de hembras M. quadrilineatus criados en plantas de avena y lechuga. Aunque el otro aislado también afectó positivamente la longevidad, pero no en el número de individuos en la progenie comparado con aquellas hembras que no estaban infectadas.
Otro caso en que mejora el potencial biológico, es referido al cicadélido especialista del maíz, D. maidis. Por ser un insecto que se alimenta y reproduce casi exclusivamente de maíz, su sobrevivencia es reducida en otras especies no relacionadas a su hospedero. Sin embargo, Purcell (1988) reportó que D. maidis no sobrevive en plantas sanas (no infectadas con fitoplasmas) de aster chino, pero cuando individuos de esta especie fueron criados en aster chino infectados con varios aislados de fitoplasmas del grupo Aster Yellows, su periodo de vida (longevidad) se incrementó en forma significativa. Una vez que los individuos de D. maidis son infectados con alguno de los aislados, estos cicadélidos pueden alimentarse y sobrevivir en plantas no infectadas de aster chino, lo cual sugiere que los fitoplasmas tiene una ingerencia en la adaptación de los insectos vectores a nuevos hospederos, lo cual puede estar relacionado con un periodo de acondicionamiento en plantas infectadas (Purcell, 1988).
Por otra parte, se ha demostrado que el efecto del fitoplasma en su vector no siempre es mutualista, sino que puede llevar a provocar un efecto patogénico con consecuencias negativas en el potencial biológico de dicho vector. Recientemente Malagnini et al. (2010) han reportado que el fitoplasma de la proliferación del manzano ("Candidatus Phytoplasma mali") influyó negativamente en la oviposición y eclosión de huevos de su vector, C. melanoneura, en donde las hembras que permanecían en plantas enfermas de manzanos ovipositaron menos huevos y muchos de estos no eclosionaron como sí ocurrió en aquellas hembras que permanecieron en plantas sanas. Aunque diferencias en la longevidad de C. melanoneura no fue posible detectar en individuos infectados y no infectados con este fitoplasma. Caso similar, Bressan et al. (2005a) evaluaron, en condiciones de laboratorio, la influencia de dos aislados del fitoplasma de la flavescencia dorada ("Flavescence dorée") inoculadas en haba y observaron que la infección por estos aislados redujo significativamente la longevidad y la fecundidad del vector experimental, E. variegatus. Igualmente, las hembras expuestas a plantas infectadas produjeron menor número de ninfas que aquellas hembras que se alimentaron de plantas no infectadas de haba (control), aunque muy similar cuando se alimentaban exclusivamente de maíz, lo cual propone que el tipo de alimento también podría tener algún efecto en un insecto polífago como E. variegatus, ya que la permanencia en un solo hospedero puede provocar una reducción en el potencial biológico comparado con aquellos que viven en una variada gama de hospederos (Bressan et al., 2005a). Se podría pensar que como E. variegatus no es considerado el vector natural de Flasvencence dorée, no existiría una relación estrecha entre el fitoplasma-vector y por lo tanto, el efecto del fitoplasma en este insecto es más patogénico que mutualista. Pero se ha demostrado que el principal vector de este fitoplasma, S. titanus, un especialista en Vitis spp., sufre efectos similares que E. variegatus, es decir, el potencial biológico de S. titanus se ve reducido cuando están infectados con aislados del fitoplasma de la flasvescencia dorada (Bressan et al., 2005b), lo cual sugiere que existe una asociación limitada entre el fitoplasma y S. titanus.
De igual forma, la infección de estos molicutes en los insectos vectores puede tener diversos efectos de acuerdo a las especies de insectos que la transmite. Madden y Nault (1983) reportaron que el fitoplasma del achaparramiento del maíz ("bushy stunt phytoplasma"), tiene menor efecto patogénico en la sobrevivencia de D. gelbus que en otras especies de Dalbulus, tales como D. maidis y D. elimanatus, considerados vectores primarios de este patógeno. Caso contrario, el "corn stun spiroplasma" (S. kunkelii), no tiene efecto o efecto reducido pero no significativo en la longevidad y fecundidad de D. maidis, pero sí en D. eliminatus y D. gelbus, afectando significativamente en la reducción del tiempo medio (50%) de la sobrevivencia, en donde la mitad de los adultos de estas especies y otros Dalbulus, mueren prematuramente comparado con aquellos individuos no infectados. De igual forma, se presenta un menor número de ninfas por hembras en la progenie de D. eliminatus y D. gelbus comparado con individuos no inafectados con S. kunkelii, cuyo efecto no se ve reflejado en la progenie de D. maidis infectados (Madden et al., 1984). También se ha reportado que S. citri tiene efecto patogénico en su vector, causando muerte en las poblaciones jóvenes (ninfas) de C. tenellus (Liu et al., 1983). Así mismo, un estudio similar ha demostrado que la tasa reproductiva de las hembras adultas se vio reducida comparada con hembras no infectadas con este espiroplasma (De Almeyda et al., 1997). Por lo tanto, Madden y Nault, (1983) y Madden et al. (1984) en sus trabajos reflejan que el efecto que pueden ejercer en general, un fitoplasma o un espiroplasma sobre especies de Dalbulus es más patogénico, pero concuerdan con Ebbert y Nault (2001) que el efecto de dichos molicutes sobre el principal vector (D. maidis) es más mutualista, situación que puede estar relacionada con el flujo génico de estos patógenos y sus vectores, además de las condiciones ambientales, tales como la temperatura. Este último factor ha sido considerado un componente importante en el comportamiento del molicute dentro de sus insectos vectores, situación que ha sido poco clara y relevante para espiroplasmas como el S. kunkelii y su vector D. maidis (Madden et al., 1984). Sin embargo, Madden et al. (1984) reportaron que el fitoplasma del achaparramiento del maíz reduce en forma significativa la longevidad de D. maidis si son sometidos a temperaturas de 20 a 29ºC. Situación contraria a lo reportado por Garcia-Salazar et al. (1991), quienes mencionan que el vector P. irroratus infectado con el fitoplasma "X-disease", provoca efectos patogénicos en la longevidad cuando las temperaturas son menores de 20ºC, pero no en temperaturas que varíen de 25 a 30ºC, las cuales no diferen su efecto significativamente comparado con P. irroratus no infectados. Aunque dichas temperaturas por si solas, tienen un efecto perjudicial en la sobrevivencia de esta especie. No obstante, se ha reportado que la relación fitoplasma temperatura también puede favorecer la longevidad, como ha ocurrido en el caso de M. quadrilineatus infectado con cepas de fitoplasmas de grupo Aster Yellows, en donde los individuos expuestos a 25 y 30ºC, sobreviven más días que aquellos no infectados (Murral et al., 1996).
Pareciera que el efecto de la infección, sobre todo de fitoplasmas, no tuviera consecuencia sobre el sexo de sus individuos vectores pero si sobre su comportamiento. Se ha reportado que machos infectados del cicadélido del aster chino (M. quadrilineatus) tiene un comportamiento diferente con aquellos no infectados. Hoy et al. (1999) determinaron que dichos machos infectados se mueven en forma más frecuente entre plantas, situación que puede favorecen el encuentro con las hembras y la dispersión del patógeno.
Por otra parte, es difícil separar el efecto directo de las plantas hospederas del efecto de los molicutes fitopatógenos sobre el insecto vector, lo cual podría enmascar el resultado real de esta interacción. No obstante, las plantas infectadas se ven alteradas, de tal forma, que las hace más susceptibles para la infestación de los insectos, por ejemplo, hay una reducción en las defensas químicas, las cuales podrían estar involucradas en repelencia de otros insectos herbívoros o en la reducción del potencial biológico de éstos. Por ejemplo, la infección fitoplasmática en plantas puede incrementar la concentración de nutrientes de fácil digestión, tales como aminoácidos libres y azucares que podrían ser utilizados por los insectos vectores (Weintraub y Beanland, 2006). Además, plantas infectadas pueden incrementar la atracción de insectos, sobre todo cicadélidos, ya que se ha demostrado que los colores amarillos son más atractivos para estos insectos; cuya coloración se da con los tejidos cloróticos de las plantas afectadas por fitoplasmas (Todd et al., 1990).
COMENTARIOS FINALES Y CONCLUSIONES
El grado de interacción entre molicute-insecto permite delimitar, en gran medida, la transmisión de éstos en otras plantas y seguramente, el efecto que puede ejercer sobre su insecto hospedante. Claramente, los fitoplasmas y espiroplasmas tienen impacto negativo en el potencial biológico (por ejemplo, producción flores, semillas o frutos) de las plantas hospederas, lo cual sugiere que la infección por estos molicutes causa un estrés generalizado afectando negativamente la actividad fisiológica de plantas hospedantes (Hogenhout et al., 2008). Sin embargo, esa aseveración sólo podría ser cierta para aquellas plantas (biotipos) altamente seleccionadas por el hombre, en donde los mecanismos de resistencia naturales se pierden a través de selección, haciendo las plantas “susceptibles” a la infección de patógenos. En aquellas plantas no seleccionadas (silvestres), el daño es reducido o no se presenta, debido a que dichos biotipos están adaptados a esos molicutes (Madden y Nault, 1983), por lo que el grado de asociación en el tiempo puede delimitar entre ser patogénico o inocuo a su organismo hospedero.
Lo que también está claro es que estos molicutes pueden afectar al potencial biológico de su vector en forma positiva, negativa o simplemente no ejercer ningún efecto, los cuales dependerán mayoritariamente, de las condiciones ambientales, planta hospedera, aislado del patógeno y especie del insecto vector, como lo han determinado los trabajos de Garcia-Salazar et al., 1991; Murral et al., 1996; Bosco et al., 1997; Ebbert y Nault, 1994 y Ebber y Nault 2001. Esto implica que algunos “aislados” de fitoplasmas (considerados todos fitopatógenos) pueden afectar en forma negativa el potencial biológico de sus insectos vectores, provocando una reducción significativa en la longevidad y la sobrevivencia (Madden y Nault, 1983; Bressan et al., 2005a y Bressan et al., 2005b). Pero también, otros insectos se ven favorecidos por la infección de estos patógenos, en tal grado que dichos vectores pueden sobrevivir más tiempo y producir más individuos en la progenie que aquellos insectos no infectados (Purcell, 1988; Garcia-Salazar et al. 1991; Murral et al., 1996 y Bealand et al., 2000). Por otra parte, la mayoría de los espiroplasmas son asociados con insectos, pero no todos de carácter fitopatógenos, lo cual pone de manifesto que posiblemente, los molicutes fitopatógenos se originaron de sus insectos vectores, como se ha propuestos para los virus fitopatógenos (Nault, 1997). La alimentación de los insectos infectados en las plantas pudo resultar en la transmisión de estos molicutes, los cuales a través del tiempo, se adaptaron a las condiciones de los tejidos de las plantas, convirtiéndose en muchos casos, patógenos de ellas.
De un inicio se ha propuesto, que los efectos negativos o positivos en un vector pueden estar asociados a las relaciones e interacciones o los mecanismos que participan entre el patógeno y su vector (Kakizawa et al., 2006). Generalmente se asume que una relación de mucho tiempo puede implicar un efecto reducido de virulencia en su vector (Purcell, 1982), por lo tanto, esos molicutes que reducen el potencial biológico en sus insectos vectores pueden tener una asociación o una relación evolutiva relativamente nueva con dicho vector, provocando un proceso de selección. Eso implica que aislados (o cepas) que no afectan negativamente a sus insectos hospederos podrían sobrevivir en el tiempo y así ser introducido en otras las plantas hospedantes y consecuentemente, ser adquiridos por otros vectores (Purcell, 1988 y Weintraub y Beanland, 2006). Uno de los mejores ejemplos de este proceso de adaptación a molicutes es Dalbulus spp., ya que es capaz de adaptarse a la infección mixta de fitoplasmas y espiroplasma (S. kunkelli) (Madden y Nault, 1983) posiblemente, resultado de una larga asociación entre estos dos organismos. Eso significa que los vectores desarrollaron una tolerancia a esos molicutes, provocando un proceso de adaptación del insecto vector a la infección, al patógeno y éstos últimos, una adaptación al ambiente interno del vector para lograr multiplicarse y ser transmitidos. Una vez adaptado estos fitopatógenos, pueden lograr manipular nuevas plantas hospederas para el vector, es decir, aquellas plantas que no son normalmente utilizadas por el insecto vector, una vez infectadas, puede favorecer al potencial biológico del mismo vector. Es el ejemplo de D. maidis, un especialista de maíz, el cual no sobrevive en aster chino sano, pero sí en un aster infectado con fitoplasmas o también puede sobrevivir en aster sano, después que se haya alimentado de un aster infectado (Purcell, 1988).
También se puede concluir que la infección por estos molicutes en los insectos vectores tiene implicaciones en la incidencia y la dispersión de enfermedades. Mientras mayor tiempo de sobrevivencia tenga el vector, tiene una mayor oportunidad de infectar más plantas y de generar un mayor número de individuos en la progenie (Weintraub y Beanland, 2006), por lo que los insectos vectores juegan un rol preponderante como los principales dispersores de estos microorganismos. Esto sugiere que una reducción del potencial biológico puede afectar la dinámica poblacional del insecto vector y con ello, limitar la dispersión del molicute que hospeda. Sin embargo, la infección persistente y propagativa en las plantas hospederas, sobre todo en las plantas perennes, puede compensar ese efecto reducido en la fecundidad y longevidad, ya que nuevos individuos sanos se van a infectar cuando se alimenten de plantas infectadas con estos microorganimos (Bai, 2004). Por lo que en la práctica, la incidencia y dispersión de estos patógenos no sólo depende de un factor, sino que es una interacción cuadripartita de difierentes niveles entre insecto vector - patógeno - planta hospedera y el ambiente en donde se presenten. Sin embargo, es necesario poner de manifiesto que esos efectos en el potencial biológico pueden estar asociados a los efectos indirectos por la infección de las plantas hospedantes, ya que la mayoría de estos trabajos no separan el efecto directo del patógeno del efecto directo de la planta hospedante durante el proceso de infección (Elliot et al., 2003), lo cual podría conducir a observaciones erróneas en el potencial biológico, factores a considerar en futuros trabajos de este tipo.
BIBLIOGRAFIA
AMMAR, E.-D.; FULTON, D.; BAI, X.; MEULIA, T.; Hogenhout, S.A. 2004. An attachment tip and pili-like structures in insect- and plant-pathogenic spiroplasmas of the class Mollicutes. Archives of Microbiology 181: 97-105.
ANDRADE, N.; VILLAGRA, M.; ARISMENDI, N. 2009. Evidencias microscópicas y moleculares de la presencia de fitoplasmas en plantas de murta (Ugni molinae Turcz.) afectadas por la enfermedad “escoba de bruja”. Tropical Plant Pathology 34: 245-249.
ARISMENDI, N.; ANDRADE, N.; RIEGEL, R.; CARRILLO, R. 2010. Presence of a phytoplasma associated to “witches’ broom” disease in Ugni molinae Turcz. and Gaultheria phillyreifolia (Pers.) Sleumer determined by DAPI, PCR and DNA sequencing. Chilean Journal of Agricultural Research 70: 26-33.
BAI, X. 2004. Insect transmitted plant pathogenic mollicutes, Spiroplasma kunkelii and aster yellows witches’-broom phytoplasma: from structural genomics to functional genomics. Tesis de Ph.D. Graduate School of The Ohio State University, USA. 232 p.
BAI, X.; FAZZOLARI, T.; HOGENHOUT, S.A. 2004. Identification and characterization of traE genes of Spiroplasma kunkelii. Gene 336: 81-91.
BEANLAND, L.; HOY, C.W.; MILLER, S.A.; NAULT, L.R. 2000. Influence of aster yellows phytoplasma on the fitness of aster leafhopper (Homoptera: Cicadellidae). Annals of the Entomological Society of America 93: 271-276.
BERTACCINI, A. 2007. Phytoplasmas: diversity, taxonomy, and epidemiology. Frontier in Bioscience 12: 673-689.
BERTAMINI, M.; GRANDO, M.S.; NEDUNCHE-ZHIAN, N. 2003. Effects of phytoplasma infection on pigments, chlorophyll-protein complex and photosynthetic activities in feld grown apple leaves. Biologia Plantarum 47: 237-242.
BOSCO, D.; MINUCCI, C.; BOCCARDO, G.; CONTI, M. 1997. Differential acquisition of chrysanthemum yellows phytoplasma by three leafhopper species. Entomologia Experimentalis et Applicata 83: 219-224.
BOVÉ, J.M.; RENAUDIN, J.; SAILLARD, C.; FOISSAC, X.; GARNIER, M. 2003. Spiroplasma citri, a plant pathogenic mollicute: relationships with its two hosts, the plant and the leafhopper vector. Annual Review of Phytopathology 41: 482-500.
BRESSAN, A.; CLAIR, D.; SÉMÉTEY, O.; BOUDON-PADIEU, E. 2005a. Effect of two strains of Flavescence dorée phytoplasma on the survival and fecundity of the experimental leafhopper vector Euscelidius variegatus Kirschbaum. Journal of Invertebrate Pathology 89: 144-149.
BRESSAN, A.; GIROLAMI, V.; BOUDON-PADIEU, E. 2005b. Reduced fitness of the leafhopper vector Scaphoideus titanus exposed to Flavescence dorée phytoplasma. Entomologia Experimentalis et Applicata 115: 283-290.
CHANG, C.-J. 1998. Pathogenicity of aster yellows phytoplasma and Spiroplasma citri on periwinkle. Phytopathology 88: 1347-1350.
CHRISTENSEN, N.M.; Axelsen, K.B.; Nicolaisen, M.; Schulz, A. 2005. Phytoplasmas and their interactions with hosts. TRENDS in Plant Science 10: 526-535.
DANIELS, M.J. 1983. Mechanisms of spiroplasma pathogenicity. Annual Review of Phytopathology 21: 29-43.
D’AMELIO, R.; Palermo, S. Marzachí, C., Bosco, D. 2008. Influence of Chrysanthemum yellows phytoplasma on the fitness of two of its leafhopper vectors, Macrosteles quadripunctulatus and Euscelidius variegatus. Bulletin of Insectology 61: 349-354.
DE ALMEYDA, L.; RACCAH, B.; KLEIN, M. 1997. Transmission characteristics of Spiruptasma citri and its effect on leafhopper vectors from the Circulifer tenellus complex. Annals of Applied Biology 130: 49-59.
DURET, S.; BERHO, N.; DANET, J.L.; GARNIER, M.; RENAUDIN, J. 2003. Spiralin is not essential for helicity, motility, or pathogenicity but is required for effcient transmission of Spiroplasma citri by its leafhopper vector Circulifer haematoceps. Applied and Environmental Microbiology 69: 6225-6234.
EBBERT, M.A.; NAULT, L.R. 1994. Improved overwintering ability in Dalbulus maidis (Homoptera: Cicadellidae) vectors infected with Spiroplasma kunkelii (Mycoplasmatales: Spiroplasmataceae). Environmental Entomology 23: 634-644.
EBBERT, M.A.; NAULT, L.R. 2001. Survival in Dalbulus leafhopper vectors improves after exposure to maize stunting pathogens. Entomologia Experimentalis et Applicata 100: 311-324.
ELLIOT, S.L.; ADLER, F.R.; SABELIS, M.W. 2003. How virulent should a parasite be to its vector?. Ecology 84: 2568-2574.
FIORE, N.; PRODAN, S.; PALTRINIERI, S.; GAJARDO, A.; BOTTI, S.; PINO, A.M.; MONTEALEGRE, J.; BERTACCINI, A. 2007. Molecular characterization of phytoplasmas in Chilean grapevines. Bulletin of Insectology 60: 331-332.
FLETCHER, J.; WAYADANDE, A.; MELCHER, U.; Ye, F. 1998. The phytopathogenic mollicute-insect vector interface: A closer look. Phytopathology 88: 1351-1358.
GAJARDO, A.; FIORE, N.; PRODAN, S.; PALTRINIERI, S.; BOTTI, S.; PINO, A.M.; ZAMORANO, A.; MONTEALEGRE, J.; BERTACCINI, A. 2009. Phytoplasma associated with grapevine yellows disease in Chile. Plant Disease 93: 789-796.
GARCIA-SALAZAR, C.; WHALON, M.E.; RAHARDJA, U. 1991. Temperature-dependent pathogenicity of the X-disease micoplasma-like organism to its vector, Paraphlepsius irroratus (Homoptera: Cicadellidae). Environmental Entomology 20: 179-184.
GASPARICH, G.E. 2002. Spiroplasma: evolution, adaptation and diversity. Frontiers in Bioscience 7: 619-640.
HANBOONSONG, Y.; CHOOSAI, C.; PANYIM, S.; DAMAK, D. 2002. Transovarial transmission of sugarcane white leaf phytoplasma in the insect vector Matsumuratettix hiroglyphicus (Matsumura). Insect Molecular Biology 11: 97-103.
HERRERA, G.; MADARIAGA, M. 2003. Evidencias inmunológicas, microscópicas y moleculares de la presencia de fitoplasmas en vides. Agricultura Técnica (Chile) 63: 15-22.
HOGENHOUT S.A.; LORIA, R. 2008. Virulence mechanisms of Gram-positive plant pathogenic bacteria. Current Opinion in Plant Biology 11: 449-456.
HOGENHOUT, S.A.; OSHIMA, K.; AMMAR, E.-D.; KAKIZAWA, S.; KINGDOM, H.N.; Namba, S. 2008. Phytoplasmas: bacteria that manipulate plants and insects. Molecular Pant Pathology 9: 403-423.
HOY, C.W.; ZHOU, X.; NAULT, R.N.; MILLER, S.A.; Styer, J. 1999. Host plant, phytoplasma, and reproductive status effects on flight behavior of aster leafhopper (Homoptera: Cicadellidae). Annals of the Entomological Society of America 92: 523-528.
HURST, G.D. Y JIGGINS, F.M. 2000. Male-killing bacteria in insects: Mechanisms, incidence, and implications. Emerging Infectious Diseases 6: 329-336.
HURST, G.D.; GRAF VON DER SCHULENBURG, J.H.; MAJERUS, T.M.; BERTRAND, D.; ZAKHAROV, I.A.; BAUNGAARD, J.; WÖLKL, W.; STOUTHARMER, R.; MAJERUS, M.E. 1999. Invasion of the one insect species, Adalia bipunctata, by two different male-killing bacteria. Insect Molecular Biology 8: 133-139.
IRPCM Phytoplasma/Spiroplasma Working Team -Phytoplasma Taxonomy Group. 2004. “Candidatus Phytoplasma”, a taxon for the wall-less, non-helical prokariotes that colonize plant phloem and insects. International Journal of Systematic and Evolutionary Microbiology 54: 1243-1255.
KAKIZAWA, S.; OSHIMA, K.; NAMBA, S. 2006. Diversity and functional importance of phytoplasma membrana proteins. TRENDS in Microbiology 14: 254-256.
KINGDOM, H.N.; HOGENHOUT, S.A. 2007. Aster yellows phytoplasma witches’-broom (AY-WB; “Candidatus Phytoplasma asteris”) increases survival rates of Macrosteles quadrilineatus and Dalbulus maidis on various plant species. Bulletin of Insectology 60: 225-226.
LEE, I-M.; DAVIS, R.E.; GUNDERSEN-RINDAL, D.E. 2000. Phytoplasma: Phylogenetic Mollicutes. Annual Review of Microbiology 54: 221-255.
LEÓN, R.; SANTAMARÍA, J.; ALPIZAR, L.; ESCAMILLA, J.; OROPEZA, C. 1996. Physiological and biochemical changes in shoots of coconut palms affected by lethal yellowing. New Phytologist 134: 227-234.
LHERMINIER, J., BENHAMOU, N., LARRUE, J.; MILAT, M.L.; BOUDON-PADIEU, E.; NICOLE, M.; BLEIN, J.-P. 2003. Cytological characterization of elicitin-induced protection in tobacco plants infected by Phytophthora parasitica or phytoplasma. Phytopathology 93: 1308-1319.
LIM, P.-O.; SEARS, B.B. 1992. Evolutionary relationships of plant-pathogenic mycoplasmalike organism and Acholeplasma laidlawii deduced from two ribosomal protein gene sequences. Journal of Bacteriology 174: 2606-2611.
LIU, H.-Y.; GUMPF, D.J.; OLDFIELD, G.N.; CALAVAN, E.C. 1983. The relationship of Spiroplasma citri and Circulifer tenellus. Phytopathology 73: 585-590.
MADDEN, L.V.; NAULT, L.R. 1983. Differential pathogenicity of corn stunting mollicutes to leafhopper vectors in Dalbulus and Balbulus species. Phytopathology 73: 1608-1614.
MADDEN, L.V.; NAULT, L.R.; HEADY, S.E.; STYER W.E. 1984. Effect of maize stunting mollicutes on survival and fecundity of Dalbulus leafhopper vectors. Annals of Applied Biology 105: 431-441.
MALAGNINI, V.; PEDRAZZOLI, F.; GUALANDRI, V.; FORNO, F.; ZASSO, R.; POZZEBON, A.; IORIATTI, C. 2010. A study of the effects of ‘Candidatus Phytoplasma mali’ on the psyllid Cacopsylla melanoneura (Hemiptera: Psyllidae). Journal of Invertebrate Pathology 103: 65-67.
MATUS, J.T.; VEGA, A.; LOYOLA, R.; SERRANO, C.; CABRERA, S.; ARCE-JOHNSON, P. 2008. Phytoplasma and virus detection in commercial plantings of Vitis vinífera cv. Merlot exhibiting premature berry dehydration. Electronic Journal of Biotechnology 11: 1-10.
MIYATA, M.; OGAKI, H. 2006. Cytoskeleton of Mollicutes. 2006. Journal of Molecular Microbiology and Biotecnology 11: 256-264.
MONTENEGRO, H.; SOLFERINI, V.N.; KLACZKO, L.B.; HURST, G.D. 2005. Male-killing Spiroplasma naturally infecting Drosophila melanogaster. Insect Molecular Biology 14: 281-287.
MURRAL, D.J.; NAULT, L.R.; HOY C.W.; MADDEN, L.V.; Miller, S.A. 1996. Effects of temperature and vector age on transmission of two Ohio strains of Aster Yellows phytoplasma by the aster leafhopper (Homoptera: Cicadellidae). Journal of Economic Entomology 89: 1223-1232.
NAULT, L.R. 1997. Arthropod transmission of plant viruses: A new synthesis. Annals of the Entomological Society of America 90: 521-541.
ÖZBEK, E.; MILLER, S.A.; MEULIA, T. Y HOGENHOUT, S.A. 2003. Infection and replication sites of Spiroplasma kunkelii (Class: Mollicutes) in midgut and Malpighian tubules of the leafhopper Dalbulus maidis. Journal of Invertebrate Pathology 82: 167-175.
PONCAROVA-VORACKOVA, Z.; FRANOVA, J.; VALOVA, P.; MERTELIK, J.; NAVRATIL, M.; NEBESAROVA, J. 1998. Identifcation of phytoplasma infecting Lilium martagon in the Czech Republic. Journal of Phytopathology 146: 609-612.
PURCELL, A.H. 1982. Insect vector relationships with procariontic plant pathogens. Annual Review of Phytopathology 20: 397-417.
PURCELL, A.H. 1988. Increased survival of Dalbulus maidis, a specialist on maize, on nont-host plant infected with mollicutes plant pathogens. Entomologia Experimentalis et Applicata 46: 187-196.
REGASSA, L.B.; GASPARICH, G.E. 2006. Spiroplasma: Evolutionary relationships and biodiversity. Frontiers in Bioscience 11: 2983-3002.
SAGLIO, P.; L’HOSPITAL, M.; LAFLECHE, D.; DUPONT, G.; BOVÉ, J.M.; TULLY, J.G.; FREUNDT, E.A. 1973. Spiroplasma citri gen. and sp. n.: a mycoplasma-like organism associated with stubborn disease of citrus. International Journal of Systematic and Bacteriology 23: 191-204.
SUZUKI, S.; OSHIMA, K.; KAKIZAWA, S.; ARASHIDA, R.; JUNG, H-Y.; YAMAJI, Y.; NISHIGAWA, H.; UGAKI, M.; NAMBA, S. 2006. Interaction between the membrane protein of a pathogen and insect microfilament complex determines insect-vector specificity. Proceedings of the National Academy of Sciences (PNAS) 103: 4252-4257.
TODD, J.L.; HARRIS, M.O.; NAULT, L.R. 1990. Importance of color stimuli in host-finding by Dal-bulus leafhoppers (Homoptera: Cicadellidae). Entomologia Experimentalis et Applicata 54: 245-255.
YU, J.; WAYADANDE, A.C.; FLETCHER, J. 2000. Spiroplasma citri surface protein P89 implicated in adhesion to cells of the vector Circulifer tenellus. Phytopathology 90:716-722.
WEINTRAUB, P.; BEANLAND, L. 2006. Insect vectors of phytoplasmas. Annual Review of Entomology 51: 91-111.
WILSON, M.R.; Weintraub, P.G. 2007. An introduction to Auchenorrhyncha phytoplasma vectors. Bulletin of Insectology 60: 177-178.
Recepción Originales: 12 de junio 2010