Agro
Sur Vol. 39(2) 79-87 2011
DOI:10.4206/agrosur.2011.v39n2-02
ARTÍCULOS
ORIGINALES
POTENCIAL ALELOPATICO DE CULTIVARES
DE Lupinus albus L., SOBRE CRECIMIENTO MICELIAL in vitro DE Gaeumannomyces
graminis var. tritici Walker1
ALLELOPATHIC POTENTIAL OF Lupinus
albus L., CULTIVARS ON MICELIAL GROWTH in vitro OF Gaeumannomyces
graminis var. tritici
Romina Senn M.1,
Emma Bensch T. 1, Jaime Guerrero C.1,
Enrique Ferrada Q.1
1
Universidad de La Frontera. Facultad de Ciencias Agropecuarias y Forestales.
Casilla 54-D. Temuco, Chile. Email: jguerre@ufro.cl.
ABSTRACT
The aim of this study was to
evaluate the allelopathic potential of cultivars of Lupinus albus L.
Rumbo, Typ Top and Pecosa on the mycelial growth of the fungus Gaeumannomyces
graminis var. tritici using aqueous extracts, considering five concentrations
(1, 3, 10, 30 and 90% v/v), compared with a control treatment. The methodology
consisted of measuring the radius of mycelial growth from the center of the
Petri plates with mixed medium APD and extract, every 24 hours to complete the
control plate. The experimental design was completely randomized with three
replicates per treatment, each Petri plate was an experimental unit. Data analysis
was performed using ANOVA and multiple comparison test of Tukey (p≤0.05).
The main results showed a differential allelophatic effect of the radical aqueous
extracts, often inhibitory and occasionally enhancing the mycelium growth of
G. graminis var. tritici. The radical aqueous extract Typ Top,
often had higher inhibitory allelopathic effect on the mycelial growth at concentrations
of 10%, 30% and 90% v/v. Concentrations of extracts above 30% v/v, showed similar
allelopathic effect on mycelial growth, while concentrations below 3% caused
a differential response, with Pecosa showing its higher inhibitory effect at
1% and Typ Top at 3%.
Key words: Allelopathic
potential, Lupinus albus L., Gaeumannomyces graminis var. tritici.
RESUMEN
El objetivo de esta investigación
fue evaluar el potencial alelopático de los cultivares de Lupinus
albus L. Rumbo, Typ Top y Pecosa sobre el crecimiento micelial in vitro
del hongo Gaeumannomyces graminis var. tritici, usando extractos
acuosos en cinco concentraciones (1, 3, 10, 30 y 90% v/v), comparadas con un
testigo sin extracto. La metodología consistió en medir el radio
del crecimiento micelial (mm.) desde el centro de las placas Petri con medio
APD y extracto respectivo cada 24 horas hasta completar la placa testigo. Se
utilizó un diseño completamente aleatorizado, con tres repeticiones
por tratamiento, cada placa constituyó una unidad experimental. El análisis
de los datos se realizó a través de análisis de varianza
(ANOVA), y prueba de comparación multiple de Tukey (p≤0,05).
Los resultados constataron efecto alelopático diferencial de los extractos
acuosos radicales, en la mayoría de los casos inhibitorio y ocasionalmente
potenciador del crecimiento micelial. El extracto acuoso radical Typ Top, tuvo
frecuentemente mayor efecto alelopático inhibidor del crecimiento micelial
a concentraciones de 10%, 30% y 90% v/v. Concentraciones sobre el 30% v/v de
los extractos, presentaron similar efecto alelopático sobre el crecimiento
micelial, mientras que concentraciones menores a 3% la respuesta fue diferencial,
siendo el efecto inhibitorio de Pecosa mayor a 1% y de Typ Top a 3%.
Palabras clave: Potencial
alelopático, Lupinus albus L., Gaeumannomyces graminis
var. tritici.
INTRODUCCIÓN
Las plantas están constantemente
expuestas a estrés bióticos y abióticos, situación
que ha propiciado el desarrollo de variadas formas de defensa (Sepúlveda
et al., 2003). Los mecanismos de defensa químicos son una estrategia
utilizada por las plantas, produciendo metabolitos secundarios (MS) en contra
de patógenos y herbívoros (Croteau et al., 2000). Entre
estas sustancias químicas se encuentran los aleloquímicos, considerados
productos de desecho de las principales vías metabólicas de la
planta (Argandoña et al., 1980,1981; Bohidar et al., 1986;
An et al., 1998; Thackray et al., 1990), los que son liberados
a través de las raíces, lixiviación por el agua, desintegración
de residuos vegetales, compuestos volátiles, o por la descomposición
de microorganismos en forma pasiva (Kogan, 1992; Ormeño, 1997,
Anaya et al., 2001, Bensch, 2003). La
principal función de estos metabolitos es otorgar protección a
la planta contra el ataque de patógenos, inhibiendo o favoreciendo el
desarrollo de estos; actuando como repelente o atrayente de insectos y reduciendo
la competencia con otras especies (Rice, 1974; Ormeño, 1997; Anaya et
al., 2001).
Diversos autores han evidenciado
las propiedades inhibitorias que presenta el género Lupinus sobre
hongos fitopatógenos, bacterias y virus. Hutchinson (1986), observó
la actividad antimicótica de Lupinus albus L. var. multolupa
de una fracción obtenida de extractos que contenía terpenos, esteroles
y fenoles, sobre cepas de Microsporum canis E. Bodin ex. Gueg, Trichophyton
tonsurans Malmsten y T. mentagrophytes (C.P. Robin) Sabour. Vallejos
et al., (1998), reportaron que la lupanina es el alcaloide que está
presente en mayor proporción en L. albus y que al ser adicionada
al medio de cultivo, inhibe el crecimiento de Colletotrichum gloeosporioides
(Penz.) Penz. & Sacc., hongo causante de la antracnosis. Bernal et al.,
(2005), evaluaron la capacidad fungicida in vitro de los extractos crudos
y alcaloides de semillas de Lupinus exaltatus Zucc., L. rotundiflorus
M. E. Jones y L. montanus Kunth, en el desarrollo de Sclerotium rolfsii
Sacc., Alternaria solani (Ell. and Mart.) Jones and Grout, Rhizoctonia
solani Khün y Fusarium oxysporum Schlectend:Fr f.sp. lycorpersici
(Sacc.) Snyder y Hans. En este contexto Zamora et al., (2008), determinaron
que el extracto de alcaloides obtenido de semillas de L. mexicanus Cerv.
ex Lag., inhibió el crecimiento micelial de R. solani en un 100%
y de S. rolfsii en un 72,5%.
Diversas especies de plantas
cultivadas poseen efecto alelopático potencial contra hongos, con la
ventaja de ser biodegradables y permiten considerarlos como alternativa práctica
y aplicable en los agroecosistemas (Blanco, 2006). En este sentido, el conocimiento
de estos metabolitos orgánicos activos, sus transformaciones e influencias
cuando son liberados al ambiente (Anaya et al., 2001), permite generar
información actualizada del efecto de estos extractos sobre algunos hongos.
Al respecto, la literatura consultada no presenta antecedentes del potencial
efecto alelopático de Lupinus albus L., sobre el hongo Gaeumannomyces
graminis var. tritici, pero es de consignar que compuestos orgánicos
de esta planta han sido eficaces sobre Phytophthora cinammomi (Aryantha
et al., 2000); también, aunque no relacionado directamente, destaca
como cultivo de quiebre, de manera de controlar enfermedades radicales (Mera
y Rouanet, 2003). Consecuentemente el conocer las interacciones alelopáticas
entre especies cultivadas conlleva una importancia de carácter científico
y también de tipo práctico, especialmente en las prácticas
agronómicas de rotación de cultivo, para reducir potencial de
inóculo y alterar ciclos biológicos de
hongos fitopatógenos del suelo, en el caso de G. graminis var.
tritici es relevante disponer de este tipo de información por
la significancia económica que puede ocasionar este hongo en la producción
de trigo en el sur de Chile.
La hipótesis de trabajo
plantea que los cultivares Lupinus albus L. cvs. Rumbo, Typ Top y Pecosa,
poseen efecto alelopático diferencial en el crecimiento de Gaeumannomyces
graminis (Sacc.) Arx y Olivier var. tritici J. Walker. Para dar cumplimiento
a la hipótesis de trabajo se plantearon los siguientes objetivos: Determinar
el potencial alelopático según concentración de extractos
acuosos radicales de L. albus (cvs. Rumbo, Typ Top y Pecosa) sobre el
crecimiento micelial in vitro de G. graminis var. tritici; y clasificar
los cultivares de lupino en relación con su potencial alelopático
sobre el hongo evaluado.
MATERIALES Y MÉTODOS
La investigación durante
la etapa de cultivo de las especies dadoras de aleloquímicos, fue realizada
en el Invernadero y Laboratorio de Suelos de la Facultad de Ciencias Agropecuarias
y Forestales de la Universidad de La Frontera. La preparación de los
extractos acuosos y evaluación del crecimiento micelial se desarrolló
en el laboratorio de Fitopatología del Instituto de Agroindustria de
la misma Universidad. El material biológico consideró semillas
de L. albus L. cvs. Rumbo, Typ Top y Pecosa y aislamientos del hongo
G. graminis var. tritici identificado según claves taxonómicas
e identificación morfométricas y claves de Hanlin (1998). Los
extractos acuosos se obtuvieron a través de la metodología desarrollada
por Enríquez et al., (2010), la que consistió en la trituración
de la parte radical de las especies dadoras a los 90 días de edad. Posteriormente
se pesaron 100 g de raíces en una balanza electrónica digital,
el material fue lavado con detergente comercial y una solución de NaOCl
al 1%, para ser finalmente enjuagada con abundante agua destilada estéril.
La masa radicular, fue fragmentada en un mortero y llevada
a un vaso precipitado de 1 L. de agua destilada estéril, obteniendo una
suspensión que se tapó con papel parafilm y se dejó reposar
durante 24 horas a temperatura ambiente (20°C). Transcurrido este período,
la suspensión se filtró por gravedad con bomba de vacío
por medio de embudo Buchner y papel filtro (GC 50). Para evitar efecto negativo
de la luz sobre los compuestos alelopáticos, el filtrado obtenido fue
guardado en frascos color ámbar y conservado en refrigerador a 5°C.
El medio de cultivo, agar papa
dextrosa (APD), fue preparado en matraces Erlenmeyer de 50 mL., a volúmenes
requeridos para cada concentración. Estos se taparon con papel aluminio
y se llevaron a autoclave durante 15 minutos a 121°C y 15 lbs/pulg2.
Luego, bajo cámara de flujo laminar y con una jeringa graduada, se adicionaron
los distintos volúmenes de extracto de compuestos alelopáticos,
requeridos según concentración a evaluar (0, 1, 3, 10, 30 y 90%
v/v), utilizando una metodología similar a la señalada por Sobrero
y Ronco (2004), Zamora et al., (2005) y
Zamora et al., (2008). Las placas fueron inoculadas con micelio G.
graminis var. tritici e incubadas en cámara de crecimiento
a 25°C. El crecimiento del micelio se determinó de acuerdo a la metodología
descrita por French y Hebert (1980), la que consistió en medir el diámetro
del crecimiento micelial, desde el centro de la placa siempre en el mismo sentido
y lugar, a partir de las 24 horas pos siembra y sucesivamente cada 24 horas,
hasta que la placa control esté completamente colonizada.
Se utilizó un diseño
completamente aleatorizado, con tres repeticiones por tratamiento, cada placa
constituyó una unidad experimental. El análisis de los datos se
realizó a través de análisis de varianza (ANOVA), y prueba
de comparación múltiple de Tukey (p < 0,05). Los tratamientos
fueron los cultivares y cada concentración constituyó un evento
independiente, por lo que la variable a evaluar fue inhibición micelial
de G. graminis var. tritici, según concentración
de extractos acuosos de los cultivares Rumbo, Typ Top y Pecosa. Para el procesamiento
de los datos se utilizó el programa estadístico Statgraphics Plus
5.0.
RESULTADOS Y DISCUSIÓN
Los resultados del efecto alelopático
de los extractos acuosos de raíces de L. albus cvs. Rumbo, Typ
Top y Pecosa sobre el crecimiento micelial in vitro de G. graminis var.
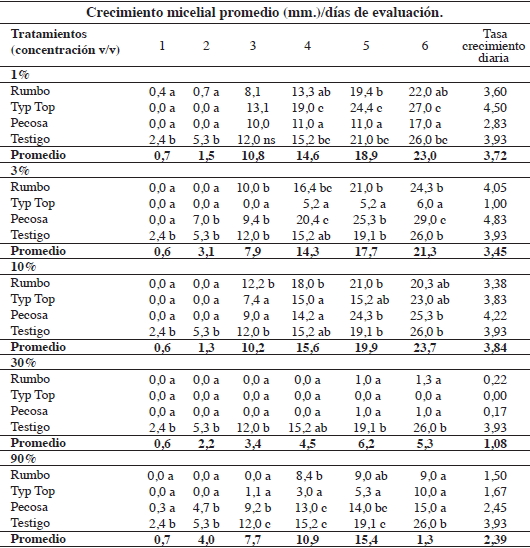
tritici, comparados con el testigo, se observan en el Cuadro
1.
Cuadro
1. Efecto alelopático de extractos acuosos de raíces de
tres genotipos de Lupinus albus L. a distintas concentraciones, sobre
el crecimiento micelial in vitro (mm.) de Gaeumannomyces graminis
var. tritici.
Table 1. Allelopathic
effects of root aqueous extracts of three genotypes of Lupinus albus L.
at different concentrations on mycelial growth in vitro (mm.) of Gaeumannomyces
graminis var. tritici. |
| |
|
| |
Cada concentración
se consideró un estudio independiente. Letras distintas en columnas
indica diferencia significativa según Tukey (p< 0,05)
Each concentration was considered as an independent study.
Different letters in columns indicate
significant differences according to Tukey (p < 0.05). |
a) Concentración 1%
v/v. Durante los primeros dos días de evaluación, los extractos
acuosos de raíces de todos los cultivares, inhibieron el crecimiento
del hongo respecto del testigo. Desde el cuarto día, el extracto proveniente
del cultivar Pecosa, tuvo efecto inhibidor significativo del crecimiento micelial
de G. graminis var. tritici, con una tasa de crecimiento
diario de 2,83 mm., para los seis días de evaluación.
Este resultado podría
explicarse considerando lo reportado por French y Hebert (1980), quienes señalan
que durante la fase de adaptación del crecimiento fúngico, el
micelio del hongo comienza a absorber metabolitos tóxicos presentes en
el medio, impidiéndole alcanzar mayores longitudes. Además, esta
situación pudiese ser atribuida a la naturaleza química de los
extractos radicales, como consta en un estudio realizado por Enríquez
et al., (2010) al evaluar el efecto inhibitorio de extractos radicales
de trigo obtenidos de 17 ecotipos y 2 variedades comerciales sobre G. graminis
var. tritici. Estos autores obtuvieron un crecimiento promedio de 4,2
mm. con extractos de los ecotipos NN1, Pulil y Varón, efecto inhibitorio
mayor al observado con extractos acuosos radicales de lupino en condiciones
in vitro.
b) Concentración 3%
v/v. Hubo diferencias significativas en la inhibición micelial del
hongo respecto del testigo según origen del extracto, para todos los
periodos evaluados. La eficacia inhibitoria fue superior por parte del extracto
acuoso del cultivar Typ Top, con tasa de crecimiento diario de 1 mm. Se constató
también, efecto potenciador del extracto proveniente del cultivar Pecosa
al cuarto y sexto día de evaluación, difiriendo significativamente
con el testigo.
Respecto de la eficacia inhibitoria
de los compuestos alelopáticos independiente de las especies, Blum y
Rebbeck (1989) señalan que una exposición constante a una dosis
baja de un aleloquímico puede producir una inhibición significativa
del crecimiento; el efecto potenciador evidenciado por extracto del cultivar
Pecosa, se respalda en lo señalado por Patrick et al. (1963),
quienes demuestran que los compuestos fitotoxicos que son liberados por la descomposición
de materia orgánica, puede influir positivamente en la actividad de los
patógenos del suelo, reduciendo la resistencia de la planta.
c) Concentración
10% v/v. Durante los dos primeros días de evaluación, todos
los extractos inhibieron completamente el crecimiento del micelio de G. graminis
var. tritici, sin diferencia significativa entre los extractos. Tampoco
hubo diferencias significativas entre extractos de distintos cultivares al final
del tratamiento. Sólo se manifestaron efectos inhibitorios para el crecimiento
del hongo al tercer día de evaluación con extractos de los cultivares
Typ Top y Pecosa respecto del testigo.
Este efecto sin embargo, fue
transitorio y el crecimiento del hongo se recuperó a niveles similares
a los del control en los siguientes días de evaluación. Los aleloquímicos
pueden ser degradados a sustancias más o menos tóxicas, las cuales
pueden interactuar en sus efectos; asimismo, las concentraciones estáticas
en el medio reflejan el balance entre tasas de entrada contra tasas de salida
para un compuesto específico, las tasas de liberación total constituyen
el componente principal de la toxicidad (Anaya et al., 2001).
d) Concentración
30% v/v. Durante los seis días de evaluación, todos los extractos
acuosos inhibieron el crecimiento micelial de G. graminis var. tritici
en casi un 100%. En el quinto día de evaluación, se observó
crecimiento micelial en los cultivares Rumbo y Pecosa (1 mm.) no difiriendo
de Typ Top, pero sí del testigo. El extracto proveniente del cultivar
Typ Top, tuvo mayor eficacia inhibitoria del crecimiento micelial (0 mm.) de
G. graminis var. tritici.
El escaso crecimiento registrado
en todos los cultivares, concuerda en cierta medida con los resultados obtenidos
por Zamora et al., (2005), quienes en un estudio de evaluación
de crecimiento in vitro de hongos fitopatógenos con extractos
crudos de semillas de L. exaltatus, señala que el menor crecimiento
se registró con la concentración más alta evaluada, con
inhibición del desarrollo micelial de 94,7% para A. solani, 91%
en R. solani y 100% para S. rolfsii. Cabe señalar, que
con la concentración más alta de lupanina (uno de los alcaloides
aislados) se registró un menor porcentaje de inhibición con respecto
al total de extractos crudos. Otro estudio
de Zamora (2000), señala diferencias significativas en el crecimiento
promedio del micelio de S. rolfsii y R. solani por efecto del
extracto de L. mexicanus. Las concentraciones más bajas del extracto
no mostraron efectos importantes sobre el crecimiento de los hongos con respecto
al testigo; no obstante, al aumentarlas, este se redujo con una respuesta de
susceptibilidad diferencial en relación al patógeno, observando
inhibición promedio del crecimiento de R. solani de 100%.
e) Concentración 90%
v/v. Todos los extractos evaluados registraron inhibición del crecimiento
micelial, siendo en mayor magnitud durante los dos primeros días. El
extracto acuoso del cultivar Pecosa fue el menos eficaz hasta el quinto día
de evaluación, aunque al final del período todos los extractos
presentaron similar efecto inhibidor del crecimiento micelial de G. graminis
var. tritici. La secuencia de menor a mayor tasa de crecimiento diaria
del hongo fue: Rumbo (1,50 mm.), Typ Top (1,67 mm.) y Pecosa (2,45 mm.).
El efecto de las concentraciones
de extractos acuosos sobre el crecimiento micelial in vitro de G.
graminis var. tritici, se muestra en la Figura 1.
Se observa que el efecto inhibitorio fue directamente proporcional a la concentración
del extracto acuoso de Lupinus albus L (Fig. 1 A-E).
Concentraciones menores al 10% inhibieron el crecimiento del hongo solo en los
dos primeros días de iniciado el tratamiento, manifestando una recuperación
del crecimiento del micelio en los días posteriores de la evaluación
(Fig. 1 A, B y C).
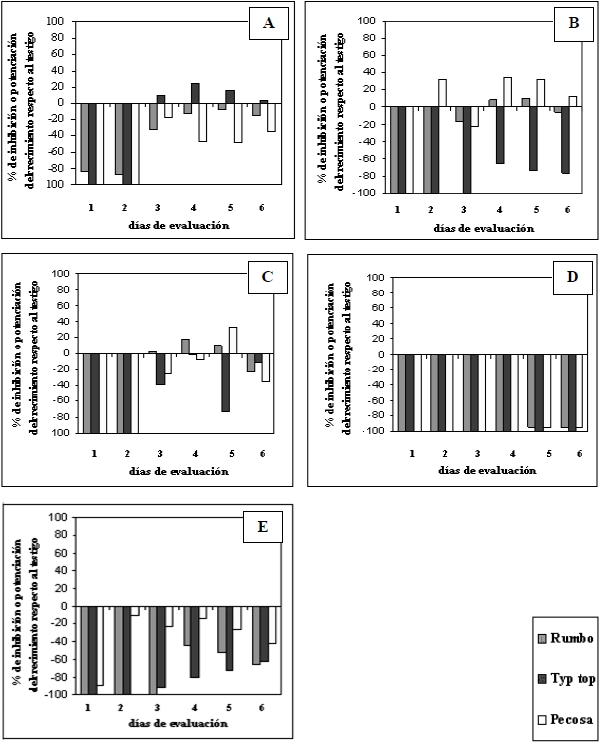 |
| |
Figura 1. Efecto
alelopático (% de inhibición o potenciación del crecimiento
respecto al testigo) de extractos acuosos de raíces de Lupinus
albus L. a diferentes concentraciones de extracto sobre el crecimiento
micelial in vitro de Gaeumannomyces graminis var. tritici
durante seis días de evaluación. A (1% v/v), B (3% v/v),
C (10% v/v), D (30% v/v), E (90% v/v).
Figure 1. Allelopathic effect
(% inhibition or growth enhance compared to control) of root aqueous extracts
of Lupinus albus L. at different extract concentrations on in vitro
mycelial growth of Gaeumannomyces graminis var. tritici
during six days of evaluation. A (1% v/v), B (3% v/v), C (10% v/v), D
(30% v/v), E (90% v/v). |
Los resultados de esta investigación
mostraron inhibición del crecimiento micelial de G. graminis var.
tritici, por los extractos acuosos radicales de lupino de todas las variedades
evaluadas. En el presente estudio, se comprobó que la acción alelopática
inhibitoria in vitro, a la concentración 30% v/v, fue la que produjo
menor crecimiento del hongo. Putnam y Duke (1974), señalan que todas
las técnicas de extracción de aleloquímicos con agua fría,
simulan la liberación natural de componentes con acción alelopática,
manteniéndose las propiedades de las sustancias que son excretadas vía
radical, por lo tanto el extracto utilizado en este experimento podría
representar las propiedades del exudado natural de Lupinus albus L. Basándose
en lo reportado por Vallejos et al., (1998), el alcaloide lupanina aislado
de L. albus inhibe el crecimiento de C. gloeosporioides, a partir
de lo cual se podría inferir que este sería el compuesto responsable
de la inhibición del crecimiento micelial de G. graminis var.
tritici en el presente estudio. Aunque Zamora et al, (2005) al
aislar lupanina desde semillas de L. exaltatus, registró menores
valores de inhibición respecto al extracto crudo, debido probablemente
a un efecto sinérgico de todos los alcaloides presentes. Frente a esto,
Enríquez et al., (2010), plantea que para determinar con exactitud
los compuestos involucrados en la inhibición del crecimiento micelial
de G. graminis var. tritici, sería necesario aislar, identificar
y caracterizar los compuestos químicos presentes en los extractos acuosos
de las especies con potencial alelopático.
CONCLUSIONES
1. El efecto alelopático
diferencial de los extractos acuosos radicales de los cultivares, en la mayoría
de los casos fue inhibitorio y ocasionalmente potenciador del crecimiento micelial.
2. El extracto acuoso radical
de lupino cultivar Typ Top, tuvo frecuentemente mayor efecto alelopático
inhibidor del crecimiento micelial de Gaeumannomyces graminis var. tritici,
en las concentraciones 10%, 30% y 90% v/v.
3. Extractos acuosos radicales
a concentraciones sobre el 30%, presentaron igual efecto alelopático
sobre el crecimiento de Gaeumannomyces graminis var. tritici.
4. Concentraciones de extractos
acuosos radicales menores a 3%, tuvieron respuesta diferencial, siendo el efecto
inhibitorio de Pecosa mayor a 1% y de Typ Top a 3%.
5. Se detectó en
un caso efecto potenciador del crecimiento micelial por parte del extracto acuoso
Pecosa a una concentración de 3% v/v.
BIBLIOGRAFÍA
AN, M., PRATLEY, J.; HAIG, T.
1998. Allelopathy: from concept to reality. In: Proceedings of the 9th Australian
Agronomy. Conference. Wagga Wagga, Australia. pp 56-62.
ANAYA, A., ESPINOSA-GARCÍA,
F.; CRUZ-ORTEGA, R. 2001. Relaciones químicas entre organismos: Aspectos
básicos y perspectivas de su aplicación. Instituto de Ecología.
Ed. Plaza y Valdés. S.A. de C.V. México. 733p.
ARGANDOÑA, V., LUZA, J.,
NIEMEYER, H.; CORCUERA, L. 1980. Role of
hydroxamic acids in the resistance of cereals
to aphids. Phytochemistry 19: 1665-1668.
ARGANDOÑA, V., NIEMEYER,
H.; CORCUERA, L. 1981. Effect of content
and distribution of hydroxamic acids on infestation by the aphids Schzaphis
graminium. Phytochemistry 20: 673-673.
ARYANTHA I., CROSS R.; GUEST
D. 2000. Suppression of Phytophthora
cinnamomi in potting mixes amended with uncomposted and composted animal
manures. Phytopathology 90: 775-782.
BLANCO, Y. 2006. La utilización
de la alelopatía y sus efectos en
diferentes cultivos agrícolas. Cultivos Tropicales 27: 5-16.
BENSCH, E. 2003. Potencial alelopático
diferencial de cultivares de trigo (Triticum aestivum L.) chileno sobre
algunas especies de malezas asociadas al cultivo. Tesis Magister en Ciencias.
Universidad Austral. Valdivia, Chile. 100 p.
BERNAL, A., ZAMORA, J., VIRGEN,
G.; NUÑO, R. 2005. Actividad biológica
in vitro de extractos de Lupinus spp. sobre hongos fitopatógenos. Revista
Mexicana de Fitopatología 23: 140-146.
BOHIDAR, K.; WRATTEN, S.; NIEMEYER,
H. 1986. Effect of hydroxamic acids on
the resistance of wheat to the aphid Sitobion avenae. Annals of Applied
Biology 109: 193-198.
CROTEAU, R., KUTCHAN, T.; LEWIS
N. 2000. Natural products (secondary metabolits)
pp.1250-1318. In Buchanan, B., Guissem, W.; Jones, R. (Eds.) Biochemistry and
molecular biology of plants. American Society of Plants Physiologits. Maryland,
USA pp 1250-1318
ENRÍQUEZ, C., BENSH, E.,
GUERRERO, E.; CONTRERAS, A. 2010. Efecto
de extractos acuosos radicales y foliares
de ecotipos de trigo (Triticum aestivum L.) sobre el crecimiento micelial
in vitro de Gaeumannomyces graminis var. tritici. Revista IDESIA 28: (1) 69-77.
FRENCH, E.; HEBERT, T. 1980.
Métodos de Investigación
Fitopatológica. Instituto Interamericano de Ciencias Agrícolas.
Ed. IICA. San José, Costa Rica. 289 p.
HANLIN, R. 1998. Illustrated
Genera of Ascomycetes, 2a edición.
Ed. American Phytopathological Society. 268 p.
HUTCHINSON, N. 1986. Actividad
antimicótica en Lupinus albus var.
Multolupa: obtención de fracción activa. Tesis Químico
Laboratorista. Universidad de La Frontera. Temuco. Chile. 37 p.
KOGAN, M. 1992. Malezas. Ecofisiología
y estrategias de control. Colección en agricultura. Facultad de Agronomía.
Pontificia Universidad Católica de Chile. Santiago. 402 p.
MERA, M.; ROUANET J. 2003. Contribución
de las leguminosas de grano en rotación
con cereales. In: E. Acevedo (ed) Sustentabilidad de cultivos anuales: Cero
labranza y manejo de rastrojos. Universidad de Chile, Facultad de Ciencias Agronómicas,
Santiago. Serie Ciencias Agronómicas pp 135-136.
ORMEÑO, J. 1997. Aplicación
de la alelopatía en el control de
malezas: El caso del centeno (Secale cereale L.) en Chile. En: Producción
de alimentos orgánicos. Seminario internacional. INIA-Quilamapu,
Chillán. 29-30 de Octubre.
PATRICK, Z., TOUSSOUN, T.; SNYDER,
W. 1963. Phytotoxicity substance in arable
soils associated with decomposition of plant residues. Phytopathology 53: 152-161.
PUTNAM, A.; DUKE, W. 1974. Biological
suppression of weeds: Evidence for allelopathy in accessions of cucumber. Science
185: 370-371.
RICE, E. 1974. Allelopathy. New
York. USA Academy Press. 353 p.
SEPÚLVEDA, G., PORTA,
H.; ROCHA, M. 2003. La participación de los metabolitos secundarios en
la defensa de las plantas. Revista Mexicana de Fitopatología 21: 355-363.
SOBRERO, M.; RONCO, A. 2004.
Ensayo de toxicidad aguda con semillas de lechuga. Internacional Development
Research Centre. Disponible en http://www.idrc.ca/en/ev-84466-201-1-DO_TOPIC.html
THACKRAY, D., WRATTEN, S., EDWARS,
P.; NIEMEYER, H. 1990. Resistance to the aphids Sitobion
avenae and Rhopalosiphum padi in Gramineae
in relation to hidroxamic acid levels. Annals of Applied Biology 116: 573-582.
VALLEJOS, E., SILVA, P., ACEVEDO,
E. 1998. Evaluación del rendimiento de nueve genotipos de lupino en la
zona central. Laboratorio de Relación Suelo-Agua-Planta. Facultad
de Ciencias Agronómicas. Universidad de Chile. Disponible en http://www.sap.uchile.cl/descargas/publicacion/Evaluaci%C3%B3n_del_Rendimiento_de_Nueve_Genotipos_de_Lupino_en~1.pdf.
ZAMORA, F., BERNAL, A., RUIZ,
M., SOTO, M., ESCALANTE, A., VIBRANS, H.
2005. Perfil de alcaloides de semillas de Lupinus exaltatus Zucc. (Fabaceae)
y la evaluación antifúngica del extracto alcaloideo y lupanina
contra fitopatógenos. Revista Mexicana de Fitopatología. 23: 124-129.
ZAMORA, F. GARCÍA, P.,
RUIZ, M. SALCEDO, E. 2008. Composición
de alcaloides en semillas de Lupinus mexicanus (Fabaceae) y evaluación
antifúngica y alelopática del extracto alcaloideo. Agrociencia
42: 185-192.
Fecha recepción antecedentes:
18 de diciembre 2011

