Departamento de Patología Animal, Facultad de Veterinaria de Lugo, Universidad de Santiago de Compostela, Campus Universitario, 27002 Lugo, España.
SUMMARY
Glutathione peroxidase (GSH-Px) in ruminants associated to selenium deficiency pathologies
Selenium is an essential microelement for animals; an adequate
level of this element is necessary in the diet, to maintain health and reproduction.
Most of the selenium is in the erythrocytes as a component of the enzyme glutathione
peroxidase (GSH-Px. E.C. 1.11.1.9). This enzyme plays a major role in the
cellular antioxidant defense system against oxygen radicals (free radicals),
potentially harmful pro-oxidants that are produced during aerobic metabolism.
In this work the pathogenic mechanisms of selenium deficiencies in ruminants
were examined. The inability of the animal to react against peroxidative damage
of free radicals in all of these nutritional deficiencies indicates that GSH-Px
represents the main functions of selenium in the organism, and it makes this
enzyme a very important tool for clinical diagnosis.
Palabras clave: glutatión peroxidasa, selenio, deficiencia, rumiante.
Key words: glutathione peroxidase, selenium, deficiency, ruminants.
INTRODUCCION
El interés de la determinación de los valores de selenio en los animales comenzó cuando se conocieron sus efectos tóxicos, siendo responsable de la Enfermedad del Alcali o vértigo ciego (Franke, 1934). Este interés adquirió una dimensión diferente tras el descubrimiento de su esencialidad para los animales (Schwarz y Foltz, 1957), aunque el verdadero papel de este elemento en el organismo no se puso de manifiesto hasta 1973, cuando Rotruck y col. descubieron su función protectora contra el daño oxidativo, al ser un componente de la enzima glutatión peroxidasa (GSH-Px, E.C. 1.11.1.9). Desde entonces esta selenoenzima se ha aislado en gran cantidad de tejidos pertenecientes a numerosas especies animales (Canther y col., 1976).
Se ha demostrado que la GSH-Px presenta un peso molecular de aproximadamente 80.000 daltons, comprendiendo 4 subunidades, y que contiene 4 átomos gramo de selenio por mol (Canther y col., 1976). La GSH-Px representa además el 75% del selenio sanguíneo, estando contenida en el interior de los glóbulos rojos a los que se incorpora durante la eritropoyesis (Oh y col., 1974; Hill y col., 1992). El hecho de que exista una fuerte correlación entre selenio sanguíneo y GSH-Px (Stevens y col., 1985; Wheatley y Beck, 1988; Hamliri y col., 1990), y que su determinación en sangre sea rápida y sencilla, hace que esta enzima se perfile en la actualidad como una de las medidas indirectas más importantes en el diagnóstico de procesos carenciales de selenio (Wheatley y Beck, 1988; Mackintosh y col., 1989).

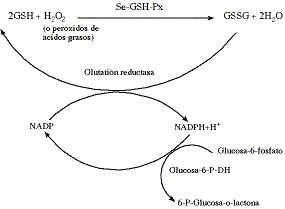
Figura 1. Reacciones en las que participa la glutatión peroxidasa (Maas, 1990).
Reactions in which glutathione peroxidase is involved (Maas, 1990).
EL DAÑO OXIDATIVO
La producción endógena de radicales libres ocurre durante el metabolismo aerobio habitual. En condiciones normales las células metabolizan la mayor parte del oxígeno (95%) hasta agua mediante una vía de reducción tetravalente (figura 2), mientras que un pequeño porcentaje (alrededor del 5%) lo hace mediante una reducción univalente, formándose productos intermediarios altamente tóxicos como anión superóxido (O2•), hidroxilo (OH•), junto con peróxido de hidrógeno (H2O2). No obstante, los organismos evolucionados han desarrollado una serie de mecanismos de defensa contra estas formas de oxígeno altamente reactivas. Básicamente estos mecanismos antioxidativos pueden clasificarse dentro de dos grandes grupos, los enzimáticos y los no enzimáticos. El grupo de enzimas que catalizan las reacciones de los radicales libres está integrado por la superóxido-dismutasa, en sus formas mitocondrial y plasmática, la catalasa y la glutatión peroxidasa; todas ellas actúan acelerando las reacciones por las cuales los radicales libres se reducen rápidamente a agua. Dentro de los no enzimáticos, determinadas macromoléculas como la transferrina, ceruloplasmina o albúmina actúan como antioxidantes ligando a determinados elementos de transición, dentro de los cuales el hierro es el más importante, que están presentes en los fluidos extracelulares, e intervienen como catalizadores metálicos de reacciones oxidativas. Finalmente, compuestos como ascorbatos solubles en agua, glutatión, urato, vitamina E, ubiquinona y ß-caroteno actúan rompiendo las cadenas de peroxidación una vez que éstas han sido iniciadas (Maas, 1990; Miller y col., 1993).
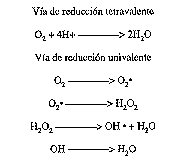
Figura 2. Vías de reducción de oxígeno.
Oxygen reduction paths.
En situaciones donde existe una importante actividad metabólica ?etapas de crecimiento y desarrollo activos, procesos inflamatorios y otras fuentes productoras de estrés (Maas, 1990)?, ocurre una mayor demanda tisular de oxígeno y parte de él se metaboliza siguiendo la vía univalente, generándose multitud de radicales libres nocivos. En este momento, si la carga de oxidantes supera las defensas antioxidantes locales y generales, estos compuestos altamente reactivos lesionan los tejidos al fijarse a los componentes estructurales básicos de las células: ácidos nucleicos (con producción de tumores y enfermedades autoinmunes), proteínas (generando alteraciones enzimáticas de las permeabilidades iónicas de la membrana y de la transducción de señales inter e intracelulares), carbohidratos (en patologías asociadas a la diabetes, cataratas y enfermedades reumáticas) y lípidos (desencadenando una peroxidación lipídica responsable de cambios estructurales y rotura de la bicapa lipídica de las membranas celulares) (Lunec y Blake, 1990; Ramón Giménez, 1993).
Estas alteraciones orgánicas, relacionadas con disturbios oxidativos, adquieren gran importancia en animales con deficiencia de selenio en la dieta, asociados o no a bajas concentraciones de vitamina E en la misma, especialmente en situaciones donde existe una intensa actividad metabólica que hace que los mecanismos de defensa celulares se desborden y aparezcan numerosos efectos tóxicos.
IMPLICACIONES PATOLOGICAS
Alteraciones musculares. En toda la bibliografía se cita al ganado ovino como el que sufre de manera más acusada la carencia de selenio debido a su función GSH-Px-dependiente; nos referimos a la Enfermedad del Músculo Blanco también conocida como Miopatía Exudativa Pigmentaria, Parálisis Enzoótica o Distrofia Muscular Enzoótica. Este proceso afecta principalmente a corderos durante las primeras semanas de vida, debido a la gran demanda de selenio en la etapa de desarrollo muscular tras el nacimiento, momento en el que los procesos de replicación y crecimiento celular son muy intensos y se necesita una elevada actividad antioxidativa. Por otra parte, hasta las seis semanas de edad los corderos dependen directamente del aporte de selenio que reciben a través de la leche de las ovejas, y ésta suele ser deficiente en selenio, encontrando el animal una imposibilidad de combatir los efectos de los radicales libres generados durante este intenso metabolismo (Jiménez y col., 1991). En el ganado bovino este proceso se conoce generalmente como distrofia muscular enzoótica, y afecta sobre todo a terneros durante los primeros meses de vida, siendo los individuos de aptitud cárnica los más predispuestos, ya que, en comparación con los de razas lecheras, los primeros presentan un crecimiento más rápido y, consecuentemente, también un mayor desarrollo de las fibras musculares (Cappa, 1996).
Los radicales libres ejercen su acción patógena dañando la integridad de las membranas celulares, puesto que son capaces de fijarse a un carbono de la cadena alquilo (CH3-(CH2)n-) de un ácido graso, iniciando la peroxidación lipídica. La importancia de este hecho estriba en que las cadenas de ácidos grasos, particularmente los poliinsaturados, se fragmentan justamente por el carbono que se ha transformado en radical libre, con lo que las estructuras fosfolipídicas de las membranas se desorganizan y destruyen (figura 3).
Rammell y col. (1989) y Bostedt
y Schramel (1990) demostraron la existencia de un incremento de la peroxidación
lipídica en el músculo, antes y después del desarrollo
de lesiones visibles en la distrofia muscular enzoótica, confirmando
que la destrucción de las células musculares debida a la peroxidación
lipídica es la causa principal de esta alteración miopática.
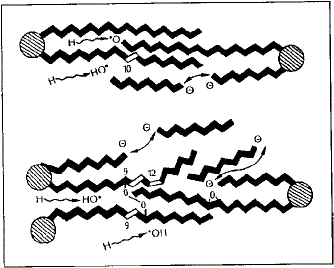
Figura 3. Representación esquemática
del daño producido por los radicales libres en los fosfolípidos
de las membranas celulares. Los trazos negros representan enlaces saturados;
los blancos insaturados; los círculos, las bases. Los radicales libres
se fijan en diversos puntos de las cadenas y las "puentean" (cross linking,
entrecruzamiento catalítico), las desorganizan y las rompen (Tomado de
Ramón Giménez, 1993).
Scheme of the damage produced by free radicals on the phospholipids of
cell membranes. Black lines represent satured links; white lines, unsatured;
circles, bases. Free radicals fix in several places of the chains, making cross
linkings, which results in their disorganization and breaking (Ramón
Giménez, 1993).
La predisposición a la peroxidación lipídica de las membranas depende directamente del contenido en ácidos grasos poliinsaturados de sus fosfolípidos y del número de dobles enlaces que poseen, siendo especialmente sensibles las membranas citosólicas e intracitosólicas (mitocondrias, núcleo, etc.). Como consecuencia del daño muscular producido se liberan al torrente sanguíneo sustancias como mioglobina, creatín quinasa (CK), aspartato-amino transferasa (ASAT), lactato deshidrogenasa (LDH), de importancia en el diagnóstico de la enfermedad (Blood y col., 1992). Histológicamente esta patología cursará con degeneración hialina y calcificación de las fibras musculares y clínicamente se manifestará como un fallo de la musculatura para atender a sus demandas funcionales (Jiménez y col., 1991).
Sistema inmune. En numerosas especies estudiadas la deficiencia de selenio aparece asociada a una reducción de la función inmune. En vacas deficitarias en este oligoelemento se ha descrito una reducción de la actividad GSH-Px en las células fagocitarias, y también una disminución de la capacidad bactericida de los neutrófilos frente a distintos agentes etiológicos como Candida albicans, Corynebacterium pseudotuberculosis, Staphylococcus aureus y Escherichia coli (Larsen y col., 1988; Hogan y col., 1990; Turner y Finch, 1991). Se ha demostrado además que tanto la respuesta inmune celular como la humoral están incrementadas en animales que reciben suplementos de selenio (Nemec y col., 1990; Bires y col., 1993; Morgante y col., 1996).
En la actualidad no está totalmente establecido el papel de este oligoelemento en la respuesta inmune, si bien hay evidencias de que, al menos en parte, responde a la acción protectora ejercida por la GSH-Px. La actividad GSH-Px se incrementa en animales con valores de selenio adecuados, sin llegar a ser deficientes, en respuesta a procesos infecciosos (Stabel y col., 1989), mientras que en aquellos que presentan valores deficientes de este oligoelemento, tras la inoculación con rinotraqueítis infecciosa bovina o parainfluenza tipo 3, no ocurre este incremento de actividad antioxidativa GSH-Px (Reffett y col., 1988a,b). Este comportamiento permite atribuir el incremento de GSH-Px al daño tisular originado por el estrés oxidativo.
El rol antioxidativo se hace muy importante durante la respuesta inmune, donde los neutrófilos producen gran cantidad de especies activas de oxígeno (superóxidos y peróxido de hidrógeno, entre otros radicales libres) en el conocido como "estallido respiratorio", siendo estos compuestos necesarios para su función antimicrobiana (Ross, 1977). Los linfocitos parecen ser especialmente susceptibles al daño peroxidativo originado por estos radicales libres, debido a que sus membranas tienen un contenido relativamente alto de ácidos grasos libres (Marsh y col., 1986). El hecho de que estas membranas celulares estén implicadas en el transporte de sustancias solubles ?teniendo una gran importancia en la fijación de mitógenos y antígenos?, hace que el normal flujo de señales inductivas en el epitelio celular no ocurra, viéndose entonces alterado el desarrollo de la inmunidad mediada por estas células. Estudios histopatológicos revelan que en el tejido linfoide de animales deficientes en selenio tiene lugar un aumento de vacuolización de los epitelios celulares (Marsh y col., 1986), siendo esta pérdida de integridad de la membrana la responsable de su alteración funcional (Kondracki y Bednarek, 1994).
A diferencia de los neutrófilos, la influencia de los bajos valores de selenio sobre la actividad de los eosinófilos en los procesos parasitarios y alérgicos ha sido poco estudiada, no obstante se cree que la alteración de la secreción de los metabolitos del ácido araquidónico, como PGE2, por parte de los macrófagos, podría ser importante en la regulación de su función (Eskew y col., 1989). En dicha regulación juegan un papel importante las especies de oxígeno reactivas originadas en el estallido respiratorio, al estar implicadas en la cadena de formación de prosta-glandinas y leucotrienos (Ramón Giménez, 1993), donde se ha visto que el Se-GSH-Px influye en la actividad de varias enzimas asociadas a la cascada del ácido araquidónico (Reddanna y col., 1989; Hong y col., 1989).
A pesar de las implicaciones de la enzima GSH-Px en el desarrollo de la respuesta inmune, el papel del selenio no está totalmente establecido. La falta de respuesta linfoproliferativa descrita en corderos por Finch y Turner (1989) puede verse rápidamente revertida tras la inyección in vivo de selenito sódico, o mediante la adición de este compuesto a cultivos celulares; tal hecho sugiere que el fallo reside en el microambiente celular más que en las células inmunes en sí mismas. Al tratar de identificar las formas inmunológicamente activas de selenio en el organismo se encuentran además de la GSH-Px otras selenoproteínas cuyo papel en la respuesta inmune todavía no se ha dilucidado (Beilstein y Whanger, 1983). Pese a estos hallazgos, numerosos autores coinciden en señalar la importancia de la GSH-Px como mecanismo antioxidativo celular, en el mantenimiento de la respuesta inmune, y el hecho de que la adición de agentes como tioles (mercaptoetanol), cistina y glutatión a cultivos celulares ?los cuales son responsables del mantenimiento de un ambiente reductor? originen un aumento de la función linfocitaria (Stabel y col., 1991) viene a su vez a confirmar esta hipótesis.
La consecuencia más importante de la reducción de actividad inmune, en animales con bajos niveles de selenio, la constituye el aumento en la incidencia de patologías mamarias. Ello no debe sorprendemos si tenemos en cuenta que durante el período de lactación, y sobre todo en la fase inicial de la misma, las células de la glándula mamaria están sometidas a una intensa actividad metabólica. Aunque no se conoce con exactidud el papel de este oligoelemento en la ubre, Maas (1990) indica que la menor actividad de la GSH-Px representa posiblemente el factor etiológico más importante en este tipo de procesos, fruto de la influencia de esta enzima sobre la actividad de los leucocitos polimorfonucleares, considerados de primera importancia en la fagocitosis y muerte intracelular de los patógenos mamarios (Ndiweni y col., 1991). La suplementación con selenio/vitamina E parece a su vez optimizar la resistencia que presenta el animal provocando un aumento de la función de los macrófagos (Ndiweni y Finch, 1995).
Cuando ocurre un fallo en los mecanismos defensivos, y penetran en la ubre numerosos microorganismos, se produce un aumento de endotoxinas y factores mediadores de la inflamación, como serotonina, histamina y ácido araquidónico, los cuales son responsables de un aumento de la reacción inflamatoria local y daño tisular. Ante un estado de deficiencia de Se-GSH-Px, la concentración de hidroperóxidos aumenta y origina una activación de la ciclooxigenasa y lipooxigenasa, enzimas de la cascada del ácido araquidónico. Es sabido que estas enzimas tienen una necesidad obligada de hidroperóxidos de ácidos grasos para el mantenimiento de su máxima actividad, y por ello la reacción inflamatoria en la ubre en animales con deficiencia de selenio se hace mucho más importante (Maddox y col., 1991). Experimentalmente se comprobó que la bajada de la actividad GSH-Px está asociada con un incremento de prostaglandinas en plasma y leche (Ndiweni y Finch, 1991). Estudios en rebaños con diferentes concentraciones de selenio permiten sugerir a Erskine y col. (1989), al igual que a Ndiweni y col. (1991), que cuando los niveles de este oligoelemento son adecuados la inflamación de los cuartos afectados es menor o de más corta duración, apuntando a su vez que existe una correlación negativa entre el nivel de selenio y la incidencia de mastitis subclínica diagnosticada mediante recuentos celulares al microscopio. Malbe y col. (1995) indican asimismo que el efecto del selenio-GSH-Px en la mastitis se refleja en la disminución de células somáticas y N-acetil-ß-D-glucosaminidasa (NAG-asa) en la leche.
La gran importancia del Se-GSH-Px, tanto en el mantenimiento de la integridad de las membranas, como al suponer la primera barrera defensiva de la ubre, lleva a Pastor Meseguer (1994) a destacar el papel de la vitamina E y del selenio (GSH-Px) como futuros tratamientos intramamarios, debido a la función de ambos antioxidantes en la protección de las membranas frente a la capacidad citotóxica de los peróxidos segregados por los polimorfonucleares para la destrucción de los gérmenes.
Selenio y reproducción. Corah e Ives (1991) hacen una revisión de los procesos patológicos en los que está involucrada la deficiencia de selenio, incluyendo alteraciones del tipo de retención placentaria; infertilidad; abortos, nacimientos prematuros, debilidad o muerte al nacimiento; quistes ováricos; metritis; bajas tasas de concepción, celos silentes o erráticos y pobre fertilización. Miller y col. (1995) indican que la suplementación con selenio y vitamina E ayuda a prevenir alteraciones de la reproducción, fundamentalmente en la época del periparto y mastitis. Santiago (1990) observó como en vacas suplementadas con selenio-vitamina E aumentaba la tasa de concepción, disminuía el número de inseminaciones necesarias para conseguir fertilización, así como el período entre parto y nueva gestación, y afirma que el selenio ha demostrado ser uno de los oligoelementos más importante para la reproducción entre todos los que se han descubierto como esenciales.
A pesar de que el papel de este oligoelemento en la función reproductora tampoco está bien establecido (Mohammed y col., 1991), los efectos positivos de la suplementación de selenio se han asociado con una mayor actividad de la enzima GSH-Px, tanto en sangre como en tejidos (Maas, 1990; McEvoy y Pollock, 1994). Hay claras evidencias de que los animales presentan mayores necesidades de selenio durante la etapa reproductiva (Zachara y col., 1989), puesto que en las rutas metabólicas de los organismos en desarrollo, con un alto número de mitosis, se originan gran cantidad de radicales libres como productos intermediarios. Cuando estos peróxidos no son destruidos por medio de la GSH-Px se producen alteraciones en las membranas celulares que hacen que dichas rutas metabólicas se desregulen fácilmente y ocurran gran cantidad de disturbios metabólicos, cuya consecuencia final será la incapacidad del animal del mantenimiento de la función reproductiva.
El selenio también muestra una gran influencia en la fertilidad del macho afectando a la calidad del semen (Udala y col., 1995). Capaul y col. (1988) encontraron que el plasma seminal contiene elevadas cantidades de GSH-Px, cuya función es proteger a la membrana del espermatozoide del ataque peroxidativo; además, en la cola del gameto masculino hay un selenopéptido que hace que ante una deficiencia de selenio se produzca una fractura en mitad de la cola del espermatozoide.
Procesos que afectan a animales en crecimiento. Desde el punto de vista económico juegan un papel muy importante los procesos que afectan a animales en crecimiento. Conocidos comúnmente como "desmedro", se caracterizan por períodos de crecimiento retrasados, enfermedades del desarrollo, rendimientos subóptimos y enfermedad periodontal (Sanson, 1990). Blood y col. (1992) incluyen estos procesos dentro de la miodegeneración nutricional como forma crónica, puesto que etiopatogénicamente son coincidentes con una manifestación subclínica de alteraciones miopáticas, asociada a una menor capacidad de respuesta del animal a factores estresantes.
Estos procesos resultan, en muchas ocasiones, difíciles de diagnosticar debido a la inespecificidad de los síntomas clínicos, lo que lleva a que se confundan las bajas concentraciones de selenio en los animales con enfermedades de origen parasitario (Santiago, 1990). Sin embargo, cuando concurre una serie de factores predisponentes y ocasionales, tales como cambios climá-ticos o cualquier otro tipo de estrés, la sintoma-tología se agrava considerablemente, pudiendo transformarse en una miodegeneración nutricional aguda. Además, en este momento los animales presentan una gran susceptibilidad a padecer procesos infecciosos, víricos o bacterianos, especialmente cuadros de tipo respiratorio (Jachens, 1993), al presentar una menor capacidad de respuesta inmune.
Procesos antitumorales. Estudios epidemio-lógicos otorgan al selenio un papel en la prevención de varios tipos de tumores (Willett y Stampfer, 1988; Baldew y Goeif, 1989; Benemariya, 1993). Sin embargo la relación inversa entre selenio y cáncer es todavía tema de debate, desconociéndose el mecanismo por el cual ejerce este efecto. Se sabe que los radicales libres, y en especial el ion hidroxilo (OH•), están implicados en la etiología de numerosas enfermedades, incluyendo la formación de tumores, puesto que son capaces de fijarse con extraordinaria avidez a las bases constitutivas del ADN (Dutfie y col., 1989). No obstante, es improbable que el selenio ejerza toda su acción protectora gracias a la función antioxidante de la GSH-Px, puesto que se necesitan niveles de selenio muy altos (400 ng Se/ml), cerca de los valores tóxicos, para lograr una inhibición del crecimiento de las células tumorales.
Estudios muy recientes (Milner, 1995) indican que los efectos del selenio parecen deberse a modificaciones en varios puntos del metabolismo, incluyendo cambios en la bioactivación carcinogénica, además de procesos de detoxifi-cación e inmunocompetencia, funciones estas dos últimas en las que la participación de la GSH-Px está demostrada.
Situaciones estresantes. Los efectos protectores del selenio-GSH-Px frente a daños oxidativos también se ponen de manifiesto en animales sometidos a situaciones estresantes, como el transporte, el calor, el frío, los cambios bruscos de alimentación, el hacinamiento, etc. (Hakkarainen y col., 1987; Maas, 1990; Scholz, 1991, y García Belenguer y col., 1992).
García Belenguer y col. (1991) al estudiar el efecto de la administración de selenio y vitamina E en vacas de lidia, para medir la adaptación al estrés físico producido por el toreo, encontraron una menor liberación de enzimas musculares al torrente circulatorio tras someter a los animales a un esfuerzo físico prolongado. Este hecho pone de manifiesto el efecto protector ejercido por ambos sistemas antioxidantes sobre las fibras musculares, y consideran que la GSH-Px está estrechamente relacionada con la adaptación del animal al ejercicio, ya que durante el mismo se incrementan las peroxidaciones en el tejido muscular. Además, estos mismos autores encuentran mayores niveles de leucocitos en animales complementados con selenio, antes y después de ser sometidos al ejercicio, lo que podría indicar que éstos se adaptan mejor al estrés que supone el toreo.
Santiago (1990) también describe el efecto protector del selenio-vitamina E (a-tocoferol) sobre el estrés que supone el destete en terneros. La suplementación con estos compuestos permite que los animales tratados logren un mayor aumento de peso, con respecto a un grupo control deficiente en selenio.
Otras funciones en el metabolismo intermediario. Además de todas las implicaciones del selenio descritas anteriormente, en la bibliografía se cita a este elemento involucrado en numerosos puntos del metabolismo intermediario: síntesis de algunos seleno-aminoácidos (Vera, 1986); absorción de lípidos en el tracto gastrointestinal, al facilitar la transferencia de éstos a través de las membranas celulares (Church, 1993); intervenir en el metabolismo de compuestos sulfhidrilo (Broderius y col., 1973); presentar un efecto favorecedor sobre la actividad global del sistema de la a-cetoglutarato oxidasa (Dukes y Swenson, 1981); intervenir en la función tiroidea, posiblemente facilitando la conversión de T4 en la forma T3, metabólicamente más activa (Arthur y col., 1988; Gutzwiller, 1993), entre sus múltiples funciones.
Se ha visto que algunos de los efectos adversos de la deficiencia de selenio aparecen antes de que sea detectable un cambio de la actividad GSH-Px en sangre (Reiter y Wendel, 1984; Burk, 1989), por lo que se piensa en alguna función del selenio independiente de su papel como componente de la enzima GSH-Px. Son necesarios entonces nuevos trabajos que permitan establecer la competencia de otras formas de selenio en el metabolismo intermediario, puesto que si bien en la actualidad se han descubierto otras proteínas que contienen selenio, el papel de estas moléculas aún no se ha dilucidado (Burk, 1989; Beilstein y Whanger, 1983).
No obstante, debemos tener en cuenta que al profundizar en el conocimiento de los mecanismos patogénicos de las deficiencias de selenio, en todas ellas subyace una patología oxidativa como causante de los disturbios metabólicos, debido a la incapacidad de la GSH-Px para destruir los peróxidos que se producen durante el metabolismo aerobio habitual. Por todo ello, la GSH-Px se convierte en una medida indirecta de selenio de gran importancia en el diagnóstico de procesos carenciales de selenio, no sólo por estar fuertemente correlacionada con el selenio sanguíneo, sino también por proporcionar una buena guía de la protección que presenta el animal frente a los daños oxidativos.
RESUMEN
El selenio constituye uno de los micronutrientes esenciales
para los animales, siendo necesario un adecuado aporte de este elemento en la
dieta para el mantenimiento de la salud y de la reproducción.
La mayor parte del selenio se encuentra contenido en el interior de las células
rojas como componente de la glutatión peroxidasa (GSH-Px, E.C. 1.11.1.9),
enzima que juega un papel central en los procesos celulares de óxido-reducción,
al suponer un importante mecanismo de defensa celular contra las formas de oxígeno
altamente reactivas (radicales libres) que se producen en el organismo durante
el metabolismo aerobio habitual.
En este trabajo se examinaron detalladamente los mecanismos patogénicos
de las alteraciones orgánicas que obedecen a deficiencias de selenio
en rumiantes. La incapacidad del animal de responder al ataque peroxidativo
de los radicales libres en todos estos procesos hace que se piense en la GSH-Px
dependiente de selenio como el mecanismo principal de actuación de este
elemento, y por ello esta enzima se convierte en una medida indirecta de gran
importancia en el diagnóstico clínico de procesos carenciales
de selenio.
_______________________________
Aceptado: 10.03.97.
BIBLIOGRAFIA
ARTHUR, J.R., P.C. McRRICE, G.J. BECKETT. 1988. Thyroid hormone concentrations in selenium deficient and selenium-sufficient cattle, Res. Vet Sci., 45: 122-123.
BALDEW, G.S., J.J.M. DE GOEIJ. 1989. Determination of 75Selenium labelled selenite and metabolities in plasma and urine by high-performance liquid chromatography with on-line radiactivity detection, J. Chromatogr. Biomed. Apply. 496: 111-120.
BEILSTEIN, M.A, P.D. WHANGER. 1983. Dis-tribution of selenium and glutathione peroxidase in blood fractions from humans, rhesus and squirrel monkeys, rats and sheep, J. Nutr. 113: 2138-2146.
BENEMARIYA, H., H. ROBBERECHT, H. DEELSTRA. 1993. Daily dietary intake of copper, zinc and selenium by different population groups in Burundi, Africa, Sci. Total Environ. 136: 49-76.
BIRES, J., A. MICHNA, P. BARTKO, J. PISTL, Z. JUHASOVA. 1993. Zinc, selenium and copper supplementation by means of reticulo-rumen pellets and its effect on the cellular and humoral immune response in sheep, Veterinnární Medicína 38: 597-607.
BLOOD, D.C., O.H. RADOSTITS, J.H. ARUNDEL, C.C. GAY 1992. Medicina Veterinaria. 7 ed., Ed. Interamericana, Madrid.
BOSTEDT, T., P. SCHRAMEL. 1990. The importance of selenium in the prenatal and postnatal development of calves and lambs, Biol. Trace Elem. Res. 24: 163-171.
BRODERIUS, M.A., P.D. WHANGER, P.H. WESWING. 1973. Tissue sulphydril groups in selenium-deficient rats and lambs, J. Nutr. 103: 336-342.
BURK, R.F. 1989. Newer roles of selenium in nutrition, J. Nutr. 119: 1051-1054.
CANTHER, H.E., D.C. HAFEMAN, R.A. LAWRENCE. 1976. Selenium and glutathione peroxidase in health and disease. A review, Trace Elements in Human Health and Disease 2: 165-236.
CAPPA, V. 1996. Importancia y papel del selenio en la alimentación de los bovinos, Veterinaria en Praxis 11: 15-20.
CAPAUL, E.G., A.R. CARCAGNO, L. DELUCA. 1988. Alterations in the semen quality and plasma enzymes in bulls. Relation with selenium deficiency. En: Selenium in Medicine and Biology. Proceedings of the Second International Congress on Trace Elements in Medicine and Biology, Avoriaz, Francia, pp. 377-379.
CORAH, L.R., S. IVES. 1991. The effects of essential trace minerals on reproduction in beef cattle, Vet. Clin. North Am. 7: 41-57.
CHURCH, D.C. 1993. Fisiología digestiva y nutrición de los rumiantes. Ed. Acribia, Zaragoza.
DUKES, H.H., M.J. SWENSON. 1981. Fisiología de los animales domésticos. 4 ed., Ed. Aguilar, México.
DUTFI, G.G., K.W.J. WAHLE, W.P.T. JAMES. 1989. Oxidants, antioxidants and cardiovascular disease, Nutr. Res. Rev. 2: 51-62.
ERSKINE, R.J., R.B. EBERHARDT, P.J. CRASSO. 1989. Induction of E. coli mastitis in cows fed selenium-deficient or selenium-supplemented diet, Am. J. Vet. Res. 50: 2093-2100.
ESKEW, M.L., A. ZARKOWER, W.J. SCHEU-CHENZUBER, J.R. BURGESS, R.W. SCHOLZ, G. HILDENBRANDT, C.C. REDDY. 1989. Effects on inadequate vitamin E an/or selenium nutrition on the release of arachidonic acid metabolites in rat alveolar macrophages, Prostaglandins 38: 79-89.
FINCH, J.M., R.J. TURNER. 1989. Enhancement of ovine lymphocyte responses: a comparison of selenium and vitamin E supplementation, Vet. Immunol. Immunopath. 23: 245-256.
FRANKE, K.W. 1934. A new toxicant occurring naturally in certain samples of plants foodstuffs. I. Results obtained in preliminary feeding trials, J. Nutr. 8: 597.
GARCIA BELENGUER, S., A. PURROY, J.M. GONZALEZ, M. GASCON. 1991. Efecto de la complementación con selenio y vitamina E en vacas bravas sometidas a diferentes prácticas de manejo, Arch. Zootec. 40: 251-260.
GARCIA BELENGUER, S., M. GASCON, A. PURROY, C. ACEÑA. 1992. Distrofia muscular nutricional por deficiencia de selenio y/o vitamina E en rumiantes, Med. Vet. 9: 84-93.
GUTZWILLER, A. 1993. The effect of a diet contain-ing cyanogenetic glycosides on the selenium status and the thyroid function of sheep, Anim. Prod. 57: 415-419.
HAKKARAINEN, J., B. PEHRSON, J. TYOPPO-NEN. 1987. Blood vitamin E, selenium and glutathione peroxidase concentrations in heifers fed either on grass or on winter feed, J. Vet. Med., A. 34: 508-514.
HAMLIRI, A., D.W. JOHNSON, M. KESSABI, W.G. OLSON. 1990. The evaluation of selenium status of sheep from the major production areas of Morocco, Ann. Rech. Vet. 21: 137-142.
HILL, F.I., T.K. WYETH, A.F. DEATH. 1992. Blood selenium concentrations and glutathione peroxidase levels of unsupplemented and supplemented alpacas in New Zealand. En: Trace Elements: Roles, risks and remedies. Proceedings of the New Zealand Trace Elements Group Conference, New Zealand. pp. 135-140.
HOGAN, J.S., K.L. SMITH, W.P. WEISS, D.A. TODHUNTER, W.L. SCHOCKEY. 1990. Relationships among vitamin E, selenium, and bovine blood neutrophils, J. Dairy Sci. 73: 2372-2378.
HONG, Y., C.H. LI, J.R. BURGESS, M. CHANG, A. SALEM, K. SRIKUMAR, C.C. REDDY. 1989. The role of selenium-dependent and selenium-independent glutathione peroxidase in the formation of prostaglandin F2a, J. BioL. Chem. 264: 13793-13800
JACHENS, G. 1993. Studies at selenium-deficient farms on the effect of postnatal selenium/vitamin E supplements on the health of calves in the first weeks of life. Tesis, Tierärzztliche Hochschule. Hannover, Alemania.
JIMENEZ, A., M. GONZALEZ, S. ANDRES, A. DEL NIÑO JESUS, J. SANCHEZ, R. BARRERA, J. RODRIGUEZ, M.C. MAÑE, G. REDONDO. 1991. Enfermedad del músculo blanco, OVIS 12: 9-62.
KONDRACKI, M., D. BEDNAREK. 1994. Effect of selenium and vitamin E on mineral, haematological and immunological values in calves. En: Proccedings 18th World Buiatrics Congress: 26th Congress of the Italian Association of Buiatrics, Bolonia, Italia. pp. 1351-1354.
LARSEN, H.J., K. MOKSNES, G. OVERNES. 1988. Influence of selenium on antibody production in sheep, Res. Vet. Sci. 45: 4-10.
LUNEC, J., D. BLAKE. 1990. Citado por Cohen, R.D.; B. Lewis; K.G.M.M. Alberti; A.M. Denman. 1992. The metabolic and molecular basis of adquired diseases. Ed. Baillière Tindall. Londres.
MAAS, J. 1990. Selenium deficiency in cattle. En: Proceeding XVI World Buiatrics Congress, Salvador, Brasil, pp. 3-13.
MACKINTOSH, C.G., J. GILL, K. TURNER. 1989. Selenium supplementation of young red deer (Cervus elephus), N. Z. Vet. J. 37: 143-145.
MADDOX, J.F., C.C. REDDY, R.J. EBERHARDT, R.W. SCHOLZ. 1991. Dietary selenium effects on milk eicosanoid concentration in dairy cows during coliform mastitis, Prostaglandins 42: 369-378.
MALBE, M., M. KLAASSEN, W. FANG, V. MYLLYS, M. VIKERPUUR, K. NYHOLM, S. SANKARI, K. SUORANTA, M. SANDHOLM. 1995. Comparisons of selenite and selenium yeast feed supplements on Se-incorporation, mastitis and leukocyte function in Se-deficient dairy cows, J. Vet. Med., A. 42: 111-121.
MARSH, J.A., G.F. COMBS, M.E. WHITACRE, R.R. DIETERT. 1986. Effect of selenium and vitamin E dietary deficiencies on chick lymphoid organ development, Proc. Soc. Exp. Biol. Med. 182: 425-436.
McEVOY, J.D., J.M. POLLOCK. 1994. A preliminary study of peripheral lymphocyte function in cows with cronic endometritis, Vet. Rec. 134: 237-238.
MILLER, J.K., E. BRZEZINSKA-SLEBODZINSKA, F.C. MADSEN. 1993. Oxidative Stress, Antioxidants, and Animal Function, J. Dairy Sci. 76: 2812-2823.
MILLER, G.Y., P.C. BARTLETT, R.J. ERSKINE, K.L. SMITH. 1995. Factors affecting serum selenium and vitamin E concentrations in dairy cows, JAVMA. 206: 1369-1373.
MILNER, J.A. 1995. Does dietary selenium really influence the cancer process, Israel J. Vet. Med. 50:137-146.
MOHAMMED, H.O., M.E. WHITE, C.L. GUARD, M.C. SMITH, G.D. MECHOR, C.W. BOOKER, L.D. WARNICK, J.J. DASCANIO, D.G. KENNEY. 1991. A case-control study of the association between blood selenium and cystic ovaries in lactating dairy cattle, J. Dairy Sci. 74: 2180-2185.
MORGANTE, M., D. BEGHELLI, S. RANUCCI, M. PAUSELLI, B. TESSI. 1996. Effetto della somministrazione di selenio e vitamina E sul test di riduzione dell NBT in pecore in lattazione. En: IV Congreso de la Federación Mediterrránea de Sanidad y Producción de Rumiantes, Murcia, España, pp. 32.
NDIWENI, N., J.M. FINCH. 1991. The relationship between the vitamin E/selenium status and the incidence of mastitis in dairy herds near Harare, Zimbabwe Vet. J. 22: 101-109.
NDIWENI, N. T.R. FIELD, M.R. WILLIAMS, J.M. BOOTH, J.M. FINCH. 1991. Studies on the incidence of clinical mastitis and blood levels of vitamin E and selenium in dairy herds in England, Vet. Rec. 129: 86-88.
NDIWENI, N., J.M. FINCH. 1995. Effects of in vitro supplementation of bovine mammary gland macrophages and peripheral blood lymphocytes with alpha-tocopherol and sodium selenite: implications for udder defenses, Vet. Immunol. Immunopath. 47: 111-121.
NEMEC, M., M. HIDIROGLOU, K. NIELSEN, J. PROULX. 1990. Effect of vitamin E and selenium supplementation on some immune parameters following vaccination against brucellosis in cattle, J. Anim. Sci. 68: 4303-4309.
OH, S.H., H.E. GANTHER, W.G. HOEKSTRA. 1974. Selenium as a component of glutathione peroxidase isolated from ovine erythrocytes, Biochemistry 13: 1825-1829.
PASTOR MESEGUER, J. 1994. Mamitis, Buiat. Esp. 4: 6-25.
RAMMEL, C.G., K.G. THOMPSON, G.R. BENTLEY, M.W. GIBBSONS. 1989. Selenium, vitamin E and polyunsatured fatty acid concentrations in goat kids with and without nutritional myodegeneration. N. Z Vet. J. 37:4-10.
RAMON GIMENEZ, J.R. 1993. Radicales libres y antioxidantes en clínica humana. Ed. IDEPSA, Madrid.
REDDANNA, P., J. WHELAN, J.R. BURGESS, M.L. ESKEW, G. HINDENBRANTDT, A. ZARKOWER, R.W. SCHOLZ, C.C. REDDY. 1989. Role of vitamin E and selenium on arachidonic acid oxidation by way of the 5-lipoxygenase pathway, Ann. N. Y. Acad. Sci. 570: 136-145.
REFFETT, J.K., J.W. SPEARS, T.T. BROWN. 1988a. Effect of dietary selenium on the primary and secondary immune response in calves challenged with infectious bovine rhinotracheitis virus, J. Nutr. 118: 229-235.
REFFETT, J.K., J.W. SPEARS, T.T. BROWN 1988b. Effect of dietary selenium on the primary and secondary immune response in lambs challenged with parainfluenza3 virus, J. Anim. Sci. 66:1520-1528.
REITER, R., A. WENDEL. 1984. Selenium and drug metabolisms-II, Independence of glutathione peroxidase and reversibility of hepatic modulations in deficient mice, Biochem. Pharmacol. 33: 1923-1928.
ROSS, D. 1977. Oxidative killing of microorganisms by phagocytic cells, Trends Biochem. Sci. 2: 61-66.
ROTRUCK, J.T., A.L. POPE, H.E. CANTHER. 1973. Selenium: biochemical role as a component of glutathione peroxidase, Science 179: 588-590.
SANSON, R.L. 1990. Selenium supplementation of sheep by topdressing pastures under high rainfall conditions, N. Z. Vet. J. 38: 1-3.
SANTIAGO, C.M. 1990. Usos e influencia del selenio-alfatocoferol. En: Proceeding XVI World Buiatrics Congress, Salvador, Brasil, pp. 15-19.
SCHOLZ, H. 1991. Importance of selenium and vitamin E in calves, Tierätliche Umschau. 46: 194-202.
SCHWARZ, K., C.M. FOLTZ. 1957. Selenium as an integral part of Factor 3 against dietary necrotic liver degeneration, J. Am. Chem. Soc. 79: 3292-3293.
STABEL, J.R., J.W. SPEARS, T.T. BROWN, J. BRAKE. 1989. Selenium effects on glutathione peroxidase and the immune response of stressed calves challenged with Pasteurella hemolytica, J. Anim. Sci. 67: 557-564.
STABEL, J.R., T.A. REINHARDT, B.J. NONNECKE. 1991. Effect of selenium and reducing agents on in vitro immunoglobulin M synthesis by bovine lymphocytes, J. Dairy Sci. 74: 2501-2506.
STEVENS, J.B., W.G. OLSON, B.S. KRAEMER, B.S. ARCHAMBEAU. 1985. Serum selenium concentrations and glutathione peroxidase activities in cattle grazing forages of various selenium concentrations, Vet. Res. 46: 1556-1560.
TURNER, R.J., J.M. FINCH. 1991. Selenium and the immune response, Proc. Nutr. Soc. 50: 275-285.
UDALA, J., A. RAMISZ, W. DREWNOWSKI, B. LASOTA, W. RADOCH. 1995. Semen quality of bulls treated with selenium and vitamin E. Zesyty Naukowe Akademii Rolniczej w Szcecinie Zootechnika 32: 57-63.
VERA, A. 1986. Alimentación y pastoreo del ganado ovino. Servicio de publicaciones de la Universidad de Córdoba.
WHEATLEY, L.E., F.G. BECK. 1988. The influence of season and husbandry on the selenium status of sheep in a deficient area, Br. Vet. J. 144: 246-251.
WILLETT, W.C., M.J. STAMPFER. 1988. Selenium and cancer, Br. J. Med. 297: 573- 574.
ZACHARA, B.A., A.K. BOROWSKA, R. ZAMORSKI, M. KAPTUR. 1989. Blood selenium status, glutathione peroxidase, and creatine kinase activities in ewes durin pregnancy and lactation and in lambs. En: The 6th International Trace Element Symposium, Leipzig, Alemania, pp.1005-1012.