COMUNICACIONES
Identificación mediante biotipos y perfiles proteicos de
Campylobacter aislados de perros*
Identification of Campylobacters isolated from dogs by
using biotypes and protein electrophoretic patterns
G. GIACOBONI1, M.V., Dr.Cs. Vs., Bact.; M.C PUCHURI1,
M. V.; C. CASTELLANO2, M. V., Dr. Cs. Vs; M. G.
ECHEVERRIA3, M. V., Dr. Cs. Vs., Bact., H. FERNANDEZ4
T. M., D. Sc.
1 Laboratorio de Diagnóstico e Investigaciones
Bacteriológicas. Facultad de Ciencias Veterinarias. Universidad Nacional
de La Plata. Calle 60 y 118.CC 296 (1900) La Plata, Argentina
2 Cátedra de Pequeños animales. Facultad
de Ciencias Veterinarias. Universidad Nacional de La Plata.
3 Cátedra de Virología. Facultad
de Ciencias Veterinarias. Universidad Nacional de La Plata. CONICET.
4 Instituto de Microbiología Clínica,
Facultad de Medicina, Universidad Austral de Chile.
SUMMARY
Two hundred and sixty faecal samples obtained with rectal swabs from
dogs were studied for Campylobacter isolation. The samples were
placed on Preston broth and incubated at 43° C for 12 h under a microaerophilic
atmosphere. Then, they were seeded on Skirrow agar and incubated under
the same conditions for 48 h. Campylobacter species were identified
by conventional methods (morphological, biochemical and cultural test),
Lior's biotypes and protein profiles were examined by polyacrylamide gel
electrophoresis, under reducing conditions. The prevalence of thermo-tolerant
Campylobacter species was 7.3%. Fifteen out of 19 Campylobacter
jejuni biotype II isolates were used in electrophoresis. Strain 1522
was employed as reference strain. Analysis of the protein profiles of the
electrophoretic banding patterns presented good correlation with biochemical
tests. All isolates presented a protein band greater than 40-46 Kd and
minor differences in mobility of 40-50 Kd. Four strains lacked the flagellin
(62-64 Kd band). The fact that protein electrophoresis presented heterogeneity
among strains of the same species and biotypes reinforces their importance
as discriminative methods of epidemiological value.
Palabras claves: Campylobacter-biotipificación-electroforesis
Key words: Campylobacter-biotyping-electrophoresis
INTRODUCCION
Las especies termotolerantes de Campylobacter (C. jejuni
subsp. jejuni, C. coli y C. lari), son agentes causantes
de gastroenteritis y diarrea aguda en seres humanos (Blaser,
1983) y reconocen como reservorios naturales una gran variedad de especies
de animales domésticos y silvestres (Blaser,
1983; Yogasundram y col., 1989; Giacoboni
y col., 1993). Los perros y gatos son portadores y, por su estrecha
relación con el ser humano al ser utilizados como mascotas, se describen
como una fuente probable de infección (Skirrow,
1981).
El conocimiento de las especies prevalentes, así como la individualización
e identificación de las cepas aisladas proveen información
epidemiológica y permite relacionar las fuentes de contagio y el
modo de transmisión. Los métodos de tipificación convencionales,
basados en las pruebas bioquímicas, resistencia a varios agentes
y tolerancia a diferentes temperaturas, son pruebas fenotípicas
que se utilizan para caracterizar las cepas aisladas. No obstante, los
diferentes métodos empleados en cada laboratorio pueden conducir
a resultados discrepantes (Onn y Holmes, 1991).
La electroforesis de proteínas en gel de poliacrilamida (SDS-PAGE)
es un método sensible y práctico que complementa la identificación
y clasificación de los microorganismos (Moore
y col., 1980; Donald y col., 1984).
El objetivo de este trabajo fue identificar las especies de Campylobacter
aisladas de perros de la ciudad de La Plata (Argentina), utilizando
métodos convencionales y su biotipificación por el esquema
de Lior, complementado con perfiles proteicos determinados por electroforesis
en SDS-PAGE.
MATERIAL Y METODOS
Se tomaron muestras fecales por hisopado rectal de 260 perros atendidos
en la Facultad de Ciencias Veterinarias de la Universidad Nacional de La
Plata. Las muestras fueron colocadas en caldo Preston de enriquecimiento
e incubadas a 43°C, en atmósfera microaerófila (Campy
Pack, BBL), durante 12 horas. Luego, una alícuota de 0.1 ml fue
sembrada en agar selectivo de Skirrow modificado (agar Brucella 43 g/l,
vancomicina 10 mg/l, trimetroprima 5 mg/l, polimixina B 2.500 U.I/l, vancomicina
10 mg/l, metabisulfito de sodio 0.5 g/l, piruvato de sodio 0.5 g/l, sulfato
ferroso 0.5 g/l y sangre equina desfribrinada 70 ml/l) e incubada en iguales
condiciones de atmósfera y temperatura, durante 48 horas. Para la
identificación presuntiva de las colonias sospechosas se realizó
coloración de Gram, pruebas de oxidasa y de catalasa. La identificación
de especie se realizó según las pruebas bioquímicas
y culturales propuestas por Skirrow y Benjamin
(1980) y la biotipificación, de acuerdo al esquema de Lior
(1984). Las cepas utilizadas para la electroforesis fueron cosechadas
en una solución salina de pH 7.0, a partir de placas de agar sangre
al 5% luego de una incubación de 48 horas a 43°C en microaerofilia.
Las suspensiones bacterianas fueron lavadas 3 veces con la misma solución
y, posteriormente, centrifugadas a 3500 rpm durante 20 minutos. Los sedimentos
así obtenidos, formados por bacterias completas, fueron procesados
en condiciones de reducción, hervidas a 100°C, durante 5 minutos
y sembradas en geles de poliacrilamida (SDS-PAGE) al 7.5%, empleando un
sistema de buffer discontinuo. Las placas (170 x 190 x 1 mm) se sometieron
a 35 mA durante aproximadamente 3.5 horas de acuerdo a la metodología
utilizada por Brooks y col. (1986). Como cepa
de referencia se utilizó cepa humana 1522 de C. jejuni. y
como marcador de peso molecular, un preparado proteico comercial (Pharmacia)
que produce 3 bandas (94, 67 y 43 Kd). La tinción posterior de los
geles se realizó con azul brillante de Coomassie.
RESULTADOS Y DISCUSION
De las 260 muestras estudiadas fueron aisladas 19 cepas de Campylobacter
termotolerantes (7.3%), correspondiendo todas a la especie Campylobacter
jejuni y, según el esquema de Lior, al biotipo II. A pesar de
haber utilizado procedimientos similares en el procesamiento de las muestras,
la prevalencia de Campylobacter encontrada en este estudio fue baja (7.3%),
comparada con la informada por Fernández
y col. (1991, 1994) en la provincia de
Valdivia (Chile) (51.3% y 42.5%). En estos estudios, Fernández
y col. (1991, 1994) encuentran que el
biotipo I de C. jejuni es el más frecuentemente aislado.
En nuestro trabajo, en cambio, el biotipo II fue el único biotipo
aislado. Estas diferencias podrían estar condicionadas por situaciones
epidemiológicas de carácter geográfico-ambiental que
estuviesen favoreciendo el predominio de determinados tipos de cepas (Lastovica
y col., 1986).
De las 19 cepas aisladas, 15 fueron sometidas a análisis electroforético
y denominadas 13, 14, 29, 64, 78, 83, 87, 88, 92, 106, 162, 165, 201, 222 y
259. Los patrones obtenidos en las distintas cepas fueron similares y presentaron
un número de 30 bandas aproximadamente. Dos de ellas (29 y 64) carecieron
de bandas de 35 y 64 kD. Las cepas 87 y 222 no presentaron la banda de 64 kD
y, además, la cepa 87 apareció diferente a las demás, con
ausencia de bandas de 43, 110, 125 y 155 kD. Las cepas 29, 64 y 88 mostraron
perfiles proteicos muy similares entre sí, mientras que en la cepa 201
se apreciaron diferencias de movilidad en las bandas ubicadas entre 40 y 50
kD (figuras 1 y 2).
De acuerdo a la bibliografía consultada, C. jejuni posee un polipéptido
mayor de entre 40 a 46 kD, cuatro menores, constantes, de aproximadamente 27-29,
35-40, 62-64 y 72 kD y uno menor, variable, de entre 70-75 kD. Todas las cepas
compartieron las bandas del polipéptido mayor (40-46kD), pero difirieron
en las 4 proteínas menos constantes, especialmente en la banda de 62-
64 kD que estuvo ausente en cuatro de las quince cepas procesadas. Este peso
molecular corresponde al de la flagelina, proteína termolábil
que podría perderse por las repetidas resiembras realizadas en medios
sólidos (Newell y col., 1984; Wennman
y col., 1985).
|
|
|
|
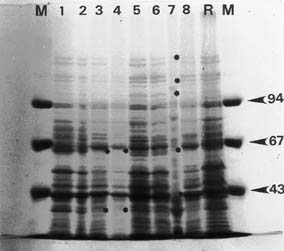
Figura 1: Perfiles proteicos de 8 cepas aisladas e identificadas
como Campylobacter jejuni biotipo II de Lior.
M: marcador de peso molecular expresado en kD (flechas).
R: cepa de referencia humana 1522.
1: cepa 13, 2: cepa 14, 3: cepa 29, 4: cepa 64, 5: cepa 78, 6: cepa 83,
7: cepa 87, 8: cepa 88.
Los asteriscos indican ausencia de bandas.
Protein profile of 8 strains isolated and identified as Campylobacter
jejuni Lior's biotype II.
M: molecular weight marker expressed in kD (arrows).
R: human reference strain (1522).
1: strain 13, 2: strain 14, 3: strain 29, 4: strain 64, 5: strain 78,
6: strain 83, 7: strain 87, 8: strain 88.
Asterisks indicate band absence.
|
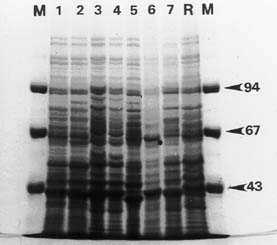
Figura 2: Perfiles proteicos de 7 cepas aisladas
e identificadas como Campylobacter jejuni biotipo II de Lior.
M: marcador de peso molecular expresado en kD (flecha).
R: cepa de referencia humana 1522.
1: cepa 92, 2: cepa 106, 3: cepa 162, 4: cepa 165, 5: cepa 201, 6: cepa
222, 7: cepa 259.
El asterisco marca ausencia de una banda.
Figure 2: Protein profile of 7 strains isolated and identified as Campylobacter
jejuni Lior's byotipe II.
M: molecular weight marker expressed in kD (arrows).
R: human reference strain 1522).
1: strain 92; 2: strain 106, 3: strain 162, 4: strain 165, 5: strain
201, 6: strain 222, 7: strain 259.
Asterisc indicates band absence.
|
La importancia de la aplicación de un método para tipificar las
especies y subespecies del género Campylobacter, reside en la
posibilidad de poder relacionar las cepas encontradas en la amplia variedad
de animales reservorios de estas bacterias con aquellas aisladas en aquellos
casos de infección humana. Existe una amplia variedad de métodos
de tipificación, con diferentes grados de complejidad y discriminación
en cuanto a la técnica y resultados que puedan ser reproducidos en diferentes
laboratorios (Blaser, 1983; Patton
y Wachsmuth, 1992). El esquema de biotipificación de Lior
(1984) es uno de los métodos más utilizados para relacionar
epidemiológicamente las cepas aisladas. Sin embargo, también se
ha utilizado con este propósito la electroforesis de proteínas.
En 1992, Hu y col., utilizando electroforesis en geles
de polialcrilamida (PAGE), realizaron un estudio epidemiológico comparando
el perfil proteico de 41 cepas de C. jejuni de origen animal y humano,
concluyendo que, por los patrones obtenidos, es posible establecer relaciones
de identidad entre las cepas aisladas de pollos y otros animales y las de infecciones
humanas.
Si bien a la electroforesis se le considera un método complejo para
tipificar Campylobacter (Patton y Wachsmuth, 1992)
y de discriminación moderada a baja, en nuestro trabajo este método
mostró heterogeneidad entre las cepas aisladas de una población
canina, aunque las mismas pertenecieron todas a un mismo biotipo. El hecho de
que la electroforesis de proteínas haya demostrado heterogeneidad entre
cepas de una misma especie y biotipo, reafirma su importancia como método
de discriminación epidemiológica. No obstante lo anterior, estimamos
necesario realizar estudios de biología molecular de mayor profundidad
que permitan explicar las diferencias encontradas en los perfiles proteicos
de las cepas analizadas.
RESUMEN
Se estudiaron 260 muestras fecales obtenidas por hisopado rectal atendidos
en la Facultad de Ciencias Veterinarias de la Universidad Nacional de La
Plata. Para el aislamiento de Campylobacter se utilizó caldo
Preston de enriquecimiento, incubado a 43°C durante 12 h en microaerofilia
y siembra en agar Skirrow incubado en iguales condiciones por 48 h. La
identificación de especie se realizó por los métodos
convencionales, la biotipificación por el método de Lior
y los perfiles proteicos se determinaron en geles de poliacrilamida bajo
condiciones de reducción. La prevalencia de Campylobacter termotolerantes
fue de 7.3%, resultando 19 cepas identificadas como C. jejuni biotipo
II. De éstas, 15 fueron sometidas a electroforesis, utilizándose
la cepa humana 1522 como referencia. Los perfiles proteicos obtenidos de
las cepas fueron similares y presentaron un número de 30 bandas
aproximadamente. Todas las cepas compartieron las bandas del polipéptido
mayor de 40-46 kD. Las diferencias se observaron en la carencia de algunas
bandas o en su movilidad entre las de 40 y 50 kD. El hecho de que la electroforesis
de proteína haya demostrado heterogeneidad entre cepas de una misma
especie y biotipo, reafirma su importancia como método de discriminación
epidemiológica.
AGRADECIMIENTOS
Al Dr. Miguel Angel Petruccelli, por su colaboración en la impresión
fotografica.
Aceptado: 31.08.99.
* Trabajo parcialmente financiado por los proyectos DID.UACH
S-97-21 y FONDECYT1980920.
BIBLIOGRAFIA
BLASER, M.J. 1983. Epidemiology of Campylobacter
jejuni infection, Epidemiol. Rev. 5: 157-176.
BROOKS, B., M. GARCIA, D.E FRASER, H.LIOR,
B. STEWART, A.M. LAMMERDING. 1986. Isolation and characterization of cephalotin-susceptible
Campylobacter coli from slaughter cattle, J. Clin. Microbiol.
24: 591-595.
DONALD A., J.R. FERGUSON, W. DWIGHT, J.R.
LAMBE. 1984. Differentiation of Campylobacter species by protein
banding patterns in polyacrylamide slab gels, J. Clin. Microbiol. 20:
453-460.
FERNANDEZ, H., R. MARTIN, J. THIBAUT. 1991.
Campylobacter intestinal carriage among stray and pet dogs, Rev.
Saúde Públ. (Sao Paulo) 25: 473-475.
FERNANDEZ, H., K. KAHLER, R. SALAZAR, M.A.
RIOS. 1994. Prevalence of thermotolerant species of Campylobacter
and their biotypes in children and domestic birds and dogs in southern
Chile, Rev. Inst. Med. Trop. (Sao Paulo) 36: 433-436.
GIACOBONI, G., K. ITOH, K. HIRAYAMA, E.
TAKAHASHI, T. MITSUOKA. 1993. Comparison of fecal Campylobacter in
calves and cattle of different ages and areas in Japan, J. Vet. Med.
Sci. 55: 555-559.
HU, L., Z. CHEN, B. WANG. 1992. Studies of outer
membrane protein profiles by SDS-PAGE for Campylobacter jejuni in
an epidemiological investigation, J. West. China Univ. Med. Sci.
23: 280-283.
LASTOVICA, A.J., E. LE ROUX, R.V. CONGI,
J.L. PENNER. 1986. Distribution of sero-biotypes of Campylobacter jejuni
and C. coli isolated from paediatric patients, J. Med. Microbiol.
21:1-4.
LIOR, H. 1984. New, extended biotyping scheme
for Campylobacter jejuni, Campylobacter coli and Campylobacter
laridis, J. Clin. Microbiol. 20: 636-640.
MOORE, W.E.C., D.E. HASH, L.V. HOLDEMAN, E.P.
CATO. 1980. Polyacrylamide slab gel electropheresis of soluble proteins
for studies of bacterial floras, Appl. Environ. Microbiol. 39: 900-907.
NEWELL, D. G., H. MC BRIDE, A. D. PEARSON.
1984. The identification of outer membrane proteins and flagella of Campylobacter
jejuni, J. Gen. Microbiol. 130: 1201-1208.
ONN, S. L. W., B, HOLMES. 1991. Effect of inoculum
size on the phenotypic characterization of Campylobacter species,
J. Clin. Microbiol. 29: 923-926.
PATTON, CH.M., K. WACHSMUTH. 1992. Typing
Schemes: Are Current Methods Useful? En: Nachamkin, I., M. J. Blaser, L.
S. Tompkins. (eds.): Campylobacter jejuni. Current status and future
trends. American Society for Microbiology, Washington D.C.
SKIRROW, M.B., BENJAMIN, J. 1980. 1001 Campylobacters:
cultural characteristics of intestinal Campylobacters from man and
animals, J. Hyg. 85: 427-441.
SKIRROW, M.B. 1981. Campylobacter enteritis
in dogs and cats: a "new zoonosis", Vet. Res. Com. 5: 13-19.
WENNMAN, W., J. CHAI, T.J. LOVIE, C. GANDREAU,
C. LIOS, D. G. NEWELL, A.D. PEARSON, D.E TAYLOR. 1985. Antigenic analysis
of Campylobacter flagellar protein and other proteins, J. Clin.
Microbiol. 21: 108-112
YOGASUNDRAM, K., S.M. SHANE, K.S. HARRINGTON.
1989. Prevalence of Campylobacter jejuni in selected domestic and
wild birds in Louisiana, Avian Dis. 33: 664-667.