COMUNICACIONES
1Instituto de Patología Animal.
2
Instituto de Farmacología Veterinaria,
Facultad de Ciencias Veterinarias, Universidad Austral de Chile, Casilla 567,
Valdivia, CHILE.
3Departamento de Análisis Instrumental, Facultad
de Farmacia, Universidad de Concepción,
Casilla 237, Concepción, Chile.
SUMMARY
DL50 of total alkaloids, as well as of two individual alkaloids (spartein and lupanin) found in bitter lupine seeds were determined for ISAbrown and Shavercross pullets.
Three hundred chickens were used for each genetic line: 100 to calculate the dosification of the alkaloids administered, 100 for the spartein dossification and 100 for the lupanin dosification. In order to determine the DL50, the maximal and minimal lethal dose had to be determined first. The three types of products were administered with a catheter directly to the crop. After alkaloids were administrated, birds were kept under observation for several hours.
The results showed that DL50 for spartein was 655 (509-856) mg/kg for the ISAbrown line and 425 (303-544) mg/kg for the SHAVERcross line. DL50 for lupanin was 1.131 (929-1378) mg/kg (ISAbrown line) and 1.271 (1027-1573) mg/kg (SHAVERcross line). DL50 for total alkaloids in lupine seeds was 958 (854-1070) mg/kg (ISAbrown line) and 961 (890-1037) mg/kg (SHAVERcross line).
As a conclusion lupanin was the alkaloid that presented the highest DL50 values followed by the total alkaloids and finally spartein.
Palabras claves: pollas reposición, alcaloides lupino, dosis letal media.
Key words: pullet, lupin alkaloids, medial lethal dose.
INTRODUCCION
La semilla del lupino es un excelente nutriente proteico - energético, de producción nacional, que se utiliza en la alimentación aviar. Sin embargo, en las variedades conocidas como amargas, su utilización se ve restringida por el alto contenido de alcaloides en sus granos.
Algunos factores antinutritivos que se han encontrado en la semilla de lupinos en cantidades mínimas son inhibidores de la tripsina, saponinas, hemoaglutininas, vicinas, convicinas y taninos. (Tapia, 1982). En cantidades más importantes están los alcaloides, compuestos nitrogenados no proteicos, la mayoría de ellos derivados quinolizidínicos de variada complejidad, que le confieren el sabor amargo a la semilla, según la cantidad presente ( Hill, 1986; von Baer y col., 1997).
En cuanto al papel que cumplen los alcaloides en la planta hay antecedentes que indican que pueden ser importantes para el metabolismo primario o el desarrollo de la planta como regulador u hormona de crecimiento, transportadores de N, o reserva de N, ya que se pueden transformar en aminoácidos. En ensayos realizados con purificados de esparteína y lupanina, se ha concluido que esparteína inhibe la multiplicación del virus X de la papa, el crecimiento de bacterias gram positivas y gram negativas y algunos hongos fitopatógenos, así también lupanina inhibe la formación de esporas (Wink, 1991).
La especie Lupinus albus, según el porcentaje de alcaloides en la semilla, se clasifica en 4 tipos: dulce hasta 0.05%, semidulce 0.051% a 0.15%, semiamargo 0.151 a 0.30% y amargo más de 0.30% (von Baer y col., 1992).
Los cultivares dulces, los cuales no presentan limitaciones para su uso en alimentación de aves ( Mc Ginnis, 1990), fueron introducidas en Chile por von Baer a contar de 1949. Ya en 1970, la superficie sembrada de Lupinus albus correspondía a 329 hectáreas, llegándose en 1995 a aproximadamente 24.800 hectáreas (Agroanálisis, 1996). Una década después de su introducción, se produjo una regresión a las formas amargas, debido principalmente a una falta de renovación constante de semilla dulce en los cultivos (von Baer, 1993).
En el grano maduro, tanto en Lupinus albus como en Lupinus angustifolius, el principal alcaloide es la lupanina, la cual en los granos de ambas especies, generalmente representa más de la mitad de los alcaloides totales. La semilla de L. albus contiene además proporciones menores de albina, 13 alfa - hidroxilupanina y multiflorina, además de trazas de esparteína, omodendrina, tetrahidrorombiflorina, angustifolina y ésteres de 13 - hidroxilupanina. A su vez, en la semilla de L. angustifolius, alrededor de un 10% de los alcaloides totales corresponde a angustifolina y no hay albina ni multiflorina (Trugo y von Baer, 1998). En ninguna de estas especies está presente lupinina, la cual es el alcaloide mayoritario en los granos de L.luteus, los cuales además contienen alrededor de 30% de esparteína (von Baer y col., 1997).
A pesar de que la esparteína se encuentra en L. albus y L. angustifolius sólo en cantidades trazas, es considerada junto a la lupanina, como los alcaloides más tóxicos presentes en las semillas de lupino (Jurado, 1989). La esparteína y lupanina son considerados tóxicos para los vertebrados por ser agonistas de los receptores de acetilcolina, inhibidores de los canales de Na+ y K+, lo que bloquea la señal de transducción neuronal, probablemente también alteran la síntesis de proteínas (Wink, 1991; Wink and Roberts, 1998).
Los métodos analíticos para la determinación de alcaloides en lupino se han discutido en diversas revisiones (von Baer y Pérez, 1990; Wink, 1992; Wink, 1993; Trugo y von Baer, 1998).
Se describe, en bovinos y ovinos, una intoxicación por lupino, que se produce por la acción directa de los alcaloides sobre el organismo. Se sabe que los efectos tóxicos están relacionados con una dosis alta de alcaloides ingerida en un período corto, por acción directa de ellos sobre el sistema nervioso central. El cuadro clínico se caracteriza por producir depresión respiratoria, acción hipotensora, inhibición de la transmisión neuromuscular y fibrilación cardíaca. En cuadros agudos se ha observado que disminuye drásticamente el consumo de alimento. Especialmente en animales jóvenes hay una alteración metabólica, que reduce la eficiencia alimenticia (Merck, 1993).
Los cultivares dulces no presentan limitaciones para emplearlos en raciones de alimentación de aves, salvo en déficit de aminoácidos azufrados, especialmente metionina (Mc Ginnis, 1990). En el caso de las formas amargas de las semillas de L. albus, como L.angustifolius, las investigaciones en aves de carne: patos (Trautmantt, 1970) o broilers (Cubillos y col., 1977; Rodríguez, 1980; Carrillo, 1995), gallinas de reposición: período de crianza (Guerra, 1979; Klein, 1995; Cubillos y col., 1996a), recría (Riofrío, 1995; Cubillos y col., 1996b) y postura (Ithurbisquy, 1980; Mena, 1994; López, 1995; Burrows, 1996; López y col., 1997), los resultados en general no señalaron efectos tóxicos (Cubillos y col., 1982; Mena, 1994; López y col., 1997) al incorporarlas hasta en un 25% en la crianza de patos y entre un 10 a 12% en broilers y ponedoras. Los rendimientos en los broilers tampoco presentaron diferencias significativas al 5% respecto a sus controles (Rodríguez, 1980; Carrillo, 1995). Los parámetros productivos de ponedoras: ganancia de peso, conversión, masa de huevos producidos, porcentaje de producción de huevos, no presentaron diferencias (p> 0.05) entre los grupos tratados y los controles (Cubillos y col., 1996a y b ; López y col., 1997).
Los estudios de toxicidad que se realizan para evaluar una sustancia, comprenden la determinación de la Dosis Letal 50% (DL50) del producto (exclusiva para la especie animal en estudio) y la caracterización de los cuadros producidos en toxicidad aguda y cónica. En ellos se trabaja con distintas proporciones de la DL50 durante un período determinado de vida útil de la especie que se trate (Jurado, 1989).
El valor de DL50 es el más representativo de la toxicidad aguda de una sustancia, el cual se empez a desarrollar en 1927 por J. W. Trevan y se define como: "aquella dosis que origina la muerte del 50% de los animales", (Jurado, 1989).
Como ya se señal los trabajos realizados se han centrado en la utilización de semillas de lupino incluidas en la dieta de diferentes tipos de aves, pero no se ha establecido la acción directa de los alcaloides del lupino sobre ellas, ni se ha comparado paralelamente la respuesta de líneas genéticas distintas, es por esto que el presente trabajo tiene por objetivo establecer la DL50 de los alcaloides del lupino, como son esparteína y lupanina por separado así como un extracto total obtenido de L. albus, en cuanto a la susceptibilidad de pollas de reposición de dos líneas genéticas distintas, una productora de huevos blancos y la otra de huevos de color marrón, siendo éstas las de mayor utilización en los planteles comerciales.
MATERIAL Y METODOS
Alcaloides del Lupino:
• Alcaloides totales: Extracto de todos los alcaloides de semillas de L. albus (14.8 mg/ml) en solución acuosa.
• Lupanina: Perclorato de lupanina (40 mg/ml), extraída en el laboratorio de semillas de L. albus amargo, en solución acuosa.
• Esparteína: Sulfato de esparteína, en solución acuosa (192mg/cc) (Sigma Chemical Company).
Extracción y purificación de alcaloides. Los alcaloides totales se obtuvieron de semillas de L. albus, en el Laboratorio de Análisis Instrumental de la Universidad de Concepción, según la metodología descrita por Trugo y von Baer (1998), que consiste fundamentalmente en que las semillas molidas se desgrasan con hexano, luego se extraen los alcaloides con metanol en un extractor soxhlet, se evapora el solvente y el extracto se disuelve en agua, se lleva a pH 6 a 6.5, se filtra y estandariza.
La composición del extracto utilizado se aprecia en el cuadro 1.
Aves: 100 pollitas de 10 días de edad, para la determinación de cada DL50, tanto de la líneas de ISAbrown (ponedoras de huevos de color) como SHAVERcross (ponedoras huevos blancos).
Determinación de la DL50: Las pollas se recibieron de 1 día de edad, se mantuvieron en baterías con calefactores, luz, agua y alimento, según los requerimientos establecidos para cada línea genética. Para determinar la DL50 las aves se trataron a los 10 días de edad, previo ayuno de 12 horas. Se pesaron individualmente en una balanza digital con + 0.1 g de precisión., los alcaloides fueron depositados directamente en la ingluvia mediante una jeringa dosificadora provista de una sonda adecuada, las aves se observaron durante 48 horas, registrándose la mortalidad producida por cada dosis.
La metodología aplicada para determinar la DL50 de la lupanina, esparteína y del extracto de los alcaloides totales de lupino, en las pollas ISA brown y SHAVER cross, fue la siguiente:
• Se determinó la dosis letal mínima (muerte de un individuo) y dosis letal máxima (muerte de todos los individuos), en grupos de 4 aves cada uno.
• Se establecieron a lo menos 4 niveles de dosis entre las determinadas anteriormente y se aplicaron a grupos de 10 aves cada uno, para registrar los niveles progresivos de mortalidad y se procedió al cálculo de cada DL50.
Estudio estadístico: El cálculo de la Dl50 se realizó con el programa PCS Farm, al cual se ingresan las distintas dosis y los niveles de respuesta, en este caso mortalidad, para cada una. El programa realiza la regresión lineal dada por la relación probit-log de la dosis según el método gráfico numérico modificado para computadores de Lichfield y Wilcoxon, que entrega la DL50 y el intervalo de confianza al 95% (Tallarida y Murray, 1987; Jurado, 1989). La determinación de diferencias significativas entre las DL50 se realiz mediante X2 de tendencia (Epi Info 5.0).
RESULTADOS Y DISCUSION
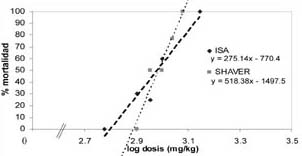
La mortalidad obtenida para cada dosis de alcaloide, tanto en la línea ISA brown, como en la SHAVER cross, junto al ajuste de la curva logarítmica, se presentan en los gráficos 1, 2, y 3, donde se puede apreciar en qué nivel de dosis se produciría una mortalidad del 50%.

|
GRAFICO 1. Curva de mortalidad (%) en pollas de 10 días tratadas con el extracto total de alcaloides de lupino. Mortality curve of 10 day pullets treated with total alkaloids. |
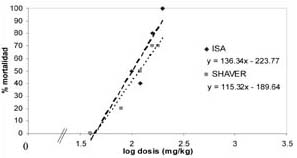
| GRAFICO 2. Curva de mortalidad (%) en pollas de 10 días
tratadas con el alcaloide lupanina.
Mortality curve of 10 day pullets treated with lupanin. |
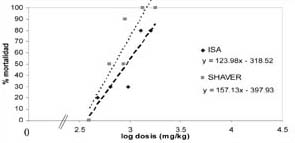
| GRAFICO 3. Curva de mortalidad (%) en pollas de 10 días
tratadas con el alcaloide esparteína.
Mortality curve of 10 day pullets treated with spartein. |
Según la respuesta, medida como mortalidad, frente a las dosis aplicadas, se calculó la dosis de cada alcaloide que causa la letalidad media en las líneas de postura utilizadas (cuadro 2).
Las DL50 de los alcaloides totales de lupino, lupanina y esparteína fueron diferentes (p<0.05) entre la línea ISA y SHAVER. Para las dos líneas genéticas, la esparteína es significativamente más tóxica (p<0.05), ya que presenta DL50 más baja que los alcaloides totales y lupanina, siendo de mayor toxicidad para la línea SHAVER. La lupanina fue el alcaloide menos tóxico para ambas líneas, sin embargo su letalidad fue menor en la línea SHAVER, por presentar la DL50 más alta (p<0.05). La DL50 de lupanina como sustancia pura no es significativamente diferente de la del conjunto de alcaloides de lupino, lo cual es de esperar ya que este purificado contiene 63% de ella.
Las DL50 oral de esparteína obtenidas para las pollitas de reposición fueron mayores que las encontradas en la literatura, tanto en broiler: hembras 288.3 y machos 268.5 mg/kg, (Valdés, 1997), como en ratones : hembras 510 y machos 350 mg/kg (Culvenor y Petterson, 1985).
En cuanto a la lupanina, las DL50 vía oral obtenidas, en el presente trabajo son similares a las de pollos broiler (sexos mixtos) 1247.6 mg/kg (Váldes, 1997) y mayores a las de ratones 410 mg/kg (Wink, 1994).
Los valores obtenidos, tanto en pollitas (Isabrown y Shavercross), broiler (Valdés, 1997) como en ratones (Culvenor y Petterson, 1985) son consistentes con lo planteado por Jurado (1989), quien indica que la DL50 de una sustancia puede variar según la especie animal, sexo, línea genética y vía de administración. Las diferencias de resistencia a sustancias tóxicas entre distintas líneas genéticas de una misma especie animal se podrían deber, por ejemplo, a sutiles cambios en alguna vía metabólica, distintas tasas de absorción o vías de excresión más eficientes (Jurado, 1989).
Loomis (1982) clasifica las DL50 de sustancias químicas según el nivel de dosis en que se encuentran en una escala que comienza en extremadamente tóxico (1mg/kg o menos), altamente tóxico(1 a 50 mg/kg), moderadamente tóxico (50 a 500 mg/kg), ligeramente tóxico (500 a 5000 mg/kg), prácticamente atóxico (5000 a 15000 mg/kg) y relativamente inocuo (más de 15000 mg/kg). Según esta clasificación, sólo la DL50 de la esparteína en la línea SHAVER está en el rango de moderadamente tóxico y las restantes en el nivel de ligeramente tóxico.
En resumen, se logró determinar la DL50 de esparteína y lupanina, en forma separada y como extracto total de los alcaloides presentes en las semillas de L. albus, en pollas de reposición productoras de huevos blancos: 425, 1271 y 961 y de color 655, 1131 y 958 respectivamente, con estos resultados se puede concluir que al estudiar la toxicidad de los alcaloides presentes en la semilla de L. albus en aves de postura, se debe estudiar la toxicidad en la línea genética en que se va a investigar, dada las diferencias observadas entre líneas de ponedoras en este trabajo.
RESUMEN
Se determinó en pollas de reposición, líneas ISA brown y SHAVER cross, la DL50 tanto de alcaloides totales como de esparteína y lupanina en forma individual, presentes en las semillas de lupinos amargos.
Se emplearon 300 pollos por cada línea genética: 100 para los cálculos de las dosis administrando alcaloides totales, 100 para la dosis de esparteína y 100 para lupanina. En la determinación de la DL50 hubo que calcular la DLmáx y la DLmin, realizándose administraciones de los 3 tipos de productos, con sonda directamente a la ingluvia y observándose las aves por un período de horas post administración.
Los resultados de estos estudios establecieron una DL50 de esparteína de 655 (509-856) mg/kg (línea ISAbrown) y 425 (303-544) mg/kg (línea SHAVERcross). En el caso de la lupanina la DL50 fue de 1,131 (929-1378) mg/kg (línea ISAbrown) y 1,271 (1027-1573)mg/kg (línea SHAVERcross). Para los alcaloides totales de la semilla de lupino, se obtuvo una DL50 de 958 (854-1070) mg/kg (línea ISAbrown) y 961 (890-1037) mg/kg (línea SHAVERcross).
Se concluye que la lupanina fue el alcaloide que presentó los valores de DL50 más altos, seguido por los alcaloides totales y finalmente por la esparteína.
Aceptado: 07.09.99.
BIBLIOGRAFIA
AGROANALISIS, 1996. Lupino: Avances en Investigación y Comercialización. Nº 137 pp. 19-21.
BURROWS, C. 1996. Efecto de la incorporación de semillas Lupinus albus dulce versus Lupinus albus amarga en gallinas ISA brown. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias. Valdivia, Chile.
CARRILLO, J.M. 1995. Estudio de la incorporación de semilla de lupino con diferentes porcentajes de alcaloides en la ración de pollos broilers. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
CUBILLOS , A., E. OELCKERS, J. ULLOA. 1977. Reemplazo de afrecho de maravilla por semilla de Lupinus albus var. Astra y Lupinus luteus var. Aurea en alimentación de broilers, Arch. Zoot. (España) 100: 369-377.
CUBILLOS, V., A. CUBILLOS, J. GUERRA. 1982. Estudio histopatológico en hígados de Gallus gallus alimentados con semilla de lupino (altramuz) dulce, Zbl. Vet. Med. A. 29: 215-222 .
CUBILLOS, A., A. RIOFRIO, E. KLEIN, I. MOLINA, D. von BAER. 1996a. Utilización de Lupinus albus y L. angustifolius (variedades dulces y amargas) como fuente proteica en raciones de pollas de reposición, Arch. Med. Vet. 28 : 41-49.
CUBILLOS, A., C. MENA, D. von BAER, I. MOLINA, C. MARDONES. 1996b. Incorporación de semillas de Lupinus albus con diferentes concentraciones de alcaloides en alimentación de ponedoras; Arch. Med. Vet. 28: 51-60.
CULVENOR, C., L. PETTERSON. 1985. Lupin toxins-alkaloids and phomosins. En: IV Int. Lupin Conference, Geraldton, Australia.
GUERRA, J. 1979. Sustitución de afrecho de soya por semilla de Lupinus albus var. multolupa, en alimentación de Gallus gallus. I. Crianza y Recría. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
HILL, G. 1986. Recents developments in the use of lupins in animal and human nutrition. In: Proceeding of the IV International lupin conference. Geraldon, Western Australia, pp. 40-61.
ITHURBISQUY, M. 1980. Sustitución de afrecho de soya por semilla de Lupinus albus variedad multolupa en alimentación de gallinas de postura. Aspectos productivos. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
JURADO, C. 1989. Toxicología Veterinaria. (2ª ed.), Salvat, Barcelona.
KLEIN, B. 1995. Utilización de semillas de lupino dulces versus amargo como fuente proteica en la crianza de pollitas de postura. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias. Valdivia, Chile.
LOOMIS, T.A.1982. Fundamentos de Toxicología. Acribia, Zaragoza.
LOPEZ, J.C. 1995. Estudio del efecto de la incorporación de semilla de lupino amargo en la salud y en la productividad de gallinas ponedoras durante la primera fase de postura. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
LOPEZ, J.C., V. CUBILLOS, A. CUBILLOS, I. MOLINA, H. BÖHMWALD. 1997. Estudio enzimático y anatomopatolgico de ponedoras alimentadas con semilla de Lupinus albus (dulce y amarga) durante 22 semanas, Arch. Med. Vet. 29: 269-278.
Mc GINNIS, J. 1990. Use of lupin in poultry nutrition. In: VI International lupine Conference. Pucón. Chile pp 3.
MENA, C. 1994. Estudio de la incorporación de semilla de lupino con diferentes porcentajes de alcaloides en la ración de gallinas ponedoras. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
MERCK, 1993. El Manual Merck de Veterinaria. (4ª ed.), Océano/Centrum, Barcelona.
REED, L., H. MUENCH. 1938. A simple method for estimating fifty percents and points, Am. J.Hyg 27: 493-497.
RIOFRIO, A.1995. Efecto de la incorporación de Lupinus albus y Lupinus angustifolius con diferentes niveles de alcaloides en raciones de pollas durante la recría. Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
RODRIGUEZ, V. 1980. Utilización de Lupinus albus/Avena nuda como principal fuente energética en reemplazo de maíz/afrecho de raps en pollos broilers. Tesis, M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
TALLARIDA, R., R. MURRAY. 1987. Manual of Pharmacologic Calculations with Computer Programs 2nd ed., Springer. New York. U.S.A.
TAPIA, M. 1982. Proceso Agroindustrial del Tarwi (Lupinus mutabilis). En II Conferencia Internacional del Lupino, Torremolinos, España, pp. 58-62.
TRAUTMANN , J.C. 1970. Efectos de la incorporación de las semillas de Lupinus luteus en la alimentación del Anas platyrhynchos, L. (Raza Pekín). Tesis M.V., Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia, Chile.
TRUGO L.C.; D.von BAER. 1998. Analytical methods for analysis of antinutritional factors in legume seeds. In. Recent advances of research in antinutritional factors in legume seeds and rapseed. Proceedings of 3rd. International Workshop on Antinutritional factors in legume and rapseed. European Association for Animal Production Publication Nº 93. Wageningen Pers.
VALDES, P. 1997. Determinación de la DL50 de esparteína y estudio de su efecto en el comportamiento de pollos broiler al incorporarla a la dieta. Tesis M.V. Universidad Austral de Chile, Facultad de Ciencias Veterinarias, Valdivia. Chile.
von BAER, D., I. PEREZ, 1990. Quality standard propositions for comercial grain of white lupin (Lupinus albus). 6th International Lupin Conference, noviembre 25-30, 1990. Temuco-Pucón, Chile.
von BAER, D., E. von BAER, U.HASHAGEN, R. IBAÑEZ, L. LAMPERTI, .M. MORALES, E. ROSS, P. PUENTES, I. PEREZ, 1992. Proyecto FDP-CORFO "Normas de Calidad de Lupino": Resultados de cosechas 1989, 1990, 1991 y conclusiones finales. En: 1ª Conferencia Nacional del Lupino. Temuco, Chile, pp. 65-75.
von BAER, E. 1993. Manejo del Cultivo. En: Seminario El Lupino una alternativa de progreso. Temuco, Chile.
von BAER, D., M. MARIVIL, E. von BAER, U.HASHAGEN, R. IBAÑEZ. 1997. Alcaloides en semilla de híbridos de Lupinus angustifolius dulce y amargo. Bol. Sociedad Chilena de Química, Nº 629.
WINK, M. 1991. Plant Breeding : High or low alkaloid levels ? Proc. 6th Int. Lupin Conf. Temuco, pp 326 - 334.
WINK, M. 1992. Role of quinolizidine alkaloids in plant-insect interactions. In : Focus and insect plant interactions 4:131-166.
WINK, M. 1993. Quinolizidine alkaloids. In: Methods in plant biochemistry, vol. 8, edit. Watterman, Academic Press London, 197-239.
WINK, M. 1994. Biological activities and potential application of lupin alkaloids. Advances in Lupin research. ISA Piess, Lisboa.
WINK, M., M. ROBERTS, 1998. Alkaloids. Biochemistry, ecology, and medicional applications. Plenum.