
ARTÍCULOS ORIGINALES
S. E. RECABARREN, Biol., M.S. A. LOBOS, M.V., Mg.S.; C. ROBINSON,
Lic. Méd. Vet.;
P. ORELLANA, M.V. Mg.S.; J. PARILO, Ag.
Laboratorio de Fisiología y Endocrinología Animal,
Facultad de Medicina Veterinaria, Universidad de Concepción,
Chillán, Chile.
SUMMARY
The aim of the present work was to characterize the pulsatile LH and GH secretion in food restricted Suffolk ewe lambs (n=5, R-MEL group) receiving daily oral administration of melatonin (3mg/20 mL, at 16:00 h), at 20-26- and 30 weeks of age, after 4,10 and 14 weeks of food restriction. Melatonin treatment was initiated at 10 weeks of age. Food restricted lambs of the same age, without melatonin treatment acted as comparative group (n=6, R-SOL). Blood samples were collected from a jugular vein by means of an indwelling catheter at 10 min-intervals for 6 hours, from 09:00 h. LH and GH were measured by radioimmunoassay. Plasma concentrations of both hormones were analyzed by the Cluster program to define pulse frequency (n° pulses/6h), and pulse amplitude (ng/mL). The transversal mean of LH and GH was also calculated (ng/mL/6h). In the R-MEL group, the transversal mean of LH tended to increase from 0.35± 0.04 in 20 weeks old lambs to 0.61± 0.15 ng/mL/6h in 30 weeks old lambs while remained unchanged in the R-SOL group: 0.34± 0.03 and 0.25±0.05 ng/mL/6h, respectively. LH pulse frequency did not change and was not different between both groups. LH pulse amplitude tended to be higher in R-MEL than in R-SOL lambs at 30 weeks of age: 0.76± 0.28 and 0.38± 0.09 ng/mL, respectively (P<0.07). In contrast to the low effect of melatonin on LH secretion, the transversal mean and the GH pulse amplitude were significantly modified by the melatonin treatment. R-MEL lambs had mean concentrations of 3.28±1.14, 6.25±1.88 and 7.26±1.57 ng/mL/6h at 20,26 and 30 weeks, respectively while R-SOL lambs had 15.69±1.37 (P<0.01), 13.25±2.66 (P<0.02) and 19.12±3.88ng/mL/6h (P<0.03), respectively. Pulse amplitude was also lower in R-MEL than in R-SOL lambs at 20, 26 and 30 weeks of age. GH pulse frequency was not different between groups and ages. Results suggest that melatonin is involved in the control of GH secretion in growing sheep, overpassing the metabolic effect of food restriction on GH secretion. However, in the case of LH, the metabolic impact of food restriction is not completely overcome by the stimulatory effect of melatonin on the LHRH/LH secretion, suggesting that the metabolic status of the growing sheep should be in concert with the photoperiod to coordinate the initiation of puberty.
Palabras claves: melatonina, secreción de LH y de GH, restricción alimenticia, desarrollo prepuberal.
Key words: melatonin, LH and GH secretion, food restriction, prepubertal development.
INTRODUCCION
El inicio de la pubertad en las ovejas es consecuencia de un aumento en la frecuencia de pulsos, y probablemente también en la amplitud de los pulsos de la hormona luteinizante (LH), lo cual conduce a un rápido aumento en la secreción de estradiol por el ovario, estímulo que en definitiva desencadena la primera alza preovulatoria de LH y la primera ovulación (Foster, 1994).
El momento exacto cuando se desencadena esta cascada de cambios endocrinos está determinado por una serie de señales de origen interno y externo que se transmite hacia el hipotálamo para inducir el cambio en la liberación pulsátil de la hormona liberadora de LH (LHRH). Aunque las señales de origen interno relacionadas con el metabolismo y la nutrición aún no se han definido, se han propuesto entre otras: glucosa, arginina, insulina y leptina (Steiner y col., 1983; Bucholtz y col., 1996; Recabarren y col., 1996; Foster y Nagatani, 1999), las cuales actuarían como pistas metabólicas e indicadoras del grado de desarrollo corporal y tendrían como objetivo estimular la secreción de LHRH a una mayor frecuencia para el inicio de la pubertad. Si la hembra no se alimenta adecuadamente para depositar la energía suficiente para soportar una preñez, esto sería reconocido por el hipotálamo mediante la información entregada por estas señales metabólicas. Como resultado de ello, el aumento en la liberación episódica de LHRH no se produciría y la pubertad se retrasaría. Por otro lado, la secreción de hormona del crecimiento (GH) es también dependiente del estado metabólico. El ayuno o la restricción crónica eleva las concentraciones plasmáticas de GH en ovejas y en borregas (Recabarren y col., 1994; Recabarren y col., 1998c), de tal forma que un indicador del estado metabólico lo constituyen los niveles plasmáticos de GH. Es probable que bajo estas condiciones de altos niveles plasmáticos de GH, ésta sea una información que utiliza el hipotálamo para regular la secreción de LH prepuberal.
La señal más poderosa de origen externo que regula el inicio de la pubertad es el fotoperíodo, el cual es traducido por la glándula pineal mediante la secreción rítmica de melatonina. El ritmo de secreción de melatonina provee la información lumínica al hipotálamo, para que en coordinación con las señales internas, modifique la secreción pulsátil de LHRH en el momento adecuado. El rol de la melatonina en el inicio de la pubertad ha quedado demostrado en varios experimentos, en los cuales se ha adelantado la pubertad con tratamiento con melatonina a borregas prepúberes, y con cambios en el fotoperíodo durante el desarrollo prepuberal (Ronayne y col., 1989; Foster, 1994; Recabarren y col., 1998a). No obstante, el rol de la melatonina en la secreción de GH no está bien definido en la oveja.
Dado que en la oveja prepúber se necesita un óptimo estado metabólico y un adecuado fotoperíodo para el inicio de la pubertad, cabe preguntarse si la administración de melatonina exógena es capaz de contrarrestar el efecto de la restricción alimenticia sobre la secreción de LH y de GH. El objetivo del presente trabajo fue determinar el efecto de la administración oral de melatonina sobre la secreción pulsátil de LH y GH en borregas sometidas a restricción alimenticia. Para ello se administró melatonina a borregas desde las 10 semanas de edad, se inició la restricción alimenticia a las 16 semanas de edad y se comparó la pulsatilidad de LH y de GH a las 20, 26 y 30 semanas de edad con la presentada por borregas de la misma edad, con la misma duración de la restricción alimenticia, sin tratamiento con melatonina.
MATERIAL Y METODOS
Procedimientos generales: Se utilizaron 11 borregas Suffolk down provenientes de la Unidad de Producción Ovina de la Facultad de Agronomía de la Universidad de Concepción, nacidas a fines de agosto. Las borregas se trasladaron a la Facultad de Medicina Veterinaria a las 8 semanas de edad, donde se mantuvieron en pradera con suplementación con alimento peletizado en la mañana y en la tarde, al momento de la estabulación. El alimento estaba constituido por 92,04% de materia seca, 14,38% de proteína total, 16,28% de fibra cruda, 1,38% de extracto etéreo, 41,34% de extracto no nitrogenado, 8,66% de cenizas, y no menos de 2300 Kcal de energía digestible por kilogramo. A las 10 semanas de edad, las borregas se separaron en 2 grupos. Al grupo restringido con melatonina (R-MEL, n=5) se le inició el tratamiento diario con melatonina oral (3 mg/20 ml solvente), administrada a las 16:00 horas (Recabarren y col., 1993), mientras que el otro grupo, designado como restringido sin melatonina (R-SOL, n=6), recibió el solvente. A las 16 semanas de edad, las borregas se estabularon y se inició la restricción alimenticia, que consistió en alimentación correspondiente al 2% del peso corporal dividida en 2 raciones diarias con el alimento peletizado. Con este manejo, las borregas mantuvieron el peso corporal. Dos a 3 días antes de los estudios de pulsatilidad de LH y GH las borregas se trasladaron a la sala de experimentación, se colocaron en bretes individuales y se procedió a la cateterización de una de las venas yugulares de acuerdo a procedimientos ya descritos (Recabarren y col., 1995). Se realizaron muestreos sanguíneos de acostumbramiento, los dos días previos al estudio de pulsatilidad con el fin de minimizar el estrés. A las 20, 26 y 30 semanas de edad, después de 4, 10 y 14 semanas de restricción, se realizó el estudio de pulsatilidad de LH y GH.
Estudio de pulsatilidad de LH y GH. El estudio de pulsatilidad de LH y GH consistió en la colección de muestras de sangre cada 10 min por 6 horas desde las 09:00 y hasta las 15:00 horas a las 20, 26 y 30 semanas de edad. Las muestras (2 ml) se depositaron en tubos de ensayo heparinizados, las que se centrifugaron a 1000 x g por 20 min a 4 Celsius. El plasma se colectó y se conservó congelado hasta la medición de LH y GH por radioimmunoensayo (RIA).
Medición de LH plasmática. Las mediciones de LH plasmática se realizaron por RIA, utilizando LH ovina para iodación LER 1374-A, facilitada por el Dr Leo E. Reichert Jr, antisuero de LH ovina CSU-204, facilitada por el Dr Gordon D. Niswender, y LH ovina S-25 utilizada como estándar, donada por la NIDDK de USA. El coeficiente de variación intra e interensayo fue de 5 y 12% respectivamente. El nivel mínimo de detección, definido como el 90% del buffer control fue de 0,1 ng/ml.
Medición de GH plasmática. Las mediciones de GH plasmática se realizaron por RIA, utilizando reactivos donados por la NIDDK de USA: oGH-I- para iodación, oGH antisuero y oGH estándar, de acuerdo a lo descrito en Recabarren y col., (1991). El nivel mínimo de detección, definido como el 90% del buffer control fue de 0,8 ng/ml con un coeficiente de variación intra- e inter-ensayo de 5 y 13% respectivamente.
Determinación de las características de la secreción pulsátil de LH y GH.
Las características de la secreción pulsátil de LH y GH se determinaron con el programa computacional CLUSTER (Veldhuis y Johnson, 1986). El programa CLUSTER usa un algoritmo reiterativo que identifica los pulsos de una hormona, la frecuencia y la amplitud de ellos, de acuerdo a la forma asignada al pulso, el coeficiente de variación intraensayo del RIA y la determinación de la diferencia entre puntos consecutivos analizados con un test de t (Veldhuis y Johnson, 1986). En el presente trabajo, para la identificación de los pulsos de LH se asignó 1 punto para el máximo y 2 puntos para el mínimo, y un test de t de 2,14 para reducir la probabilidad de identificar pulsos falsos positivos a menos de 1%. Para la identificación de los pulsos de GH se usó una configuración 2 x 2 para el máximo y mínimo respectivamente y un test de t de 2,4, para reducir las posibilidades de identificar falsos positivos a menos de 1%.
Análisis estadístico. La frecuencia de pulsos, la amplitud de los pulsos y el promedio de las concentraciones plasmáticas de LH y GH se analizó mediante Análisis de Varianza de Mediciones Repetidas con el programa computacional STATISTICA for Windows, con dos niveles de Melatonina (con y sin) y tres momentos de medición: 20, 26 y 30 semanas.
Las comparaciones entre niveles de ambos factores (Hormona y Semana) se efectuaron mediante prueba de contrastes ortogonales preestablecidos.
Se consideró un P<0,05 como estadísticamente significativo. Los datos se entregan como promedio ± error estándar.
RESULTADOS
En el cuadro 1 se muestra un resumen de las características de la secreción pulsátil de LH en ambos grupos de borregas. Las concentraciones plasmáticas promedio (ng/ml/6h) descendieron de 0,34 ±0,03 a 0,25±0,05 y la amplitud de pulsos de 0,51 ±0,07 a 0,38±0,09 ng/ml desde las 20 sem a las 30 sem. de edad, en las borregas sin melatonina, sin embargo, estos valores no se diferenciaron entre ambas edades ni de los mostrados por las borregas del grupo R-MEL. Sólo a las 30 sem, en el grupo R-MEL, el promedio de las concentraciones de LH (ng/ml/6h) tendió a ser mayor que aquel que presentan las borregas del grupo R-SOL (P<0,06). En la figura 1, se muestra el perfil de las concentraciones plasmáticas de LH en ambos grupos de borregas a las 20, 26 y 30 semanas de edad, con 4, 10 y 14 semanas de restricción alimenticia. En las borregas del grupo R-SOL, se observó que la secreción pulsátil de LH fue menor que la del grupo R-MEL. Sin embargo, no se presentaron diferencias estadísticas entre ambos grupos.
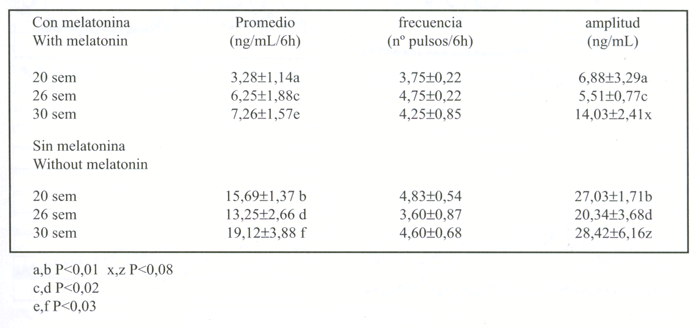
En el cuadro 2 se muestra un resumen de las características de la secreción pulsátil de GH en ambos grupos de borregas. A las 20, 26 y 30 semanas de edad, es decir, después de 4, 10 y 16 semanas de tratamiento con melatonina, las borregas del grupo R-MEL presentaron una concentración plasmática promedio de GH (ng/ml/6h) menor a la del grupo con restricción alimenticia sin melatonina (P<0,01, 0,02 y 0,03 respectivamente). La amplitud promedio de los pulsos de GH fue menor en el grupo R-MEL a las 20 y 26 semanas de edad con una tendencia a ser menor a las 30 semanas (P<0,01, 0,02 y 0,08 respectivamente). La frecuencia de los pulsos no cambió con la duración de la restricción alimenticia ni se diferenció entre los 2 grupos de borregas. En la figura 2 se presenta el perfil de secreción de GH en ambos grupos de borregas a las 20, 26 y 30 semanas de edad.
CUADRO 1. Resumen de las características de la secreción pulsátil de LH en borregas Suffolk con restricción alimenticia a las 20, 26 y 30 semanas de edad, con y sin tratamiento con melatonina oral. El tratamiento con melatonina se inició a las 10 semanas de edad y la restricción alimenticia a las 16 semanas de edad. Datos se muestran como promedio ± e.e.m.
Summary of pulsatile LH secretion in Suffolk ewe lambs under food restriction at 20-26- and 30-weeks of age, with and without oral melatonin treatment. Melatonin treatment was initiated at 10 weeks of age and food restriction at 16 weeks of age. Data is shown as mean ± sem.

CUADRO 2. Resumen de las características de la secreción pulsátil de GH en borregas con restricción alimenticia a las 20, 26 y 30 semanas de edad, con y sin tratamiento con melatonina oral. El tratamiento con melatonina se inició a las 10 semanas de edad y la restricción alimenticia a las 16 semanas de edad. Datos se muestran como promedio ± e.e.m.
Summary of pulsatile GH secretion in Suffolk ewe lambs under food restriction at 20-26- and 30-weeks of age, with and without oral melatonin treatment. Melatonin treatment was initiated at 10 weeks of age and food restriction at 16 weeks of age.
DISCUSION
Los resultados del presente estudio muestran que la administración crónica de melatonina en ovejas prepúberes sometidas a restricción alimenticia no contrarresta el efecto inhibidor de la restricción alimenticia sobre la secreción de LH, pero tiene un profundo impacto sobre la secreción de GH.
La restricción alimenticia genera cambios metabólicos que son reconocidos por el hipotálamo a través de la activación de receptores centrales, probablemente ubicados en el área postrema y núcleo paraventricular (Foster y col., 1998) y posteriormente la información metabólica se retransmitiría mediante vías nerviosas que se conectan con las neuronas LHRH del hipotálamo. La inhibición de la secreción de LHRH producto de los cambios metabólicos sería más poderosa que la estimulación que ejerce la melatonina sobre la secreción de LHRH, impidiendo la presentación de los eventos que conducen a la primera ovulación. Además, las concentraciones plasmáticas de LH y la frecuencia de pulsos de LH en el grupo con restricción alimenticia con administración de melatonina del presente estudio, son más bajas que las exhibidas por ovejas prepúberes creciendo normalmente bajo un fotoperíodo natural sin tratamiento con melatonina o con tratamiento crónico con melatonina bajo un esquema de administración similar al del presente estudio (Recabarren y col., 1998b), en el cual se produjo un adelanto en la edad de inicio de la pubertad. Estos resultados sugieren que las vías nerviosas que se activan en los estados de desbalance metabólico son fundamentalmente de acciones inhibitorias sobre las neuronas LHRH. Uno de estos circuitos neuronales inhibitorios estaría constituido por las neuronas secretoras del neuropéptido Y (Malven y col., 1992; McShane y col., 1992). Las neuronas del neuropéptido Y son activadas por la restricción alimenticia, aumentando la concentración de este péptido (Ober y Malven, 1993; Barker-Gibb y Clarke, 1996). Las vías del neuropéptido Y terminarían en estrecho contacto con las neuronas LHRH (Norgren y Lehman, 1989). La menor secreción de LH durante la restricción alimenticia no sería consecuencia de la activación del eje adrenal como respuesta a un posible estrés ya que otros experimentos (l'Anson y col., 1994; Recabarren y col., 1999; Recabarren y col., 2000) han descartado esta posibilidad. Por otro lado, la restricción alimenticia no disminuiría la sensibilidad hipofisiaria a la LHRH ya que pulsos exógenos de LHRH restituyen la secreción de LH a valores observados en borregas sin restricción alimenticia (Ebling y col., 1990; Kile y col., 1991). El presente experimento, además, refuerza indirectamente la hipótesis de que el efecto de la melatonina sobre la sensibilidad hipofisiaria a pulsos de LHRH es un fenómeno derivado de una mayor secreción basal de LHRH y no un efecto a nivel hipofisiario (Recabarren y col., 1998a).
|
Figura 1. Perfil de secreción pulsatil de LH en borregas Suffolk con restricción alimenticia de 20,26 y 30 semanas de edad, con () y sin () administración de melatonina. La administración de melatonina se inició a las 10 sem. de edad y la restricción alimenticia a las 16 semanas de edad.
Pattern of pulsatile LH secretion in food restricted Suffolk ewe lambs of 20, 26 and 30 weeks of age, with () and without () melatonin administration. Melatonin administration began at 10 weeks of age and food restriction at 16 weeks of age. |
Figura 2. Perfil de secreción pulsatil de GH en borregas Suffolk con restricción alimenticia de 20,26 y 30 semanas de edad, con () y sin () administración de melatonina. La administración de melatonina se inició a las 10 sem. de edad y la restricción alimenticia a las 16 semanas de edad.
Pattern of pulsatile GH secretion in food restricted Suffolk ewe lambs of 20, 26 and 30 weeks of age, with () and without ( ) melatonin administration. Melatonin administration was began at 10 weeks of age and food restriction at 16 weeks of age. |
El aumento en la secreción de GH como resultado de la restricción alimenticia es producto, en parte, de la disminución en las concentraciones plasmáticas de IGF-1. La disminución de las concentraciones plasmáticas de IGF-1 se debería a una menor síntesis, producto de la disminución en la unión de la GH a sus receptores hepáticos (Ketelslegers y col., 1995). La disminución del IGF-1 reduciría el feedback negativo sobre la secreción de GH, ya sea directamente a nivel hipofisiario (Fletcher y col., 1995) o indirectamente a nivel hipotalámico, probablemente por una disminución en la secreción de somatostatina (Tannenbaum y col., 1983) y como resultado de ello, aumenta la GH plasmática. No obstante, la restricción alimenticia ejercería sus efectos sobre la GH en gran parte por acciones a nivel central. Estudios en ovejas adultas han mostrado que la secreción de somatostatina disminuye con la restricción alimenticia mientras que la secreción de GHRH no cambia (Thomas y col., 1991), lo que sugiere que la sensibilidad hipofisiaria a la GHRH aumenta. Hart y col (1986) demostraron que la sensibilidad a la GHRH aumenta en estados de balance energético negativo en ovejas adultas. Por otro lado, se ha demostrado que existen conecciones entre neuronas secretoras de neuropéptido Y y neuronas somatostatinérgicas (Hisano y col., 1990; Okada y col., 1993), con un posible rol inhibidor de este péptido sobre la secreción de somatostatina. Es posible, entonces, que las borregas con restricción alimenticia sin melatonina exógena experimenten una disminución en la secreción de somatostatina, producto de cambios en la influencia ejercida por el neuropéptido-Y, en paralelo a las influencias que ejercería este péptido sobre la secreción de LHRH, generando, en consecuencia, aumentos en la secreción de GH; en particular en la amplitud de los pulsos dada por la mayor sensibilidad de la hipófisis a la GHRH y menor secreción de LHRH. Por el contrario, en las borregas con administración de melatonina, se produciría un aumento en la secreción de somatostatina. Experimentos in vitro con hipotálamos de ratas machos han demostrado que la administración de melatonina, en dosis de 10-7 y 10-8 M, estimula la secreción de somatostatina (Richardson y col., 1981). Estos resultados explicarían la disminución en la secreción de GH observada en las borregas con restricción alimenticia con tratamiento crónico con melatonina. La melatonina habría aumentado la secreción de somatostatina, la cual a su vez disminuiría la secreción de GH. Este fenómeno, a su vez, contrarestaría el efecto de la restricción alimenticia mediada por el neuropéptido-Y y por el IGF-1. Es posible que la melatonina pudiera influir sobre las neuronas secretoras de neuropéptido Y, sin embargo, no hay estudios que hayan evaluado esta interacción.
En resumen, la administración de melatonina oral no modifica la secreción de LH, lo que sugiere que la influencia de señales metabólicas derivadas del proceso de restricción alimenticia crónica es altamente inhibitoria sobre la secreción de LHRH/LH, sobrepasando el efecto estimulador que tiene la melatonina. Sin embargo, en el caso de la GH, la administración de melatonina disminuye la secreción de GH, sugiriendo que la melatonina es una potente hormona reguladora de la secreción de GH, cuya acción sobrepasa los efectos de señales metabólicas sobre la secreción de esta hormona.
Sin embargo, a pesar de que la administración de melatonina disminuye la GH, semejante a lo observado en borregas en crecimiento colocadas en fotoperíodo estimulador, el efecto reducido de la melatonina sobre la secreción de LH sugiere que el estado metabólico de la hembra en crecimiento debe estar en relación con las señales derivadas del fotoperíodo para que se presente la primera ovulación. Si esto no ocurre, como se observa en el presente experimento, el proceso neuroendocrino que conduce a la primera ovulación se posterga, independiente del hecho de que la GH disminuye.
RESUMEN
El objetivo del presente trabajo fue caracterizar la secreción pulsátil de LH y GH en borregas sometidas a restricción alimenticia (n=5, grupo R-MEL), a las 20, 26 y 30 semanas de edad, tratadas diariamente con melatonina (3 mg/día, a las 16:00 h), desde las 10 semanas de edad. La restricción alimenticia se inició a las 16 semanas de edad. Borregas de la misma edad con restricción alimenticia sin administración de melatonina actuaron como grupo comparativo (n=6, R-SOL). El promedio transversal de LH tendió a aumentar desde 0,35± 0,04 a las 20 sem. hasta 0,61±0,15 ng/ml/6h a las 30 sem en las borregas del grupo R-MEL, mientras que en las borregas del grupo R-SOL el promedio no cambió entre ambas edades: 0,34± 0,03 a las 20 sem y 0,25±0,05 ng/ml/6h a las 30 sem. La frecuencia de pulsos de LH no cambió y no fue diferente entre los 2 grupos. La amplitud de pulsos de LH tendió a ser mayor en las borregas R-MEL a las 30 sem: 0,76± 0,28 y 0,38± 0,09 ng/ml respectivamente (P<0,07). En contraste al escaso efecto de la melatonina sobre la secreción de LH, la secreción de GH se modificó significativamente con el tratamiento con melatonina. El promedio transversal y la amplitud de pulsos de GH se redujeron con la melatonina. Las borregas del grupo R-MEL presentaron un promedio transversal de 3,28±1,14, 6,25±1,88 y 7,26±1,57 ng/ml/6h a las 20, 26 y 30 sem. respectivamente, mientras que las borregas del grupo R-SOL tuvieron promedios de 15,69±1,37, 13,25±2,66 y 19,12±3,88ng/ml/6h respectivamente. La amplitud de pulsos fue siempre menor en las borregas del grupo R-MEL que en las del grupo R-SOL a las 20,26 y 30 semanas de edad. La frecuencia de pulsos no fue diferente entre los grupos ni entre las edades. Los resultados sugieren que la melatonina está relacionada con el control de la secreción de GH en la oveja en crecimiento, sobrepasando los efectos metabólicos de la restricción alimenticia. Sin embargo, en el caso de la LH, el impacto metabólico de la restricción alimenticia no logra ser sobrepasado por el efecto estimulador de la melatonina sobre la secreción de LHRH/LH, sugiriendo que el estado metabólico de la hembra en crecimiento debe estar en coordinación con las señales del fotoperíodo para que se pueda iniciar la pubertad.
AGRADECIMIENTOS
Los autores agradecen a la NIDDK de USA por su gentil donación de reactivos para el RIA de GH y LH, y a los Dres Gordon D. Niswender y Leo E. Reichert Jr. por el antisuero a LH y por la LH ovina para iodación respectivamente. Al Dr Mario Briones por su asesoría en el análisis estadístico. Este trabajo fue financiado por Proyecto Fondecyt 95-1020 y DIUC 94.153.001.
_________________________________________
Aceptado: 14.09.2000.
BIBLIOGRAFIA
BARKER-GIBB, M.L., I.J. CLARKE. 1996. Increased galanin and neuropeptide-Y immunoreactivity within the hypothalamus of ovariectomized ewes following a prolonged period of reduced body weight is associated with changes in plasma growth hormone but not gonadotropin levels. Neuroendocrinology 64: 194-207.
BUCHOLTZ, D.C., N.M. VIDWANS, C.G. HERBOSA, K.K. SCHILLO, D.L. FOSTER. 1996. Metabolic interfaces between growth and reproduction. V. Pulsatil luteinizing hormone secretion is dependent on glucose availability. Endocrinology 137: 601-607.
EBLING, F.J.P., R.I. WOOD, F.J. KARSH. 1990. Metabolic interfaces between growth and reproduction. III. Central mechanisms controlling pulsatile LH secretion in the nutritionally growth-limited female lamb. Endocrinology 126: 2719-2727.
FLETCHER, T.P., G.B. THOMAS, F.R. DUNSHEA, L.G. MOORE, I.J. CLARKE. 1995. IGF feedback effects on growth hormone secretion in ewes: evidence for action at the pituitary but not the hypothalamic level. J. Endocrinol. 144: 323-331.
FOSTER, D.L. 1994. Puberty in the sheep. En: The Physiology of Reproduction. (eds.) E. Knobil y J.D. Neill. 2da edición. pp 411-451. Raven Press, Ltd. New York, USA.
FOSTER, D.L., S. NAGATANI, D.C. BUCHOLTZ, H. TSUKAMURA, T. TANAKA, K-I. MAEDA. 1998. Links between nutrition and reproduction:signals, sensors and pathways controlling GnRH secretion. En: Nutrition and Reproduction. (eds.) W. Hansel, S. McCann. Pp 1-22. LSU Press, Baton Rouge, Louisiana.
FOSTER, D.L., S. NAGATANI. 1999. Physiological perspectives on leptin as a regulator of reproduction: role in timing puberty. Biol. Reprod. 60: 205-215.
HART, I.C., P.M.E. CHADWICK, A. COERT, S. JAMES, A.D. SIMMONDS. 1986. Effect of different growth hormone-releasing factors on the concentrations of growth hormone, insulin and metabolites in the plasma of sheep maintained on positive and negative energy balance. J. Endocrinol. 105: 113-118.
HISANO, S., Y. TSURUO, Y. KAGOTANI, S. DAIKOKU, K. CHIHARA. 1993. Immunohistochemical evidence for synaptic connections between NPY containing axons and periventricular somatostatin neurons in the anterior hypothalamus in rats. Brain Res. 520: 170-177.
KETELSLEGERS, J.M., D. MAITER, M. MAES, L.E. UNDERWWOD, J.P. THISSEN, 1995. Nutritional regulation of insulin-like growth factor-I. Metabolism 44: 50-57.
KILE, J.P., B.M. ALEXANDER, G.E. MOSS, D.M. HALLFORD, T.M. NETT. 1991. Gonadotropin-releasing hormone overrides the negative effect of reduced dietary energy on gonadotropin synthesis and secretion in ewes. Endocrinology 128: 843-849.
L'ANSON, H., E.H. QUINT, R.I. WOOD, B.G. ENGLAND, D.L. FOSTER. 1994. Adrenal axis and hypogonadotropism in the growth-restricted female lamb. Biol. Reprod. 50: 137-143.
MALVEN, P.V., S.A. HAGLOF, H. DEGROOT. 1992. Effects of intracerebral administration of neuropeptide Y on secretion of luteinizing hormone in ovariectomized sheep. Brain Res. Bull. 28: 871-875.
McSHANE, T.M., T. MAY, J.L. MINER, D.L. KEISLER. 1992. Central action of neuropeptide-Y may provide a neuromodulatory link between nutrition and reproduction. Biol. Reprod. 46:1151-1157.
NORGREN, R.B., M.N. LEHMAN. 1989. A double label pre-embedding immunoperoxidase technique for electron microscopy using diaminobenzidine and tetramethylbenzidine as markers. J. Histochem. Cytochem. 37: 1283-1289.
OBER, J.A., P.V. MALVEN. 1993. Effect of growth retardation on pituitary luteinizing hormone and hypothalamic neuropeptide Y in ovariectomized sheep. Neuroendocrinology 56: 331-339.
OKADA, K., H. SUGIHARA, S. MINAMI, I. WAKAHAYASHI. 1993. Effects of parenteral administration of selected nutrients and central injection of antiserum to neuropeptide Y on growth hormone secretory pattern in food-deprived rats. Neuroendocrinology 57: 678-686.
RECABARREN, S.E., J. RAMIREZ, L. MANRIQUEZ, P. ORELLANA, J. PARILO. 1991. Concentraciones plasmáticas de hormona luteinizante y hormona del crecimiento en borregas con restricción alimenticia. Agrociencia 7: 155-160.
RECABARREN, M.P., P. ROJAS, A. LOBOS, J. COX, S.E. RECABARREN. 1994. La naloxona bloquea el aumento de la GH y la disminución de glucosa plasmática inducidas por el ayuno en ovejas adultas ovariectomizadas. Resumen 227. XXXVII Reunión anual de la Soc. de Biología de Chile, 23 al 26 noviembre, Puyehue, Chile.
RECABARREN, S.E., A. URRUCELQUI, M. ROBBIANO, A. LOBOS, P. ORELLANA, J. PARILO. 1995. Efecto De la infusión endovenosa de L-Arginina y L-Ornitina sobre la secreción de hormona del crecimiento en ovejas prepúberes. Arch. Med. Vet. XXVII: 99-104.
RECABARREN, S.E., H. ESCOBAR, A. LOBOS, M.P. RECABARREN, J. PARILO. 1996. Luteinizing hormone pulse frequency is increased by arginine infusion in prepubertal sheep. Exp. Clin. Endocrinol. Diabetes 104: 74-79.
RECABARREN, S.E., A. LOBOS, E. CENDOYYA, C. CORREA, I. RUDOLPH. 1998a. Pituitary responsiveness to diurnal and nocturnal GnRH pulses in melatonin treated ewe lambs. 80th annual meeting of the Endocrine Society, June 24, 27. New Orleans, USA.
RECABARREN, S.E., A. LOBOS, J. HENRIQUEZ, C. PEÑEIPIL, J. PARILO. 1998b. Efecto de la administración diaria de melatonina sobre el perfil secretorio de hormona luteinizante en ovejas prepúberes. Agrociencia 14: 303-315.
RECABARREN S.E., A. LOBOS, J. RAMIREZ, P. ORELLANA, J. PARILO, G. IÑIGUEZ. 1998c.Secreción pulsátil diurna y nocturna de hormona del crecimiento en ovejas prepúberes con y sin restricción alimenticia. Arch. Med. Vet. 30: 91-99.
RECABARREN, S.E., A. LOBOS, E. ABALOS, C. ARRIAGADA. 1999. Effect of naloxone infusions on the pulsatile LH secretion, insulin and cortisol plasma concentrations in fasted ewe lambs. Exp Clin Endocrinol Diabetes 107:suppl 1, S-48. 43rd Symposium of the German Society of Endocrinology, Kiel, Germany, March 10-13.
RECABARREN, S.E., A. LOBOS, C. SCHNEIDER, J. COX, J.A. PARILO. 2000. Insulin sensitivity before, during and after fasting in ewe lambs. Arch Med Vet. (En prensa).
RICHARDSON, S.B., C.S. HOLLANDER, J.A. PRASAD, Y. HIROOKA. 1981. Somatostatin release from rat hypothalamus in vitro: effects of melatonin and serotonin. Endocrinology 109: 602-606.
RONAYNE, E., B. JORDAN, J.F. QUIRKE, J.F. ROCHE. 1989. The effect of frequency of administration of melatonin on the time of onset of the breeding season in anestrous ewes. Anim. Reprod. Sci. 18: 13-24.
STATISTICA for Windows. Computer program manual.1997. StatSoft, Inc., 2300 East 14th Street, Tulsa, OK 74104.
STEINER, R.A., J.L. CAMERON, T.H. McNEIL, D.K. CLIFTON, W.J. BREMMER. 1983. Metabolic signals for the onset of puberty. In: Neuroendocrine aspects of reproduction. Editado por. R.L. Norman. pp. 183-227. Academic Press, New York.
TANNENBAUM, G.S., H.J. GUYDA, B.I. POSNER. 1983. Insulin-like growth factors: a role in growth hormone negative feedback and body weight regulation via brain. Science 220: 77-79.
THOMAS, G.B., J.T. CUMMINS, H. FRANCIS, A.W. SUDBURY, P.I. McCLOUD, I.J. CLARKE. 1991. Effect of restricted feeding on the relationship between hypophyseal portal concentrations of growth hormone (GH)-releasing factor and somatostatin, and jugular concentrations of GH in ovariectomized ewes. Endocrinology 128: 1151-1158.
VELDHUIS, J.D., M.L. JOHNSON. 1986. Cluster analysis: a simple, versatile, and robust algorithm for endocrine pulse detection. Am. J. Physiol. 250: E486-E493.