Oxygen reduction pathways.
REVISIONES BIBLIOGRÁFICAS
Importancia del estrés oxidativo en ganado vacuno: en relación con el estado fisiológico (preñez y parto) y la nutrición
Importance of oxidative stress in cattle: its relationship with the physiological condition (pregnancy and parturition) and nutrition
C. CASTILLO, M.V., Dr. Med. Vet; J.L. BENEDITO, M.V., Dr. Med. Vet; M. LÓPEZ-ALONSO, M.V., Dr. Med. Vet; M. MIRANDA, M.V., Dr. Med. Vet; J. HERNÁNDEZ, M.V., Dr. Med. Vet.
Departamento de Patología Animal, Facultad de Veterinaria de Lugo, Universidad de Santiago de Compostela, Campus de Lugo, 27002-Lugo, España.
SUMMARY
Palabras claves: estrés oxidativo, bovino, fisiología, patología.
Key words: oxidative stress, bovine, physiology, pathology.
1. INTRODUCCIÓN
En los últimos años hemos podido asistir al avance de la biología molecular, en un afán de conocer cada vez mejor la patogenia de las enfermedades. Entre los numerosos hallazgos realizados destaca el papel atribuido al oxígeno, una molécula imprescindible para la vida, pero dada su alta reactividad, ahora sabemos que lo que se creía positivo para los organismos vivos, también es un elemento tóxico, dando origen a la conocida paradoja del oxígeno (Miller y col., 1993; Ramón, 1993). Con objeto de contrarrestar tal circunstancia, la naturaleza ha desarrollado sistemas de control, los sistemas antioxidantes, que neutralizan los cambios producidos por el oxígeno y otras sustancias a escala celular. En su estudio, no obstante, aún quedan muchos puntos sin aclarar acerca del funcionamiento de estos sistemas, y todo ello a pesar de la impresionante cantidad de información que estamos obteniendo desde hace pocos años, desde que se supo el papel que jugaban en la patogenia y evolución de ciertas patologías. Basu y col. (1999) señalan en su libro Antioxidants in Human Health and Disease, que en los últimos cinco años se han publicado unos 14.000 artículos relacionados con este tema; esto hace que, además de existir una gran dispersión de la información, sea imposible su acceso completo. Desde nuestro punto de vista, en medicina veterinaria la evolución ha estado revestida de un matiz diferente. El empleo del término estrés oxidativo emana de los numerosos estudios realizados sobre la base de la importancia de los suplementos vitamínico-minerales, para prevenir ciertas patologías metabólicas, o la incidencia de las mastitis. Además, en el primer caso el papel de determinados oligoelementos y vitaminas era analizado sobre todo desde el punto de vista de la enfermedad que podía ocasionar su intoxicación y, sobre todo, la carencia. Así podemos señalar a la enfermedad del músculo blanco, en el caso del selenio y la vitamina E (Ceballos y Wittwer, 1996; López Alonso y col., 1997; Ceballos y col., 1998), la ataxia enzoótica para el cobre (Radostits y col., 2000) o la deficiencia en cinc (Church, 1993), sin ir más lejos. Sin embargo, en los últimos años hemos podido comprobar como se abordan estos estudios, considerando al estrés oxidativo como un trastorno primario, relacionados con la patogenia de ciertas enfermedades como mastitis, problemas de fertilidad o hipocalcemias (Miller y col., 1993; Hidiroglou y col., 1997; Campbell y Miller, 1998) y en los que la suplementación vitamínico-mineral juega un papel curativo y, lo que es más importante, preventivo. De ahí el motivo de este trabajo: creemos que los nuevos enfoques de la patología veterinaria irán, inexcusa-blemente, en esta dirección. Para ello es imprescindible tener una buena base bibliográfica a partir de la cual emprender las diferentes investigaciones. Además, nos hemos centrado en el ganado vacuno, dada su elevada exigencia productiva y que le hace muy susceptible al padecimiento de determinadas enfermedades que pueden estar relacionadas estrechamente con el concepto de estrés oxidativo. Este trabajo está dividido en dos partes: una general, en donde abordamos qué son las sustancias oxidantes, de dónde proceden y cúal es su patogenia, y otra, dedicada al ganado vacuno, donde planteamos, en base a la bibliografía revisada, cúal puede ser la relación del estrés oxidativo y la aparición de ciertas patologías.
1.1. ¿QUÉ SON LAS ESPECIES REACTIVAS DE OXÍGENO U OXIDANTES?. Un radical libre es cualquier molécula o átomo que tiene en su última capa uno o más electrones desapareados (es decir, un número impar). Estos electrones desapareados confieren al radical una enorme reactividad química que le conducirá a interactuar rápidamente con otras moléculas con las que entre en contacto (Ramón, 1993). Esta interacción puede ser con otros radicales o bien con una especie química estable, y lo puede hacer de tres maneras: el radical puede ceder su electrón desapareado (radical reductor), puede tomar uno de la molécula estable para aparear así su electrón (radical oxidante), o bien puede unirse a la molécula estable. En cualquiera de los tres casos la situación resultante es la génesis de otro radical químicamente agresivo. Desde un punto de vista fisicoquímico, la oxidación consiste en la pérdida de electrones por parte de un átomo o una molécula, de manera que disminuye su carga negativa y aumenta la positiva. Lo contrario (adquisición de electrones por parte de un átomo con el consiguiente aumento de la carga negativa), es la reducción. De esta manera, son oxidantes aquellas especies que aceptan electrones, quedando así reducidas con una mayor carga negativa, y reductoras las que donan electrones, con lo que se oxidan y quedan con una carga negativa menor. Toda oxidación implica una reducción: si un átomo cede electrones otro los capta; por ello es más lógico hablar de reacciones de óxido-reducción o redox (Crystal y Ramón, 1992). El oxígeno es una molécula básicamente oxidante, hasta el punto que en las células de metabolismo aerobio es el principal responsable de la producción de especies oxidantes. Sin embargo, como veremos más adelante, no todas ellas tienen un origen endógeno, la existencia de factores exógenos, como la radiación solar, toxinas fúngicas, pesticidas o xenobióticos, pueden incrementar su nivel. A la hora de nombrar estos compuestos la terminología es muy variada. Lo correcto sería definir a estas sustancias como especies reactivas de oxígeno _ERO- (ROM, reactive oxygen metabolites o ROS, reactive oxygen substances, en la bibliografía anglosajona). Químicamente, un radical libre se caracteriza por tener un electrón desapareado y el oxígeno singlete o el peróxido de hidrógeno, derivados del metabolismo del oxígeno (y por tanto ERO), no lo son, ya que ambos poseen el número de electrones apareados. Su peculiaridad consiste en que el peróxido de hidrógeno, sin ser realmente un radical libre se "comporta" como una sustancia oxidante, mientras que el oxígeno singlete presenta un electrón en un orbital de mayor energía, produciendo radicales libres cuando lo cede (Crystal y Ramón, 1992; Ramón, 1993). Por esta razón, emplear el término oxidante, más global, es desde nuestro punto de vista lo adecuado.
| Figura 1. Vías de reducción
del oxígeno. Oxygen reduction pathways. |
1.2. GENERACIÓN DE LAS ESPECIES REACTIVAS. En condiciones normales, las células metabolizan la mayor parte del oxígeno (el 95%) hasta agua, sin formación de intermediarios tóxicomediante la vía de la reducción tetravalente, tal y comose aprecia en la figura 1, mientras que un pequeño porcentaje (en torno al 5%) lo hace mediante la reducción univalente. En este último caso, una molécula de oxígeno más cuatro electrones y cuatro protones forman dos moléculas de agua y tres intermediarios altamente tóxicos, dos de los cuales son literalmente radicales libres (el anión superóxido e hidroxilo). El tercer producto, H2O2 ya vimos que no podía ser considerado como tal (Ramón, 1993). En situaciones en las que exista una mayor actividad metabólica (etapas del crecimiento, desarrollos activos o procesos inflamatorios) ocurre una mayor demanda tisular de O2 y parte de él se metaboliza siguiendo la vía univalente, generándose multitud de sustancias oxidantes (López Alonso y col., 1997). Sin ir tan lejos, la acción de las isoenzimas del citocromo P-450, necesarias para la producción fisiológica de colesterol, hormonas sexuales, glucocorticoides, mineralcorti-coides y formas activas de vitamina D, son generadores de ERO (Miller y col., 1993). La segunda gran fuente de ERO también es endógena y está constituida por el metabolismo de las células defensivas. Los polimorfonucleares, los monocitos sensibilizados, los macrófagos y los eosinófilos, para que puedan cumplir su misión, están dotados de diversos enzimas líticas (proteasas, lipasas, nucleasas, etc.), así como de vías metabólicas que generan varias especies químicamente agresivas _básicamente peróxido de hidrógeno, radicales superóxido e hidroxilo, y probablemente oxígeno singlete-, cuyo fin último es lesionar y destruir elementos extraños. En condiciones normales estas especies reactivas son producidas y utilizadas en compartimentos como los lisosomas que, aunque en el interior de los fagocitos, no tienen por qué dañar a la célula, siempre y cuando los mecanismos antioxidantes de ésta funcionen bien (Crystal y Ramón, 1992). Como puede deducirse de lo anteriormente dicho, los estados inflamatorios son causa de un aumento en la producción de radicales libres que puede terminar desequilibrando la defensa antioxidante celular y afectar a su función, lesionándola incluso en forma irreversible. En la figura 2 se exponen esquemáticamente las vías de generación de ERO en el organismo.
Por último, los oxidantes pueden proceder del exterior, bien sea directamente o como consecuencia del metabolismo de ciertas sustancias. Así tenemos la contaminación ambiental, la luz solar, las radiaciones ionizantes, una concentración de oxígeno demasiado elevada, los pesticidas, metales pesados, la acción de ciertos xenobióticos (cloroformo, paracetamol, etanol, tetracloruro de carbono, violeta de genciana) o el humo de tabaco, por citar algunos ejemplos, ya que este terreno está en constante expansión tal y como se aprecia en las bases de datos consultadas (Agris, Biological Abstracts, Life Sciences Collection, Medline Advanced). Pero el papel de los radicales libres no ha de ser abordado sólo desde una perspectiva negativa o patológica. Estos compuestos cumplen también una función fisiológica, al participar, en condiciones normales, en la defensa frente a las infecciones, en el metabolismo normal (particularmente en la respiración mitocondrial), en la detoxificación microsomal, en la fagocitosis e inflamación, en la formación de prostaglandinas y leucotrienos, en la neurotransmisión, e incluso sirven como mensajeros en la comunicación entre la mitocondria y el núcleo celular (Ramón, 1993; López Alonso y col., 1997; Kehrer, 2000; Lee y col., 2000; Matés y col., 2000).
1.3. ESPECIES REACTIVAS DE OXÍGENO MÁS IMPORTANTES EN EL ORGANISMO Y LA DEFENSA ANTIOXIDANTE. Ya sabemos de donde proceden las especies reactivas de oxígeno. En el cuadro 1 se exponen brevemente las más importantes, destacando sus particularidades.
Cuadro 1. Principales especies
reactivas de oxígeno en el organismo (Duthie y
col., 1989; Crystal y Ramón, 1992; Ramón,
1993).
Principal reactive oxygen species in the body (Duthie
y col., 1989; Crystal y Ramón, 1992; Ramón,
1993).
| ERO | Particularidades |
| Anión superóxido (-O•2) | Formado en reacciones de autoxidación (flavoproteínas, ciclo redox). |
| Radical hidroxilo (•OH) | Formado en las reacciones de Fenton o en la de Haber-Weiss catalizada por metales (hierro). Es la especie de vida media más corta y el más reactivo de todos. Puede captar los electrones de los tioles, por lo que interactúa con las bases nitrogenadas de los ácidos nucleicos, alterando la información genética de las células. También estimula la peroxidación lipídica, afectando a los fosfolípidos de las membranas celulares. |
| Radical peroxilo (ROO•) | Formado a partir de hidroperóxidos orgánicos o del ROOH por pérdida de H+. |
| Peróxido de hidrógeno (H2O2) | Formado a partir de la dismutación del -O•2 o puede proceder directamente del O2. Al no contener electrones despareados no puede ser considerado como un auténtico radical libre. |
| Acido hipocloroso (HOCl) | Producido por acción del estallido respiratorio de las células defensivas. Se origina a partir del H2O2 por acción de la mieloperoxidasa. Tampoco puede ser considerado estrictamente como un radical libre. |
| Oxido nítrico (NO) | Producido por la unión del oxígeno con el nitrógeno, induciendo lipoperoxidación lipídica (Rajaraman y col., 1998). |
| Iones Fe+++ y Cu++ | Actúan como catalizadores en la formación de radicales hidroxilo (Campbell y Miller, 1998), de ahí la importancia que adquieren las proteínas encargadas de transportar estos iones, manteniéndolos "secuestrados" (Leung, 1998; Inanami y col., 1999). |
| Oxígeno singlete (1O2) | Es el oxígeno molecular simple, el primer estado excitado. Se forma por la activación del O2 (luz solar, radiaciones). |
Sabemos que el descubrimiento del metabolismo aerobio por parte de las células trajo consigo la necesidad de protegerse de la oxidación. Una de las primeras estrategias adaptativas fue la de utilizar el oxígeno como receptor de electrones en la cadena respiratoria, lo que genera simplemente agua, una sustancia no tóxica. Además, el oxíg
eno podía ser empleado en otros procesos bioquímicos como la síntesis de hormonas, neurotransmisores o el catabolismo de sustancias tóxicas (Crystal y Ramón, 1992).
Pero las células también han desarrollado mecanismos adaptativos que las protegen de los efectos perjudiciales de los oxidantes. La naturaleza ha dotado a los organismos con metabolismo aerobio de múltiples sistemas detoxificadores o antioxidantes.
Un antioxidante es cualquier sustancia capaz de atenuar los efectos de oxidación de las sustancias oxidantes cuando se añade a éstos. Serían equivalentes a las sustancias tampón, que pueden captar o liberar hidrogeniones y que tienen por tanto una acción amortiguadora sobre los cambios de pH (Sies, 1997; Duthie, 1999).
El descubrimiento, en 1968, de la superóxido dismutasa (SOD), una enzima que actúa específicamente sobre un radical libre, despertó el interés de los científicos por los sistemas antioxidantes. El que hoy conozcamos la existencia de un gran número de sistemas detoxificadores, y el que estén tan distribuidos en los seres vivos, refleja la enorme importancia de estar protegido de la oxidación.
Los sistemas antioxidantes se dividen en dos grupos: Internos (cuadro 2) y Externos. Los primeros se dividen a su vez en enzimáticos (entre los que destacamos la superóxido dismutasa, la cata
lasa, y el sistema de la glutatión y cuyos mecanismos de acción quedan reflejados en la figura 3), y los no enzimáticos (como la albúmina, ciertos ácidos grasos, nicotinamida, ADP, ceruloplasmina, metabolitos estrogénicos, tocoferoles, ácido ascórbico, carotenos o el ácido úrico). El lugar de actuación depende de la enzima, algunos son más efectivos en el interior celular y otros fuera. Lo importante es que ningún compartimento orgánico quede expuesto a los efectos de la oxidación (Ramón, 1993).
Cuadro 2. Principales antioxidantes en
el organismo.
Principal antioxidants in the body.
| Antioxidante | Particularidades |
| Superóxido dismutasa (SOD) | Cataliza la dismutación del -O•2 a H2O2 y O2. Existen tres isoenzimas: 2 intracelulares (la mitocondrial Mn-SOD y la citosólica Cu-Zn-SOD) y una extracelular (Mondola y col., 2000). Se produce especialmente en el epitelio alveolar y en el endotelio. |
| Catalasa (CAT) | Se encarga de destruir el H2O2 transformándolo en H2O y O2. Es sobre todo intracelular, con actividad máxima en hígado y riñones (Céspedes y col., 1996). |
| Glutatión (GSH) | Elemento central de muchos sistemas detoxificadores (Crystal y Ramón, 1992). Molécula que contiene un grupo sulfidrilo que la hace idónea para atenuar el efecto de los oxidantes. Destaca la glutatión peroxidasa (López Alonso y col., 1997) y la glutatión reductasa, encargada de regenerar el GSH consumido. Recientes estudios (Khamaisi y col., 2000) apuntan a que el descenso en los niveles de GSH estaría relacionado con la aparición de síndromes diabéticos. |
| Ceruloplasmina | Inhibidor sérico de la peroxidación lipídica |
| Antiproteasas | Inhiben específicamente la acción de las proteasas y el estallido respiratorio de los neutrófilos |
| Metabolitos estrogénicos | Protegen frente a la lipoperoxidación (Tang y col., 1996). |
| Tocoferoles | Neutralizan al 1O2. Antioxidantes liposolubles que protegen la integridad de las membranas celulares, siendo los más eficaces en esta tarea |
| Acido ascorbico | De acción similar a la CAT, aunque no tan eficaz como ella. |
| Carotenos | Neutralizan al 1O2. Actúan en compartimentos hidrofóbicos. Destaca el licopeno por su efectividad. |
| Acido úrico | Antioxidante a concentraciones fisiológicas (Crystal y Ramón, 1992). Neutraliza los radicales •OH y ROO• y puede prevenir al ácido ascórbico de la oxidación. |
| NADPH | Enzima subsidiaria con capacidad antioxidante (Crystal y Ramón, 1992). Contribuye a la regeneración de la GSH y de la CAT (Krizanovic y col., 1997). |
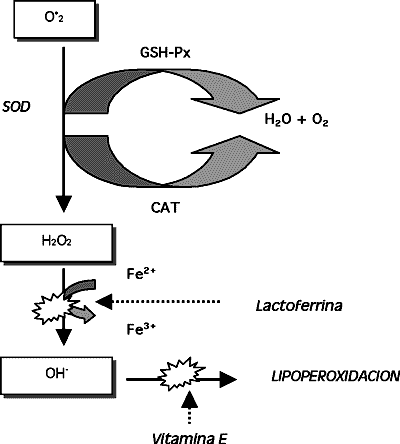 |
| Figura 3. Mecanismos
de defensa contra los daños producidos por las ERO. La superóxido
dismutasa (SOD) junto con la catalasa(CAT) o la glutatión peroxidasa
(GSH-Px) eliminan muchos de estos compuestos. La lactoferrina (que atrapa
el hierro) u otros antioxidantes como la vitamina E, limitan los daños
producidos. |
Las necesidades orgánicas de antioxidantes dependerán de las concentraciones existentes de ERO. Lo que sí se conoce es que su producción está condicionada por dos hechos: la influencia genética, que sería quien regula la producción total en primera instancia, y la influencia ambiental, que podría alterar la síntesis de alguno de ellos en particular (Kow, 1999). La influencia genética explicaría las diferencias encontradas por Tiidus y col. (1999) en determinados sistemas antioxidantes de ratas y que están relacionadas con el sexo. De acuerdo a este estudio, las hembras poseen mayores niveles de vitamina E en hígado y tejido cardíaco que los machos, mientras que éstos muestran índices superiores de vitamina C en músculos. Por el contrario, los niveles hepáticos de la enzima glutatión son significativamente inferiores en las hembras. Esto nos induce a pensar, ya en el campo de la medicina veterinaria, si existirán también diferencias raciales, basándonos en la selección genética que el hombre ha hecho de los animales con fines productivos, de manera que pueda existir una cierta "susceptibilidad" racial al padecimiento de un estrés oxidativo ante determinadas circunstancias. Creemos que el estudio comparado del sistema antioxidante y el grado de estrés que puede existir en determinados momentos, en función de la raza, nos podría aportar una valiosa información
En lo que respecta a los antioxidantes artificiales, algunos ya han comenzado a emplearse en medicina humana con total eficacia. Se ha comprobado que los aportes exógenos de grupos SH, como los que contiene el fármaco N-acetilcisteína son capaces de regenerar el glutatión (Crystal y Ramón, 1992; Ramón, 1993; Lee y col., 2000). El dimetilsulfóxido (DMSO), la etil-dimetiltiourea y el mismo etanol poseen efecto antioxidante y pueden neutralizar el efecto pernicioso del radical hidroxilo (Ramón, 1993). Por otro lado, ciertos fármacos como la indometacina, y, posiblemente, también otros antiinflamatorios no esteroideos, al bloquear la vía de la ciclooxigenasa, inhiben la hiperreactividad inducida por los oxidantes inhalados, aunque no puede asegurarse que tengan una acción antioxidante directa. La administración de glucocorticoides ha demostrado presentar una alta capacidad para inhibir la producción de ERO por parte de los macrófagos y neutrófilos (Crystal y Ramón, 1992; Pereira y col., 1998; Schweizer y Peterhans, 1999).
A partir de todo lo señalado, se entiende que para mantener el equilibrio fisiológico del organismo los sistemas de oxidación y los de protección antioxidante deben actuar de forma controlada sobre los substratos susceptibles a una oxidación (Halliwell, 1997). Pero estos sistemas de protección antioxidante resultan, en ocasiones, insuficientes para neutralizar las ERO generadas, desarrollándose un estado de desequilibrio que se conoce como estrés oxidativo (Sies, 1997; Campbell y Miller, 1998; Kow, 1999; Matés y col., 1999), causante de lo que llamamos daño oxidativo (López Alonso y col., 1997)
1.4. ACCIÓN DE LOS OXIDANTES EN LOS ORGANISMOS VIVOS. Aunque la acción de estos compuestos, y de los radicales libres en concreto, es repetitiva y consiste en la disrupción de las cadenas largas originales, con formación de nuevos radicales libres hijos, cada principio inmediato presenta una serie de peculiaridades (Ramón, 1993; López Alonso y col., 1997; Matés y col., 2000).
1.4.1. Acción sobre los lípidos. Es el proceso oxidativo más frecuente en el organismo (Halliwell, 1997). Se produce cuando un radical libre se fija a un carbono de la cadena alquilo (CH3-(CH2)n-) de un ácido graso, iniciando lo que se conoce como peroxidación lipídica. La importancia de este hecho estriba en que las cadenas de ácidos grasos, particularmente los poliinsaturados (PUFA) se fragmentan justamente por el carbono que se ha transformado en radical libre, con lo que las estructuras fosfolipídicas de las membranas se desorganizan y destruyen (Duthie y col., 1989; López Alonso, 1997; Duthie, 1999), tal y como se aprecia en la figura 4.
| Figura 4. Representación
esquemática del daño producido por los radicales libres
en los fosfolípidos de las membranas celulares. Los trazos negros
representan enlaces saturados; los blancos insaturados; los círculos,
las bases. Los radicales libres se fijan en diversos puntos de las cadenas
y las "puentean", las desorganizan y las rompen (Tomado de López
Alonso y col., 1997). |
Esto afecta fundamentalmente a las membranas citosólicas e intracitosólicas (mitocondrias, núcleo, etc.) con la consiguiente pérdida de su funcionalidad. Pero además, la peroxidación lipídica produce metabolitos, algunos de ellos altamente tóxicos como los aldehídos malondialdehido (MDA) y 4-hidroxinonenal, así como hidrocarburos de cadena intermedia, como pentano, etano, pero nunca metano (Ramón, 1993; López Alonso y col., 1997).
1.4.2. Acción sobre proteínas. Los radicales libres son capaces de peroxidar las cadenas de aminoácidos constitutivas de las proteínas, alterando su conformación espacial y por tanto su función. Las estructuras más afectadas son las proteínas de membrana (canales iónicos, receptores, etc.) y las proteínas estructurales que forman parte de la maquinaria contráctil, particularmente las Na+/K+ATPasas, los intercambiadores Na+/Ca+ (tanto del retículo como mitocondriales y de sarcolema) y las ATPasas ligadas a las proteínas contráctiles y dependientes de Mg++ (Ramón, 1993).
1.4.3. Acción sobre el ADN. Las sustancias reactivas del oxígeno, y en particular el OH•, son capaces de fijarse con extraordinaria avidez a la purina y pirimidina constitutivas de las bases de ADN, alterando su estructura. Las consecuencias van a ser básicamente dos: rotura y desalineación de las bases por hidroxilación, o bien entrecruzamientos entre bandas de ADN, traduciéndose básicamente en bloqueos de la replicación del ADN celular o bien mutaciones (Kow, 1999).
2. PAPEL DEL ESTADO OXIDATIVO EN EL GANADO VACUNO
2.1. Influencia del estado fisiológico: gestación y parto. Es conocido que la gestación supone para la hembra una serie de profundos cambios metabólicos orientados hacia el desarrollo del feto. Sabemos qué cambios hormonales y metabólicos tienen lugar, no hay más que remitirse a la bibliografía existente (Church, 1993; Goff y Horst, 1997). Sin embargo, poco hay acerca del estado oxidativo en tal circunstancia. Tomando como referencia a la especie humana, donde estos estudios han comenzado a realizarse, sabemos que al final de la gestación existe un incremento en la producción de ERO (a consecuencia de la peroxidación lipídica) y de los niveles de enzimas antioxidantes (Gromadzinska y col., 1998). Estos resultados coinciden con los mostrados hasta la fecha por Lomba (1996) y Formigoni y col. (1997) y realizados en vacuno lechero. Además, se acaba de conocer que existen antioxidantes de bajo peso molecular, como uratos, bilirrubina, albúmina y sulfidrilos que aumentan sus niveles en el cordón umbilical, protegiendo al feto frente a los lipoperóxidos producidos en el metabolismo materno (Kiely y col., 1999). Parece pues evidente que mientras el equilibrio entre agentes oxidantes y antioxidantes se mantenga, la gestación llega a término sin mermar la salud de la madre ni de la cría. La causa de este incremento en la producción de radicales libres aún permanece un tanto oscura, pero bien puede ser atribuída a la mayor actividad metabólica desarrollada por la madre, y ya hemos visto como el metabolismo normal es fuente de sustancias oxidantes (Ramón, 1993; Miller y col., 1993; Goff y Horst, 1997; López Alonso y col., 1997). Ese equilibrio puede romperse por alguna de las dos partes: que haya un exceso en la producción de radicales libres, de manera que el sistema antioxidante se veaa desbordado, o bien que haya una disminución en estos últimos, de forma que la producción de radicales libres, fisiológica para esta etapa no puede ser convenientemente contrarrestada. La bibliografía existente nos induce a sospechar acerca de esta última posibilidad, la merma en la defensa antioxidante como causa de la aparición de un estrés oxidativo, durante la gestación y el momento peripartal. Y esta merma parece tener, dos razones básicas: el propio consumo de elementos antioxidantes por efecto de la gestación, como veremos a continuación, o el incorrecto aporte de la dieta, aspecto este último que trataremos posteriormente. La gestación causa un descenso en los niveles de a-tocoferol, lo que afecta a la vitamina E y a la capacidad del animal para defenderse de la lipoperoxidación (Miller y col., 1993; Pereira y col., 1998). Pero no sólo es esta vitamina la afectada, sabemos que también hay una merma en los niveles de vitamina C y A así como de otros elementos (Fe, Cu, Zn) que participan en la defensa antioxidante (Goff y Horst, 1997; Weiss, 1998).
Las consecuencias de la existencia de un estrés oxidativo en este momento son variadas. Podemos encontrarnos con estados cetonémicos y sufrimiento fetal, llegando en casos extremos al aborto (Gromadzinska y col., 1998), ya que el aumento de lipoperóxidos inicia la cascada del ácido araquidónico, causando un desajuste entre la producción de tromboxano y prostaciclina. El primero, junto con los peróxidos procedentes de los ácidos grasos insaturados, y que se han formado en el curso de esta síntesis, causan daño vascular con alteraciones, primero en la circulación placentaria y luego en la materna. Si consideramos el parto, en sí mismo, nos encontramos con que de por sí, existe un alto riesgo de estrés oxidativo, ya que aunque se trate de una situación fisiológica, participan distintos mediadores inflamatorios como prostaglandinas, fenómenos de isquemia-reperfusión y a veces hipoxia y que ponen en marcha la activación de distintos sistemas enzimáticos como la xantino-oxidasa, produciéndose radicales libres (Palomino, 1998). Tras este momento, el animal además ha de verse sometido al importante esfuerzo que supone iniciar la lactación y adaptarse a un nuevo tipo de dieta, rica en energía (Goff y Horst, 1997). Para Correa y col. (1993), el momento peripartal se erige como uno de los más críticos de la vida productiva de la hembra; por ello consideramos necesario asegurarnos de que esta presenta un adecuado sistema antioxidante, que minimice el estado de estrés oxidativo propio de esta fase, ya que de lo contrario es posible la aparición de trastornos que comprometen la salud y productividad del animal (Campbell y Miller, 1998). Efectivamente, varios investigadores han relacionado hasta el momento esta circunstancia con la aparición de mastitis, hipocalcemias o retenciones placentarias, por citar algunos de los casos más señalados (Miller y col., 1993; Brzezinska-Slebodzinska y col., 1994; Weiss y col., 1997; Campbell y Miller, 1998), aunque no cabe duda de que investigaciones posteriores señalarán más patologías, especialmente metabólicas, ya que, en situaciones de aumento en los niveles de radicales libres, hay una menor disponibilidad de NADPH, necesaria para el metabolismo, especialmente de la glucosa (Miller y col., 1993). Enlazando con este último aspecto, en la actualidad la implicación del estrés oxidativo en la regulación del metabolismo glucídico presenta muchos puntos oscuros (Ceriello, 2000), aunque sí parece evidente su repercusión negativa (Sozmen y col., 1999; Ceriello, 2000; Kashiba y col., 2000; Khamaisi y col., 2000). En los casos de diabetes, en los que existe una mayor resistencia de los tejidos a la acción de la insulina e hiperglucemia, se ha detectado un aumento en la producción de radicales libres intracelulares que, curiosamente, potencian una mayor resistencia a la acción de la insulina, estableciéndose un círculo vicioso (Ceriello, 2000; Khamaisi y col., 2000). Esta situación produce una alteración en el sistema defensivo antioxidante, afectando concretamente a la catalasa (Sozmen y col., 1999), al sistema de la glutatión (Khamaisi y col., 2000) o al ácido ascórbico (Kashiba y col., 2000). En estos casos, se ha comprobado que la administración terapéutica de vitamina E y C ayuda a mejorar la acción de la insulina (Ceriello, 2000). Por otro lado, la hipoglucemia también genera una mayor cantidad de radicales libres intracelulares, afectando, en este caso, a la síntesis proteica de las neuronas, tal y como describen Monje y col. (2000), y en el que se señala que la administración de vitaminas E y C, y N-acetilcisteína ayuda a prevenir o paliar los daños derivados. Todos estos estudios, si bien tienen como modelo de experimentación a los animales, están enfocados hacia la especie humana. A partir de aquí creemos que sería sumamente interesante abordar, en rumiantes, la participación del estrés oxidativo en la cetosis bovina, un disturbio metabólico caracterizado por hipoglucemia y presencia de cuerpos cetónicos en sangre, leche y orina (Radostits y col., 2000). Creemos que es importante, y necesario, evaluar qué grado de estrés oxidativo se produce en cada cuadro clínico de este proceso, qué elementos antioxidantes se ven afectados y en qué medida; todo ello con el fin de adecuar la terapia destinada no sólo al restablecimiento de los niveles de glucosa (Radostits y col., 2000) sino también al de elementos antioxidantes, con el propósito de minimizar las lesiones producidas, especialmente en hígado, desarrollando lo que conocemos como hígado graso (Smith y col., 1997). Precisamente, Grattagliano y col. (2000) han encontrado en ratas que aquellas que presentan esteatosis hepática muestran índices elevados de estrés oxidativo, con descenso en los niveles de vitamina C y E, conduciendo a una peroxidación lipídica. Además, si los animales presentan inanición (y recordemos que hay un descenso de la ingesta en las hembras bovinas tras el parto _Radostits y col., 2000), el daño se extiende a las proteínas celulares. La aparición de las mastitis en estos momentos ha estado relacionada con una disfunción de la actividad neutrofílica. Los postulados que se han propuesto son variados: para algunos investigadores está relacionado con la merma de los sistemas antioxidantes, como la vitamina E, y que hace a los neutrófilos más susceptibles a la acción de los peróxidos citosólicos, además de mermarse la producción de SOD, GSH-Px y catalasa (Hogan y col., 1990; Efe y col., 1999), mientras que recientes investigaciones la atribuyen a una disminución de la actividad neutrofílica, y en concreto, del estallido respiratorio, por influjo hormonal y metabólico, propio de este estado (Hoeben y col., 2000). Hoy por hoy, los estudios publicados apuntan hacia la primera explicación, ya que la suplementación vitamínico-mineral ha demostrado prevenir a la hembra frente a esta patología, al mejorar la actividad defensiva de los neutrófilos (Hogan y col., 1990; Weiss y col., 1997; Campbell y Miller, 1998). Hidiroglou y col. (1997) señalan que la suplementación con vitamina E no sólo beneficia a la función de los neutrófilos, que han de generar ERO (O2- y H2O2) en su función antimicrobiana, sino también a los tejidos circundantes que podrían afectarse por la acción de los radicales libres producidos. La homeostasis cálcica se ve seriamente comprometida en el momento peripartal (Goff y Horst, 1997; Horst y col., 1997). Si la hembra, además, presenta un estado de estrés oxidativo las consecuencias pueden ser graves y se ha relacionado con la aparición de la paresia puerperal. El aumento en los niveles de radicales libres puede inhibir la formación de 1,25 dihidroxicolecalciferol al inactivarse el citocromo P-450 (Miller y col., 1993), enzima encargada de la hidroxilación de la vitamina D en las posiciones 1 y 25. Los estudios realizados en lo que respecta a este desequilibrio metabólico (Horst y col., 1997; Weiss, 1998) abordan la importancia de mantener los niveles de calcio, fósforo y vitamina D mediante diversas estrategias nutricionales como son la manipulación dietética del equilibrio ácido-base, la restricción dietética de cationes, las raciones en las que exista una diferencia catión-anión, etc. Creemos interesante complementar todas estas pautas con la administración de vitamina E, y que actuaría como refuerzo antioxidante a las terapias preventivas planteadas. Weiss (1998) apunta la posibilidad de una suplementación con 1000 UI de vitamina E /día a las vacas en fase de secado y de 500UI/día a las que estén en fase de lactación
Finalmente, se ha relacionado al estrés oxidativo, provocado por la disminución en las concentraciones de vitamina E antes del parto, con la aparición de retención placentaria (Weiss, 1998), por acción de los lipoperóxidos (Brzezinska-Slebodzinska y col., 1994) o retrasos en la aparición del primer celo (Miller y col., 1993). Márquez y López-Ortega (1997) señalan que las hembras bovinas que presentan una mayor generación de ERO en células luteales mostrarán peroxidación lipídica, afectando a sus membranas, con importantes consecuencias, tales como la pérdida de los receptores para las gonadotrofinas, la disminución en la formación de adenosín-monofosfato cíclico o de la capacidad esteroidogénica del cuerpo lúteo durante la involución. Por último, el estrés oxidativo afecta negativamente al desarrollo embrionario, sobre todo en los primeros momentos de la división celular, por acción de los aniones superóxido (Luvoni y col., 1995). Hasta el momento hemos abordado la situación de la hembra, sin embargo el feto, o la cría, también puede verse afectado. Algunas de sus consecuencias ya han sido consideradas al tratar la gestación, a continuación nos centraremos en abordar la influencia que puede ejercer el parto. En este instante, el ternero, per se, por el propio nacimiento, se enfrentará a un estado de estrés, por el paso del neonato desde un ambiente intrauterino hipóxico a otro relativamente hiperóxico, con aumento en la oferta de oxígeno que llegan a sus pulmones y al torrente circulatorio (Palomino, 1998; Muñiz y col., 2000). Además, la inmadurez del propio sistema antioxidante, atribuible a los bajos niveles de b-caroteno, retinol y a-tocoferol (Nonnecke y col., 1999), provoca que éste sea insuficiente para eliminar los radicales superóxido producidos, haciendo a los animales muy vulnerables a las consecuencias derivadas de un estrés oxidativo (Inanami y col., 1999). Creemos necesario que se siga investigando en este terreno, constatando además la influencia que la madre tiene sobre la conformación del sistema antioxidante durante la vida intrauterina del animal y, una vez nacido, ver cómo los factores medioambientales influyen en el deterioro o refuerzo del mismo. A esta situación hay que añadir que el animal presenta en ese momento un sistema inmune inmaduro que produce elevadas cantidades de NO, sin que sea convenientemente contrarrestado (Rajaraman y col., 1998). Este compuesto, en cantidades fisiológicas actúa como marcador celular y neurotransmisor, sin embargo, su presencia en elevadas cantidades y durante bastante tiempo permite su unión a los aniones superóxido formados en el parto, causando daños en la membrana celular, inflamación y apoptosis.
2.2. IINFLUENCIA DE LA DIETA. Parece evidente que si la madre recibe los adecuados aportes de antioxidantes o de sus precursores, muchas patologías pueden ser evitadas, o al menos contrarrestadas. Esto nos introduce en el papel de la nutrición de los bovinos y su relación con el estrés oxidativo. Ya en el año 1979, Chow señalaba que la reducción de hidroperóxidos por acción de la catalasa y glutatión peroxidasa estaba estrechamente relacionada con la cantidad de proteínas, lípidos, carbohidratos, vitaminas y minerales ingeridos. Desde entonces diversos estudios han establecido que el estado nutricional condiciona la capacidad defensiva antioxidante y por tanto la susceptibilidad ante un estado de estrés oxidativo (Duthie y col., 1989; Lomba, 1996; Duthie, 1999) La mayoría de los estudios han estado dirigidos hacia el aporte vitamínico-mineral, pero no desde una perspectiva general sino concreta: se aborda el papel de un determinado mineral o vitamina, siendo muy difundidos los trabajos acerca de la vitamina E y el selenio. La profusión de estudios de este tipo hace que en el momento de realizar una revisión de este tema la información sea desbordante. Y es que, como señala Miller y col. (1993), los sistemas antioxidantes trabajan en conjunto, de manera que el déficit de un elemento afecta a todo el sistema antioxidante. Por ello, la suplementación con una vitamina o mineral en concreto no siempre garantiza el éxito, ya que puede estarse obviando la deficiencia de otros. Además, las modificaciones fisiológicas que tienen lugar a lo largo de la vida, así como las influencias medioambientales, son factores que contribuyen a desajustar el equilibrio de micronutrientes, y estos factores han de ser tenidos en cuenta en el momento de definir los requerimientos específicos para cada etapa (Richard y Roussel, 1999). Creemos que así se pueden establecer programas concretos de suplementación vitamínico-mineral, destinados a reducir el riesgo de enfermedades asociadas a la producción. La influencia de la dieta, como factor ambiental, en el estado oxidativo de los rumiantes, y a tenor de lo publicado en el terreno de la veterinaria, puede cifrarse en dos niveles fundamentales: que aporte inadecuados niveles de antioxidantes o bien que la composición de la misma genere más ERO de los que el propio sistema antioxidante pueda neutralizar. Iremos viendo cada apartado. En lo que compete a los niveles de antioxidantes, son muy conocidos los efectos beneficiosos de la suplementación con selenio, zinc o vitamina E y A, sobre el estado oxidativo y por tanto, la salud del animal. Estos componentes han protagonizado la mayor parte de las investigaciones realizadas en el terreno de las sustancias antioxidantes, orientadas a mantener el nivel productivo de la hembra tras el parto o la maduración del sistema inmune del ternero tras el nacimiento (Nonnecke y col., 1999). Pero creemos que los estudios en este campo aún pueden ofrecernos datos muy interesantes, no ya para el post-parto sino para la misma gestación, previniendo las alteraciones metabólicas que con frecuencia se derivan de un desajuste entre la ingesta y la exigencia productiva, tal y como ya hemos mencionado al referirnos a la cetosis o la hipocalcemia. Menos información existe, desde la perspectiva del estrés oxidativo en estos animales, acerca de otros componentes nutricionales, como la grasa y la proteína. Las dietas ricas en grasa están muy correlacionadas con la producción de ERO, llegando a dañar gravemente el ADN de la célula mamaria, reflejándose en la existencia de tumores (Djuric y col., 1992). Pero hay más, el alto contenido lipídico, y especialmente en n-3PUFA, puede afectar a los hepatocitos y otras células tisulares, a través de la lipoperoxidación, afectando a la funcionalidad del hígado (Ibrahim y col., 1997; Krizanovic y col., 1997) y mermando, en general, la defensa antioxidante (Husveth y col., 2000) por alteración en la conformación de las proteínas celulares, al reaccionar los residuos de lisina con los aldehídos saturados derivados de los PUFA (Refsgaard y col., 2000). La suplementación paralela con vitamina E o selenio ha demostrado disminuir el grado de daño oxidativo (Meltzer y col., 1997; Oriani y col., 1999). Precisamente, la importancia del manejo nutricional en relación con el estrés oxidativo quedó patente en un estudio realizado por nosotros en ganado ovino (Castillo y col., 1999; Castillo y col., 2001). En el mismo, pudimos constatar que la administración de dietas ricas en energía al final de la preñez, unida a una suplementación vitamínico-mineral que no se modificaba en función del estado fisiológico, producía un descenso acusado en los niveles de la enzima glutatión peroxidasa. No hablábamos entonces del término estrés oxidativo, sino que señalábamos los riesgos potenciales derivados de la administración de una dieta rica en grasa sobre la salud de la hembra. A partir de este punto creemos que es interesante abordar qué papel juegan determinados alimentos sobre la posibilidad de causar o no estrés oxidativo en los animales. Las dietas pobres en proteínas dañan la mucosa intestinal por generación de radicales libres, interfiriendo en el transporte epitelial de nutrientes y complicando el estado de estrés oxidativo generado por la misma malnutrición proteica (Darmon y col., 1993). A veces, es frecuente la administración de cantidades excesivas de hierro, siendo peligroso por su efecto pro-oxidante. Porres y col. (1999) han mostrado que tal situación puede mermar los niveles de catalasa en la mucosa del colon causando peroxidación de sus células, a pesar del aumento en ellas de los niveles de GSH-Px. Campbell y Miller (1998) han relacionado esta ingesta con la aparición de retención placentaria. Es evidente que a medida que avanzan los conocimientos vamos teniendo más referencias acerca de los mecanismos patogénicos que intervienen en diferentes enfermedades. El descubrimiento de los mecanismos involucrados en el desarrollo de un estrés oxidativo nos ha abierto más fuentes de comprensión referentes al desarrollo de numerosas patologías. Nosotros nos hemos centrado en las que afectan al ganado vacuno en un momento determinado de su vida productiva, y aunque la mayoría de los trabajos comentados en esta revisión tienen como modelos a los animales de experimentación, qué duda cabe que pueden constituir el punto de arranque para nuevas y fascinantes investigaciones, aplicables a los animales domésticos.
3. CONCLUSIONES
Es necesario establecer qué papel juega el estrés oxidativo en la fisiopatología de las enfermedades que afectan al ganado vacuno, tanto desde su nacimiento como durante la gestación e inicio de la lactación, abordando también las consecuencias que ese estado de estrés no contrarrestado puede tener sobre la salud del individuo. Sólo así podremos avanzar en el conocimiento del proceso, pudiendo desarrollar modalidades terapéuticas y preventivas más eficaces. Para llegar a este punto creemos que es imprescindible ponderar esta situación en los animales, buscando marcadores eficaces. Una vez obtenidos valores fisiológicos, y tras analizar sus factores de variación de manera objetiva (raza, edad, sexo, estado fisiológico, etc.) podremos tener la base necesaria a partir de la cual señalar cuando un animal entra en estrés oxidativo. El estudio del estrés oxidativo ha de hacerse valorando también las defensas antioxidantes, viendo qué vitamina o enzima se altera en cada proceso en donde describamos estrés oxidativo.
4. RESUMEN
El oxígeno implicado en la oxidación de substratos, para producir energía durante el metabolismo fisiológico genera sustancias tóxicas conocidas como especies reactivas de oxígeno (ERO). Bajos niveles de ERO son esenciales en gran cantidad de procesos celulares; la acumulación de éstos puede, sin embargo, causar graves daños en las macromoléculas biológicas. Por otro lado, el organismo se protege mediante una amplia variedad de mecanismos antioxidantes. El estudio de los daños inducidos por ERO y cómo el organismo se protege frente a ellos está adquiriendo una gran importancia en la práctica de la medicina humana, y veterinaria.
El objetivo de este trabajo de revisión es: i) aclarar diversos aspectos del estado oxidativo, ii) analizar la influencia del estrés oxidativo sobre la salud del ganado vacuno teniendo en cuenta su estado fisiológico (gestación y parto) y el manejo nutricional y, iii) organizar la amplia literatura existente al respecto, y que puede ser de interés veterinario, de una forma rápidamente accesible.
5. BIBLIOGRAFÍA
BASU, T. K., C. N. TEMPLE, M. M. GARG. 1999. Antioxidants in Human Health and Diseases. CABI Publishing, Oxford. UK.
BRZEZINSKA-SLEBODZINSKA, E., J. K. MILLER, J. D. QUIGLEY, J. R. MOORE, F. C. MADSEN. 1994. Antioxidant status of dairy cows supplemented prepartum with vitamin E and selenium. J. Dairy Sci. 77: 3087-3095.
CAMPBELL, M. H., J. K. MILLER. 1998. Effect of supplemental dietary vitamin E and zinc on reproductive performance of dairy cows and heifers fed excess iron. J. Dairy Sci. 81:2693-2699.
CASTILLO C., J. HERNANDEZ, M. LOPEZ ALONSO, M. MIRANDA, J. L. BENEDITO. 1999. Effect of physiological stage and nutritional management on some serum metabolite concentrations on Assaf ovine breed. Arch. Tierz. 42:377-386.
CASTILLO, C., J. HERNANDEZ, M. LOPEZ ALONSO, M. MIRANDA, J. L. BENEDITO. 2001. A different point of view of glutathione preoxidase: its relationship to the metabolic changes associated with nutritional management in the Assaf ovine breed. Arch. Tierz. 43 (en prensa).
CEBALLOS, A., F. WITTWER. 1996. Metabolismo del selenio en rumiantes. Arch. Med. Vet. 28: 5-18.
CEBALLOS, A., F. WITTWER, P. A. CONTRERAS, A. 1998. Actividad sanguínea de glutatión peroxidasa en rebaños lecheros a pastoreo: variación según edad y época del año. Arch. Med. Vet. 30: 13-22.
CERIELLO, A. 2000. Oxidative stress and glycemic regulation. Metab. Clin.Exp. 49: 27-29.
CESPEDES, E., I. HERNANDEZ, N. LLOPIZ. 1996. Enzimas que participan como barreras fisiológicas para eliminar los radicales libres: catalasa. Rev. Cubana Invest. Biomed. 15: 23-28.
CHOW, C.K. 1979. Nutritional influence on cellular antioxidant defence systems. Am. J. Clin. Nutr. 32: 1066-1081.
CHURCH, D. E. 1993. El rumiante, fisiología digestiva y nutrición. Acribia, Zaragoza. España.
CORREA, M. T., H. ERB, J. SCARLETT. 1993. Path análisis of seven postpartum disorders of Holstein cows. J. Dairy Sci. 76:1305-1312.
CRYSTAL, R. G., J. R. RAMON. 1992. GSHSystem. Glutatión: eje de la defensa antioxidante. Excerpta Médica, Amsterdam. Holanda.
DARMON, N., M. A. PELISSIER, M. HEYMAN, R. ALBRECHT, J. F. DESJEUX. 1993. Oxidative stress may contribute to the intestinal dysfunction of weanling fed a low protein diet. J. Nutr. 123:1068-1075.
DJURIC, Z., M. H. LU, S. M. LEWIS, D. A. LUONGO, X. W. CHEN, L. K. HEILBRUN, B. A. READING, P. H. DUFFY, R. W. HART. 1992. Oxidative DNA damage levels in rats fed low-fat, high-fat or calorie-restricted diets. Toxicology and Appl. Pharmacol. 115:156-160.
DUTHIE, G. G. 1999. Determination of activity of antioxidants in human subjects. Proc. Nutr. Soc. 58: 1015-1024.
DUTHIE, G. G., K. W. J. WAHLE, W. P. T. JAMES. 1989. Oxidants, antioxidants and cardiovascular disease. Nutr. Res. Rev. 2: 51-62.
EFE, H., O. DEGER, D. KIRCI, S. C. KARAHAN, A. OREM, M. CALAPOGLLI. 1999. Decreased neutrophil antioxidant enzyme activities and increased lipid peroxidation in hyperlipoproteinemic human subjects. Clin. Chim. Acta 279:155-165.
FORMIGONI, A., P. PEZZI, A. PANCIROLI, D. CALDERONE. 1997. Oxidative status evolution in dairy cows. Preliminary observations. Atti della Associazione Scientifica di Produzione Animale. 12:203-204.
GOFF, J. P., R. L. HORST. 1997. Physiological changes at parturition and their relationship to metabolic disorders. J. Dairy Sci. 80: 1260-1268.
GRATTAGLIANO, I., G. VENDEMIALE, P. CARACENI, M. DOMENICALI, B. NARDO, A. CAVALLARI, F. TREVISANI, M. BERNARDI, E. ALTOMARE. 2000. Starvation impairs antioxidant defense in fatty libres of rats fed a choline-deficient diet. J. Nutr. 130: 2131-2136.
GROMADZINSKA, J., W. WASOWICZ, G. KRASOMSKI, D. BRONIARCZYK, M. ANDRIJEWSKI, K. RYDZYNSKI, P. WOLKANIN.1998. Selenium levels, thiobarbituric acid-reactive substance concentrations and glutathione peroxidase activity in the blood of women with gestosis and inminent premature labour. Analyst. 123:35-40.
HALLIWELL, B. 1997. Antioxidants and human disease: a general introduction. Nutr. Rev. 55: S44-S52.
HIDIROGLOU, M., T. R. BATRA, X. ZHAO. 1997. Bioavailability of vitamin E compounds and the effect of supplementation on release of superoxide and hydrogen peroxide by bovine neutrophils. J. Dairy Sci. 80:187-193.
HOEBEN, D., E. MONFARDINI, G. OPSOMER, C. BURVENICH, H. DOSOGNE, A. DE KRUIF, J.F. BECKERS. 2000. Chemiluminescence of bovine polymorphonuclear leucocytes during the periparturient period and relation with metabolic markers and bovine pregnancy-associated glycoprotein. J. Dairy Res. 67:249-259.
HOGAN, J. S., K. L. SMITH, W. P. WEISS, D. A. TODHUNTER, W. L. SCHOCKEY. 1990. Relationships among vitamin E, selenium and bovine blood neutrophils. J. Dairy Sci. 73: 2372-2378.
HORST, R. L., J. P. GOFF, T. A. REINHARDT, D. R. BUXTON. 1997. Stategies for preventing milk fever in dairy cattle. J. Dairy Sci. 80:1269-1280.
HUSVETH, F., H. A. MANILLA, T. GAAL, P. VAJDOVICH, N. BALOGH, L. WAGNER, I. LOTH, K. NEMETH. 2000. Effects of saturated and unsaturated fats with vitamin E supplementation on the antioxidant status of broiler chicken tissues. Acta Vet. Hung. 48:69-79.
IBRAHIM, W., Y. S. LEE, C. C. YEH, J. SZABO, G. BRUCKNER, C. K. CHOW. 1997. Oxidative stress and antioxidant status in mouse liver: effects of dietary lipid, vitamin E and iron. J. Nutr. 127:1401-1406.
INANAMI, O., A. SIGA, K. OKADA, R. SATO, Y. MIYAKE, M. KUWABARA. 1999. Lipid peroxides and antioxidants in serum of neonatal calves. Am. J. Vet. Res. 60: 452-457.
KASHIBA, M., J. OKA, R. ICHIKAWA, A. KAGEYAMA, T. INAYAMA, H. KAGEYAMA, T. ISHIKAWA, M. NISHIKIMI, M. INOUE, S. INOUE. 2000. Impaired reductive regeneration of ascorbic acid in the Goto-Kakizaki diabetic rat. Biochem. J. 351: 313-318.
KEHRER, J. P. 2000. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology, 149: 43-50.
KHAMAISI, M., O. KAVEL, M. ROSENSTOCK, M. PORAT, M. YULI, N. KAISER, A. RUDICH. 2000. Effect of inhibition of glutathione synthesis on insulin action: in vivo and in vitro studies using buthionine sulfoximine. Biochem. J. 349: 579-586.
KIELY, M., P. A. MORRISEY, P. F. COGAN, P. J. KEARNEY. 1999. Low molecular weight plasma antioxidants and lipid peroxidation in maternal and cord blood. European J. Clin. Nutr. 53: 861-864.
KOW, Y.W. 1999. Oxidative stress, DNA damage and human diseases. Dojindo Newsletter, 2: 4-13.
KRIZANOVIC, D., P. BOZIC, B. G. VRBANAR, I. KARADJOLE, V. P. PETRUSA. 1997. Glutathione and related enzimes activities in the blood of Simmental Bulls. Res. Vet. Sci. 63: 191-192.
LEE, H. C., P. H. YIN, C. Y. LU, C. W. CHI, Y. H. WEI. 2000. Increase of mitochondria and mitochondrial DNA in response to oxidative stress in human cells. Biochem. J. 348: 425-432.
LEUNG, F. Y. 1998. Trace elements that acts as antioxidants in parenteral micronutrition. J. Nutr. and Biochem. 9: 304-307.
LOMBA, F. 1996. Influence of dietary cation-anion and oxidants-antioxidants balances during the dry period on the occurrence of the fat cow syndrome in the dairy cow. Annales de Med. Vet. 140: 109-122.
LOPEZ ALONSO, M., M. MIRANDA, J. HERNANDEZ, C. CASTILLO, J. L. BENEDITO. 1997. Glutatión peroxidasa (GSH-Px) en las patologías asociadas a deficiencias de selenio en rumiantes. Arch. Med. Vet. 29: 171-180.
LUVONI, G. C., E. PARRAVICINI, F. GANDOLFI, A. LAURIA. 1995. Oxidative stress and "in vitro" bovine embryogenesis. Preliminary findings on the use of superoxidedismutase (SOD). Atti della Soc. It. Sci. Vet. 47: 195-199.
MARQUEZ, I. C., A. A. LOPEZ-ORTEGA. 1997. Generación de radicales libres en el cuerpo lúteo de bovinos lecheros. Gaceta Veterinaria. 3: 23-29.
MATES, J. M., J. M. SEGURA, C. PEREZ-GOMEZ, R. ROSADO, L. OLALLA, M. BLANCA, F. M. SÁNCHEZ-JIMENEZ. 1999. Antioxidant enzymatic activities in human blood cells after an allergic reaction to pollen or house dust mite. Blood Cells, Molecules and Diseases. 25: 103-109.
MATES, J. M., C. PEREZ, L. OLALLA, J. SEGURA, M. BLANCA 2000. Allergy to drugs: antioxidant enzymatic activities, lipid peroxidation and protein oxidative damage in human blood. Cell Biochem. Funct. 18: 77-84.
MELTZER, H. M., M. FOLMER, W. SIRI, O. LIE, A. MAAGE, H. MUNDAL, T. A. YDERSBOND. 1997. Supplementary selenium influences the response to fatty acid-induced oxidative stress in humans. Biol. Trace Elem. Res. 60: 51-68.
MILLER, J. K., E. BRZEZINSKA-SLEBODZINSKA, F. C. MADSEN. 1993. Oxidative stress, antioxidants and animal function. J. Dairy Sci.76: 2812-2823.
MONDOLA, P., M. BIFULCO, R. SERU, T. ANNELLA, M.R. CIRIOLO, M. SANTILLO. 2000. Presence of CuZn superoxide dismutase in human serum lipoproteins. FEBS Letters. 467: 57-60.
MONJE, M., J. CHATTEN-BROWN, R. HYE-SCOTT, K. RALEY-SUSMAN. 2000. Free radicals are involved in the damage to protein synthesis after anoxia/aglycemia and NMDA exposure. Brain Res. 857: 172-182.
MUÑIZ, P., M. J. GARCIA BARCHINO, A. IRADI, E. MAHIQUES, V. MARCO, M. R. OLIVA, G. T. SAEZ. 2000. Age-related changes of liver antioxidant encimes and 8-hydroxy-2'deoxyguanosine during fetal-neonate transition and early rat development. Life 49: 497-500.
NONNECKE, B. J., R. L. HORST, W. R. WATERS, P. BUBESKI, J. A. HARP. 1999. Modulation of fat-soluble vitamin concentrations and blood mononuclear leucocyte population in milk replacer-fed calves by dietary vitamin A and b-caroten. J. Dairy Sci. 82: 2632-2641.
ORIANI, G., G. SALVATORI, G. MAIORANO, A. MANCHISI, A. BRIENZA, L. PANTALEO, R. CATERINA, T. ROTUNNO. 1999. Effects of intramuscular injection of alpha-tocopheryl acetate on fatty acid profile in lamb liver. Int. J. Vit. and Nutr. Res. 69: 378-384.
PALOMINO, N. 1998. Estudio comparativo del estrés oxidativo en recién nacidos. Tesis Doctoral, Universidad de Granada, Facultad de Medicina, Granada, España.
PEREIRA, B., L. F. B. P. COSTA-ROSA, E. J. H. BECHARA, P. NEWSHOLME, R. CURI. 1998. Changes In the TBARs content and superoxide dismutase, catalase and glutathione perooxidase activities in the lymphoid organs and skeletal muscles of adreno-demedullated rats. Braz. J. Med. Biol. Res. 31: 827-833.
PORRES, J. M., C. H. STAHL, W. H. CHENG, Y. FU, K. R. RONEKER, W. POND, X. G. LEI. 1999. Dietary intrinsic phytate protects colon from lipid peroxidation in pigs with a moderately high dietary iron intake. Proc. Soc. Exp. Biol. and Med. 221: 40-42.
RADOSTITS, O. M., C. C. GAY, D. C. BLOOD, K. W. HINCHCLIFF. 2000. Veterinary Medicine. 9th edition, Saunders, Philadelphia, USA.
RAJARAMAN, V., B. J. NONNECKE, S. T. FRANKLIN, D. C. HAMMELL, R. L. HORST. 1998. Effect of vitamins A and E on nitric oxide production by blood mononuclear leukocytes from neonatal calves fed milk replacer. J. Dairy Sci. 81: 3278-3285.
RAMON, J. R. 1993. Radicales libres y antioxi-dantes en clínica humana. Ed. IDEPSA (Internacional de Ediciones y Publicaciones, S.A.), Madrid, España.
REFSGAARD, H. H. F., L. TSAI, E. R. STADTMAN. 2000. Modifications of proteins by polyunsatured fatty acid peroxidation products. Proc. National Academy Sci. USA 97: 611-616.
RICHARD, M. J.; A. M. ROUSSEL. 1999. Micronutrients and ageing: intakes and requirements. Proc. Nutr. Soc. 58: 573-578.
SCHWEIZER, M., E. PETERHANS. 1999. Oxidative stress in cells infected with bovine viral diarrhoea virus: a crucial step in the induction of apoptosis. J. Gen. Virol. 80: 1147-1155.
SIES, H. 1997. Oxidative stress: oxidants and antioxidants. Exp. Physiol. 82: 291-295.
SMITH, T. R., A. R. HIPPEN, D. C. BEITZ, J. W. YOUNG. 1997. Metabolic characteristics in induced ketosis in normal and obese dairy cows. J. Dairy. Sci. 80: 1569-1581.
SOZMEN, B., Y. DELEN, F. K. GIRGIN, E. Y. SOZMEN. 1999. Catalase and paraoxonase in hypertensive type 2 diabetes mellitus: correlation with glycemic control. Clin. Biochem. 32: 423-427.
TANG, M., W. ABPLANALP, S. AYRES, M. T. R. SUBBIAH. 1996. Superior and distinct antioxidant effects of selected estrogen metabolites on lipid peroxidation. Metabolism Clin. and Exp. 45: 411-414.
TIIDUS, P. M., E. BOMBARDIER, N. HIDIROGLOU, R. MADERE. 1999. Gender and exercise influence on tissue antioxidant vitamin status in rats. J. Nutr. Sci. Vitaminol. 45: 701-10.
WEISS, W. P. 1998. Requirements of fat-soluble vitamins for dairy cows: a review. J. Dairy Sci. 81: 2493-2501.
WEISS, W. P., J. S. HOGAN, D. A. TODHUNTER, K. L. SMITH. 1997. Effect of vitamin E supplementation in diets with a low concentration of selenium on mammary gland health of dairy cows. J. Dairy Sci. 80: 1728-1737.
Aceptado: 06.03.01