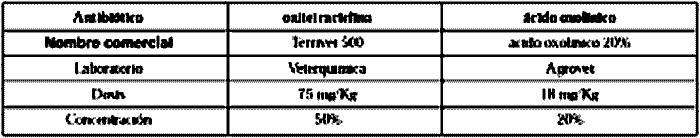
0000000000 Concentration, dosis, origin and comertial name of the antibiotics oxitetraciclyne and oxolinic acid.
ARTÍCULOS ORIGINALES
Efecto del pH, cepa bacteriana y tipo de muestra, en la detección microbiológica, de ácido oxolínico y oxitetraciclina en peces
Influence of pH, microbial strain and sample type, on the microbiological detection of oxolinic acid and oxitetraciclyne in fish
ERIKA GESCHE,1 M.V., Dr. Agr.; ENRIQUE MADRID,2 M.V.; CRISTIAN AGUILA, M.V.
Simultaneously with the development
of the salmoniculture, comes forth the need to use antimicrobial drugs to control
fish disease thus, increasing the risk of residues in the edible product.
Detection of residues of oxolinic acid
and oxitetracycline in fish, carried out using 75 units of Salmo salar.
With an average weight of 2.7 Kg. Fish
were treated during 10 days with the dosis recommended by the manufacturer,
for both antibiotics.
Once the treatment was finished, blood
serum samples and muscle samples after killing the fish, were taken on days
1 to 5, 10, 15, 20 and 30 of the posttreatment period. Samples were kept frozen
and submitted later to bacterial inhibition method, using B. subtilis
BGA and E. coli ATCC 11303 as sensitive strains included in a nutritive
culture media at pH 6,0 and 8,0.
Both samples, muscle and serum of fishes,
were placed in duplicate on each Petri dish with the different substrates. Residues
of antibiotic were detected after an incubation period of 24 h at 35 ºC
when an inhibitory zone of the test microorganism appeared. The inhibition zone
was measured in milimeters and recorded.
Results show that the oxolinic acid and
oxitetraciclyne were detected better at pH 6.0, also B. subtilis BGA
is more sensitive than E. coli ATCC 11303 to both drugs. Blood serum
samples produce bigger inhibitory zones for both antibiotics than the muscle
sample. Moreover better residue retention time for drugs was in blood serum.
Palabras claves: Residuos de antibióticos, peces, detección microbiológica.
Key words: Antibiotic residues, fish, microbiological detection.
INTRODUCCIÓN
Junto con el desarrollo de la salmonicultura en Chile, se inició el uso de antibióticos y quimioterápicos en el tratamiento de enfermedades que aparecen como consecuencia de una producción intensiva (Achurra, 1992; Bravo, 1993). Entre los antibacterianos más frecuentemente empleados, destacan el ácido oxolínico y la oxitetraciclina, fármacos de características disímiles en cuanto a su estructura y origen, perteneciendo el ácido oxolínico a una quinolona de primera generación y la oxitetraciclina a la familia de las tetraciclinas (Jacobsen, 1989; Doelz, 1992). El empleo de antibacterianos en la acuicultura, conlleva la posibilidad de retención de residuos de estos fármacos en el producto final y por ende al riesgo de provocar transferencia no deseada al consumidor (Booth y Mc Donald, 1988). Es por ello que también en nuestro país, impulsados por la garantía de calidad del producto de exportación, se ha puesto énfasis en la determinación de residuos de antibacterianos en productos pesqueros (Chile, 1997). Para la detección de residuos de inhibidores en alimentos se han desarrollado variadas técnicas físicas, químicas e inmunológicas que hacen uso de materiales y equipos especializados, permitiendo, además de la identificación, la cuantificación del antibacteriano extraído del alimento (Silva y Anhalt, 1980; Moats, 1983; Bishop y White, 1984). Sin embargo, para un análisis inicial de tipo meramente cualitativo, es corriente el uso de métodos microbiológicos basados en la inhibición de cepas tipo de bacterias especialmente sensibles a antibacterianos (Nouws y col., 1979). Son muchas las bacterias sensibles usadas en la detección de residuos de antibacterianos. Es así como para la determinación de residuos en leche, se preconiza el uso de Bacillus stearother-mophilus var. calidolactis (FIL/IDF, 1991), mientras para la detección en carne se emplean cepas tales como Bacillus subtilis BGA y Micrococcus luteus ATCC 9341 (Nouws y col., 1979; Heitzmann, 1994). En el caso de la detección de inhibidores bacterianos en peces, en Chile se ha indicado el uso de Bacillus subtilis ATCC 6633 y el Bacillus cereus var mycoides ATCC 11778 (Chile, 1997). Por otra parte, Ellerbroeck y col. (1997), después de probar la eficiencia de varias cepas bacterianas frente a antibacterianos utilizados en acuicultura, sugiere el empleo de Bacillus subtilis BGA y de E.coli ATCC 11303. También el pH del medio de cultivo en que se analizan las muestras, juega un rol importante, por cuanto se ha demostrado que influye sustancialmente en la difusión y acción del antibiótico y, por lo tanto, sobre el tamaño del halo de inhibición (Bielecka y col., 1981). Los niveles de pH más utilizados son 6,0 y 8,0, ampliando de este modo el espectro de detección de los antibacterianos. Niveles más ácidos o más básicos, interfieren en el desarrollo de la bacteria sensible, motivo por el cual se debe ser especialmente cauteloso en la fijación del pH del medio de cultivo. La muestra de elección para la detección de inhibidores en peces, es tejido muscular (Ellerbroeck y col., 1997; Chile, 1997)), el cual al ser depositado sobre el medio sólido de cultivo, permite que el antibacteriano difunda al medio, provocando la inhibición del crecimiento de la bacteria incluida en el substrato de cultivo. Dado que el tamaño del halo de inhibición es directamente propor-cional a la concentración del anti-bacteriano difundido (Bielecka y col., 1981), es necesario procurar trozos de músculo similares en tamaño, para cada muestra. Diferente es la situación cuando se trata de analizar un alimento líquido, como la leche, en cuyo caso se colocan alícuotas de 0,1 ml en perforaciones practicadas en el substrato de cultivo o bien discos filtro que absorben una cantidad determinada del líquido (FIL/IDF, 1991). El hecho de aplicar la muestra cuantificada, permite tener resultados más homogéneos e incluso, disponiendo de una curva de calibración confeccionada en base a substancias puras y en condiciones idénticas de substrato, hacer una estimación de la cantidad de residuo presente en la muestra. Considerando las ventajas que presentan las muestras líquidas en la evaluación de la presencia de antibióticos, algunos autores han experimentado con detección de residuos en suero de peces tratados con fármacos antibacterianos ( Björklund y col., 1992; Pérez, 1993). En base a los antecedentes descritos, se formuló la presente investigación que pretende aportar antecedentes sobre la detección, por métodos microbiológicos, de residuos de ácido oxolínico y oxitetraciclina en peces tratados, con énfasis en la determi-nación de la eficacia del uso de suero como muestra, comprobar el pH más adecuado para la detección de cada fármaco y determinar la sensibilidad de la cepa E.coli ATCC 11303, en comparación con Bacillus subtilis BGA para los antibacterianos mencionados.
Con el fin de obtener muestras in vivo con residuos de antibacterianos, se llevó a cabo un ensayo con 150 peces de la especie Salmo salar de un peso promedio cercano a los 2,7 Kg y clínicamente sanos. El centro experimental en que se realizó la medicación, está ubicado a 42º 18´de latitud Sur y 73º 40´ de longitud Oeste y la temperatura del agua, durante toda la fase experimental fue cercana a los 10ºC. Para la aplicación de los dos antibacterianos, se separaron 2 grupos de 75 peces, sometiendo un grupo a terapia oral con oxitetraciclina y el otro con ácido oxolínico, durante 10 días con la dosis recomendada por el fabricante, para cada antibacteriano que fue mezclado en el alimento (cuadro Nº 1). Previamente se tomaron muestras de 5 peces de cada grupo que sirvieron de control para comprobar la ausencia de inhibidores bacterianos. Una vez finalizado el período de medicación de 10 días, se tomaron muestras de suero y de músculo de 5 peces extraídos al azar, en los siguientes 9 días post tratamiento: 1, 2, 3, 4, 5, 10, 15, 20 y 30, obteniendo de este modo, muestras de suero y de músculo de 45 ejemplares sometidos a tratamiento con cada medicamento. Las muestras, conveniente-mente rotuladas, se almacenaron en conge-lación hasta el momento de su análisis. Para el análisis de los residuos se empleó agar nutritivo recomendado para análisis de antibióticos (Gesche, 1986), ajustado a pH 6,0 y 8,0. Al medio de cultivo de cada pH se adicionó una suspensión de E.coli ATCC 11303 y de B.subtilis BGA en una concentración final de 104 ufc/ml de medio de cultivo. Los 4 substratos de cultivo así obtenidos, se depositaron en placas de Petri de 90 mm de diámetro, a razón de 12,5 ml por placa, a fin de estandarizar a 2 mm la profundidad del mismo. De cada uno de los 5 peces muestreados por día, se obtuvieron cilindros de músculo de 8 mm de diámetro y 2 mm de altura, que se colocaron en duplicado sobre el substrato de cultivo de cada una de las 4 placas de Petri preparadas. En las mismas placas se colocó en duplicado el suero correspondiente a cada pez. Para ello se hicieron 2 perforaciones en el substrato de cultivo con un sacabocados de 8 mm de diámetro, en las cuales se depositaron 100 µl de suero del mismo pez. Las placas con las muestras fueron incubadas a 35ºC durante 20 - 24 horas, al cabo de lo cual se comprobó la pureza y densidad del crecimiento bacteriano y se procedió a medir el halo de inhibición formado, con ayuda de un pie de metro de 0,05 mm de precisión. Para ello se consideró la distancia entre el borde de la muestra de músculo o de la perforación, hasta el inicio del crecimiento bacteriano. De esta forma se dispuso de 10 valores (duplicado de 5 peces) de tamaño de halo de cada variable por día de muestreo. Con el valor promedio de estos datos, se confeccionaron gráficos destinados a demostrar la relación entre las variables: pH del medio de cultivo, cepa sensible y tipo de muestra para la detección de los antibacterianos ácido oxolínico y oxitetraciclina. Para lograr un expedito análisis de los datos de tamaño de halos de inhibición de las cepas bacterianas detectados en las diferentes variables estudiadas, se presentan gráficos que señalan el valor promedio de halos de inhibición (n = 10) obtenidos para cada día de muestreo luego de finalizado el tratamiento con los antibacterianos ácido oxolínico y oxitetraciclina. En cada línea de gráfico se da a conocer el valor del coeficiente de correlación ( r ) que entrega el programa computacional HG (Harward Graphics) empleado para la confección de los gráficos. Este valor demuestra el grado de asociación negativa obtenida para cada variable entre la concentración de antibacteriano (halo) y el tiempo de depleción. Los valores de correlación calculados con el programa Excel, fueron todos significativos al 1%, lo cual valida los datos obtenidos.
Cuadro 1. Concentración,
dosis, laboratorio de origen y nombre comercial de los antibióticos
oxitetraciclina y ácido oxolínico.
0000000000 Concentration,
dosis, origin and comertial name of the antibiotics oxitetraciclyne and oxolinic
acid.

RESULTADOS
1. pH del medio de cultivo. En la determinación de la afinidad de pH del medio de cultivo para los antibacterianos en estudio, se demuestra que tanto el ácido oxolínico (gráfico 1) como la oxitetraciclina (gráfico 2) actúan mejor en el substrato de cultivo ajustado a pH 6,0 que en aquel de pH 8,0. Ello se deduce de la obtención de un mayor tamaño de halos de inhibición obtenidos para ambos antibacterianos, con las muestras de músculo depositadas en el substrato de cultivo a pH 6,0. La cepa sensible en ambos medios de cultivo, corresponde a B.subtilis BGA. Analizando los mismos gráficos (1 y 2), se puede determinar que esta diferencia de tamaño del halo de inhibición logrado entre pH 6,0 y 8,0, se hace más manifiesta en la medida que disminuye la concentración del antibacteriano en el músculo. Para el caso del ácido oxolínico, esto corresponde a los días 3, 4 y 5 post tratamiento (gráfico 1), y en el caso de la oxitetraciclina (gráfico 2), se visualiza lo mismo en los días 5, 10 y 15 después de terminado el tratamiento.
| Gráfico1: Influencia del
pH en la detección de ácido oxilínico. |
| Gráfico 2: Influencia del
pH en la detección de oxitetraciclina. 00000000Muestra = músculo. Cepa = B. subtitis BGA. 00000000Influence of the pH value on the detection of oxitetraciclina. 00000000Sample = muscle. Strain = B. subtitis BGA. |
2. sensibilidad de E.coli ATCC 11303. La cepa E.coli ATCC 11303, resultó ineficaz para la detección de oxitetraciclina en los peces tratados, dado que ninguna de las muestras presentó halos de inhibición en las placas que llevaban esta cepa como organismo sensible. Vale decir, la bacteria se mostró resistente a las concentraciones de oxitetraciclina presente como residuo en los peces tratados.
Distinta fue la situación en el caso de la detección de ácido oxolínico, ya que tal como se muestra en el gráfico 3, con ambas bacterias se detectaron halos de inhibición en los días 1 a 5 post tratamiento.
| Gráfico 3: Halos de inhibición
provocados por ácido oxolínico en el sustrato de cultivo con 0000000B. subtitis BGA y E. coli 11303. Muestra = músculo. pH = 6,0. 0000000Inhibition halo produced by oxolinic acid on sustrate with B. subtitis BGA y E. coli 11303 0000000Sample = muscle. pH = 6,0. |
Sin embargo, considerando que los halos de inhibición logrados con E. coli fueron siempre proporcionalmente menores que los obtenidos con B.subtilis BGA, se deduce que en el presente estudio fue la última cepa la cual resultó más adecuada para la detección de ácido oxolínico presente como residuo en las muestras analizadas.
3. Muestras de suero y músculo. Los resultados de tamaño de halo de inhibición obtenidos con muestras de suero y músculo de los peces tratados con ácido oxolínico (gráfico 4), colocados en el substrato de cultivo a pH 6,0 y con B.subtilis BGA como cepa sensible, se puede comprobar que éstos fueron siempre superiores con las muestras de suero.
| Gráfico 4: Relación
tamaño de halos obtenidos en muestra de suero y músculo en
la detección 00000000de ácido oxolínico. Cepa = B, subtitis BGA. pH = 6,0. 00000000Relationship between halo obtained with suero and muscle as sample, in the detection of 00000000oxolinic acid. Strain = B. subtitis BGA. pH = 6,0. |
Cabe destacar, que usando suero como muestra para la detección de ácido oxolínico, se encontraron resultados positivos incluso en los días 10 y 15 después de finalizado el tratamiento, situación que no se dio con las muestras de músculo para la misma fecha.
Al hacer la comparación de tamaño de halos de inhibición obtenidos con muestras de suero y músculo de los peces tratados con oxitetraciclina (gráfico 5), se observa un cuadro similar al anterior. Vale decir, siempre los halos obtenidos con muestras de suero, fueron superiores a los encontrados con músculo como muestra.
| GRAFICO 4: Relación
tamaño de halos obtenidos en peces tratados con oxitetraciclina en 00000000000muestras de suero y músculo a pH 6 con B. subtitis BGA. 00000000000Relationship between halo obtained with suero and muscle of fish traited with oxitetraciclina. 00000000000Strain = B. subtitis BGA. pH = 6,0. |
DISCUSIÓN
Los antibacterianos oxitetraciclina y ácido oxolínico pertenecen a fármacos usados frecuentemente en el tratamiento de afecciones en peces y, debido a su retención , la legislación chilena ha puesto especial énfasis en su detección en el producto terminado. Para ello se usa de preferencia la detección por métodos microbiológicos a través de cepas reconocidamente sensibles, a la vez que se sugiere el uso de diferentes niveles de pH del susbstrato de cultivo (Chile, 1997). Como lo demuestran los resultados señalados en los gráficos 1 y 2, ambos antibacterianos tienen una mejor acción cuando se encuentran en un substrato a pH ácido (6,0). Al respecto, Gesche y col. (1991), trabajando con substancias puras de diferentes antibióticos empleados en producción animal, probaron la afinidad de ellos por determinado nivel de pH del medio de cultivo, concluyendo que antibióticos de los grupos ß-lactámicos y tetraciclinas, reaccionan mejor a pH 6,0, mientras que macrólidos y aminoglicósidos, lo hacen mejor a pH 8,0. También Barrientos (1998), trabajando con substancias puras de oxitetraciclina y de varias quinolonas que incluían el ácido oxolínico, demostró para ambos antibacterianos una mayor acción en el substrato de cultivo a pH 6,0. Ellerbroeck y col. (1997), quienes trabajaron con diversas bacterias sensibles y niveles de pH del medio de cultivo, determinaron que para oxitetraciclina la reacción fue siempre mejor a pH 6,0, en cambio, para ácido oxolínico, la afinidad por el pH fue dependiente de la cepa sensible incluida en el substrato de cultivo. En el análisis comparativo de sensibilidad de las cepas B.subtilis BGA y E.coli ATCC 11303 en los peces tratados con ácido oxolínico (gráfico 3), se pudo comprobar que en el substrato de cultivo a pH 6,0, este antibacteriano se detectó con ambas cepas bacterianas. Sin embargo, el tamaño del halo de inhibición provocado por B. subtilis BGA en el día 5 post tratamiento, superó en más de 3 mm a aquellos detectados con y E. coli ATCC 11303, motivo por el cual se puede considerar que B. subtilis BGA, fue más sensible para la detección de ácido oxolínico. En los peces tratados con oxitetraciclina, la mayor sensibilidad de B. subtilis BGA en relación a E.coli, ATCC 11303 quedó de manifiesto al no encontrarse halos de inhibición con las muestras colocadas sobre el substrato con E.coli como cepa sensible, en cambio, sí los hubo en las muestras colocadas sobre las placas con B.subtilis BGA. Al respecto, también Ellerbroeck y col. (1997) señalan una sensibilidad 10 veces superior de B.subtilis BGA sobre E.coli 11303, para la detección de oxitetraciclina. A su vez, Barrientos (1998), al comparar la sensibilidad de las cepas B.subtilis BGA, B. cereus ATCC 11778 y E. coli ATCC 11303, señala que B.subtilis BGA es la cepa de elección para la determinación de residuos de oxitetraciclina Los resultados obtenidos en este ensayo in vivo, no coinciden plenamente con aquéllos obtenidos por Barrientos (1998), quien consideró que E.coli ATCC 11303, es la cepa de elección para la determinación de quinolonas, encontrando valores de detección de 0,05 µg para ácido oxolínico con E. coli y de 0,126 µg con B. subtilis BGA. Por su parte, Ellerbroeck y col (1997), también describen a E.coli 11303 como la cepa más sensible a ácido oxolínico entre las cepas por ellos probadas. Aunque la concentración mínima detectable, para ellos es idéntica con E. coli y B. subtilis BGA en el susbstrato a pH 6,0. (0,025 µg), señalan que la sensibilidad de E.coli 11303 a pH 8,0 para la detección de ácido oxolínico es algo superior, puesto que encontraron un valor de detección mínima correspondiente a 0,01 µg. Las variaciones en la sensibilidad de detección de antimicrobianos descritas por los citados autores, pueden atribuirse a diferencias en la estandarización de las técnicas empleadas. Es así como Ellerbroeck y col. (1997) describen el uso de una concentración de 105 ufc de E.coli/ml de medio de cultivo, mientras Barrientos (1998) la fijó en 104 ufc/ml. En cuanto a la comparación de eficiencia de músculo y suero como muestras para la detección de residuos de inhibidores bacterianos, los gráficos 4 y 5 demuestran que para ambos antibacterianos se obtuvieron siempre tamaños de halo algo superiores en suero que en músculo. A la vez se aprecia que la correlación tamaño de halo vs día de muestreo en el período de depleción, es superior al trabajar con muestras de suero ( r = 0,96 y 0,99) que con músculo (r = 0,92 y 0,97). Este hecho se explica por una mayor facilidad de difusión del residuo en el suero, por tratarse de una muestra líquida. Un resultado similar obtuvo Pérez (1993), quien trabajó con peces Salmo salar en la etapa de cultivo de agua dulce, con un peso promedio de 30g. Este autor que trabajó con 4 antimicrobianos, entre los cuales estaban ácido oxolínico y oxitetraciclina, obtuvo mayores tamaños de halo con muestras de suero que con músculo, tanto en el período de tratamiento como en el muestreo posterior al mismo. También hace mención a la mayor estabilidad de datos obtenidos con las muestras de suero. Con los datos obtenidos para el ácido oxolínico (gráfico 4) se comprueba que, dada la mayor sensibilidad de detección de residuos del inhibidor en suero, éste se detectó en el día 15 post tratamiento, oportunidad en la cual el residuo contenido en el músculo, no provocó inhibición bacteriana, hecho de gran importancia práctica cuando el objetivo del muestreo es comprobar la depleción del antibacteriano aplicado en un centro de cultivo de peces de término. Si bien en el caso de peces, la extracción de sangre para la obtención de suero puede ofrecer un grado de dificultad mayor a la obtención de músculo, lo último implica el sacrificio del ejemplar con el consecuente costo, que será especialmente importante cuando se trata de comprobar la presencia de residuos en peces de término. La respuesta a los objetivos planteados en el presente trabajo se resumen de la siguiente forma: el ácido oxolínico y la oxitetraciclina se detectan mejor en el substrato a pH 6,0; la cepa Bacillus subtilis BGA, es más sensible que E.coli ATCC 11303, a la detección de ambos antibacterianos; las muestras de suero provocaron halos de inhibición de mayor tamaño que las de músculo del mismo pez y demostraron una mayor persistencia del residuo a través del tiempo de depleción de los fármacos
RESUMEN
Junto al desarrollo de la salmonicultura,
surge la necesidad de aplicación de antimicrobianos para el control de
enfermedades de los peces, aumentando el riesgo de la presencia de residuos
en el producto destinado al consumo.
Con la finalidad de aportar antecedentes
a la detección microbiológica de residuos de ácido oxolínico
y oxitetraciclina en peces, se trataron, 75 peces de la especie Salmo salar
con cada uno de los antibióticos. Para ello se escogieron peces con un
peso promedio de 2,7 Kg, y durante 10 días se les administró por
vía oral la dosis indicada por el fabricante para ambos antibacterianos.
Finalizado el período de tratamiento, se tomaron muestras de músculo
y suero de 5 peces en los días 1 a 5 y 10, 15, 20 y 30 post tratamiento.
Las muestras fueron conservadas en congelación para luego ser analizadas
por el método de detección del antibiótico por inhibición
bacteriana, utilizando Bacillus subtilis BGA y E. coli ATCC 11303
como cepas sensibles, incluidas en un medio de cultivo nutritivo a pH 6,0 y
8,0 respectivamente. Muestras de suero y de músculo de cada pez se colocaron
en duplicado en cada una de las 4 placas de Petri con los diferentes substratos
de cultivo. Después de la incubación de las placas a 35 ºC
por 24 h se midió el halo de inhibición bacteriana (en mm) provocado
por la difusión del residuo.
Los resultados demuestran que el ácido
oxolínico y la oxitetraciclina se detectan mejor en el substrato a pH
6,0, y que la cepa Bacillus subtilis BGA, es más sensible que
E.coli ATCC 11303, a la detección de ambos antibacterianos. Las
muestras de suero provocaron halos de inhibición de mayor tamaño
que las de músculo del mismo pez y demostraron una mayor persistencia
del residuo a través del tiempo de depleción de los fármacos.
Proyecto DID/UACh código: S-98-15
BIBLIOGRAFÍA
ACHURRA, M. 1992. Mercado mundial actual. Gran impulso a la salmonicultura chilena. Chile Pesquero 71: 21-24.
BARRIENTOS, M. 1998. Determinación de sensibilidad de detección microbiológica de residuos de Oxitetraciclina y Quinolonas de uso común en peces. Tesis de Licenciatura, Facultad de Ciencias Veterinarias, Universidad Austral de Chile, Valdivia.
BISHOP, J. R., C. H. WHITE, 1984. Antibiotics residues detection in Milk-a review. J. Food Prot. 47: 647-652.
BJÖERKLUND, H., J. BONDESTAM, G. BYLUND. 1990. Residues of oxytetracicline in wild fish and sediment from fish farms. Aquaculture 86 : 359-367.
BJÖERKLUND, H., A. ERIKSSON, G. BYLUND. 1992. Temperature-related absortion and excretion of oxolinic acid in rainbow trout (Oncorhynchus mykiss) Aquaculture 102: 17-27.
BOOTH, N. H., L. E. MC DONALD. 1988. Farmacología y terapéutica veterinaria. Editorial Acribia, Zaragoza, España.
BRAVO, S. 1993. Uso de quimioterápicos en enfermedades de salmonídeos. Chile Pesquero 75: 57-59.
CHILE. 1997. Ministerio de Economía Fomento y Reconstrucción. Sistema de control de residuos en peces de exportación. Servicio Nacional de Pesca. ORD.SP Nº 595/97. Valparaíso.
DOELZ, H. 1992. Consideraciones sobre el empleo de la quimioterapia antibacteriana en salmonicultura. Actualidad Farmacéutica 49: 7-9.
ELLERBROECK, L., C. SCHWARZ, G. HILDEBRANDT,E.WEISE,E-M. BERNOTH, H. J. PLUTA, G. ARNDT. 1997. Zur mikrobiologischen Erfassung von Rückständen antimikrobiell wirksamer Stoffe beim Fisch. Archiv für Lebensmittelhygiene 48: 1-6.
FIL/IDF INTERNATIONAL DAIRY FEDERATION. 1991. Detection and confirmation of inhibitors in Milk and Milk Products. IDF Bulletin Nº 258, 99 pp.
GESCHE, E. 1986. Detección de residuos de antibacterianos en carne. Técnica del Bacillus subtilis BGA. Monografías de Med.Vet. 8: 1-5.
GESCHE, E., M. VEGA, R. SAELZER, M. MAYOR. 1991. Influencia del pH del medio de cultivo en la detección microbiológica de residuos de antibióticos. Fleischwirtschaft español 1: 10-16.
HEITZMAN, R. J. 1994. Residues in food producing animals and their products. Reference materials and methods. Ed. Oxford. Blackwell Scientific Publication. London-Edimburg-Boston-Paris-Berlin-Vienna.
JACOBSEN, M. D. 1989. Withdrawal times of freshwater rainbow trout, Salmo gairdnerii Ricardson, after treatment with oxolinic acid, oxytetracycline and trimetroprim. J. Fish. Dis. 12: 29-36.
MOATS, W. A. 1983. Determination of Penicilin G, Penicilin V and Cloxacilin in Milk by Reversed-Phase High Performance Liquid Chromatografy. J. Agric. Food Chem. 31: 880-883.
NOUWS, J. F. M., M. SCHOTHORST, G. ZIV. 1979. A critical evaluation of several microbiological test method for residues of antimicrobial drugs in rumiants. Arch. Lebensmittelhyg. 30: 4-8.
PEREZ, A. 1993. Detección microbiológica de inhibidores bacterianos en peces tratados experimentalmente con cuatro antibacterianos. Tesis de Licenciatura, Facultad de Ciencias Veterinarias, Universidad Austral de Chile, Valdivia.
SILVA, J., G. ANHALT. 1980. Determinación de oxitetraciclina en cobayos infectados intramuscularmente comparando algunos métodos. Arch.Med.Vet. 12: 79-106.
Aceptado: 31.10.2000