Arch. Med. Vet., Vol. XXXV, N° 1, 2003, pp. 23-36
ARTICULOS ORIGINALES
Inmunohistoquímica en biopsias de piel tratadas con proteína K y microondas para el diagnóstico en animales persistentemente infectados con el virus diaria viral bovina*
Immunohistochemistry of skin biopsies treated with proteinase K and microwave for diagnosis of persistent bovine viral diarrhea virus infection
J. LERTORA1, M.V., Mg. Vet. Sci.; E. PAREDES1, M.V., Dr. med. vet.; G. REINHARDT2, M.V., Dr. med. vet.; A. ALBERDI1, T.M.
*Financiado
por Proyecto Fondecyt N° 1990717.
1 Instituto de Patología
Animal, Facultad de Ciencias Veterinarias.
2 Instituto de Microbiología, Facultad de Ciencias,
Universidad Austral de Chile, Casilla 567, Valdivia, Chile. e-mail: eparedes@uach.cl
Summary
The aims of this study were to set up and to evaluate an immunohistochemical technique in bovine skin biopsies for the diagnosis of persistently infected cattle with Bovine Viral Diarrhea virus. Formalin fixed, paraffinembedded skin tissues were submitted to different treatments for antigen retrieval, incubated with 15.c.5, WB160, WB162, WB210 and WB215 monoclonal antibodies, and developed with the biotin-streptoavidin-peroxidase system. Monoclonal antibodies 15.c.5 and WB210, which react with the glycoprotein Erns of the Bovine Viral Diarrhea virus, successfully detected the virus after unmasking the antigen. The remaining monoclonal antibodies did not react in formalin fixed tissues. The stain pattern and its distribution were identical in all persistently infected bovines examined and is typical of this condition. The immunohistochemistry applied to formalinfixed skin biopsies using monoclonal antibody 15.c.5, previous enzymatic antigenic unmasking, is a useful method for the diagnosis of persistently infected bovines.
Key words: Immunohistochemistry, bovine viral diarrhea virus, skin biopsies.
Resumen
Los objetivos de este estudio fueron montar y evaluar una técnica inmunohistoquímica en biopsias de piel para el diagnóstico de bovinos persistentemente infectados con el virus Diarrea Viral Bovina. Biopsias de piel, fijadas en formalina y embebidas en parafina, se sometieron a diferentes tratamientos recuperadores de antígeno, incubadas con los anticuerpos monoclonales 15.c.5, WB160, WB162, WB210 y WB215 y revelados con el sistema biotinastreptoavidina- peroxidasa. Los anticuerpos monoclonales 15.c.5 y WB210, los cuales reaccionan con la glicoproteína Erns del virus Diarrea Viral Bovina, inmunolocalizaron el antígeno viral previo desenmascaramiento antigénico. Los restantes anticuerpos monoclonales no reaccionaron en tejido fijado en formalina. El patrón de tinción y su distribución fue idéntico en los bovinos persistentemente infectados analizados y es distintiva de esta condición. La inmunohistoquímica en biopsias de piel fijadas en formalina, utilizando el anticuerpo monoclonal 15.c.5 previo desenmascaramiento antigénico proteolítico, es un método útil para el diagnóstico de bovinos persistentemente infectados.
Palabras claves: Inmunohistoquímica, virus Diarrea Viral Bovina, biopsias de piel.
INTRODUCCION
El virus Diarrea Viral Bovina (vDVB) pertenece al género Pestivirus de la familia Flaviviridae con un alto grado de variabilidad genética y antigénica. Estas características se reflejan en el espectro de manifestaciones clínicas que produce en el huésped, dificulta los métodos diagnósticos y limita la protección brindada por vacunas monovalentes (Paton, 1995). Afecta a bovinos de cualquier edad, ocasionando una variedad de síndromes, incluyendo trastornos respiratorios, digestivos, síndrome hemorrágico, inmunodepresión, enfermedad aguda de alta morbilidad y mortalidad, infección persistente y enfermedad mucosa (Kelling, 1996; Tremblay y col., 1996; Walz y col., 1999). El mayor impacto económico son los ocasionados por los trastornos reproductivos como ooforitis, muerte embrionaria y abortos (Moennig y Liess, 1995).
La infección presenta una distribución mundial y es endémica en la mayoría de las poblaciones bovinas. Alcanza un nivel de 0.5% a 2% de bovinos persistentemente infectados y 60% a 80% de bovinos seropositivos (Houe, 1999). La IX y X Regiones de Chile presentan una seroprevalencia de 73.8%, mientras que en rebaños lecheros de la Provincia de Valdivia, Chile, se observa una prevalencia predial del 100% y 50,9% de bovinos seropositivos (Reinhardt y col., 1990; Riedemann y col., 1996).
La principal fuente de infección y reservorio del virus en la naturaleza son los bovinos persistentemente infectados (Houe, 1999). En todo programa de control y erradicación de la enfermedad, empleen o no vacunación, es imprescindible el diagnóstico y eliminación de dichos animales (Brownlie y col., 2000).
Los bovinos persistentemente infectados pueden ser diagnosticados por aislamiento viral, ELISA, PCR e inmunohistoquímica. La inmunohistoquímica realizada en tejido fijado en formalina aventaja a otras técnicas en término de conveniencia en la remisión de muestras, permite estudios retrospectivos de muestras enviadas para examen histopatológico y permite una asociación precisa entre el antígeno viral con tipos celulares y lesiones histológicas (Dubovi, 1996). El reconocido epiteliotropismo del vDVB ha originado el desarrollo y validación de técnicas inmunohistoquímicas en biopsias de piel para el diagnóstico de bovinos persistentemente infectados. Esta técnica, en comparación con el aislamiento viral, permite un diagnóstico seguro, rápido y menos costoso (Thür y col., 1996; Njaa y col., 2000). El objetivo de este estudio fue montar y evaluar una técnica inmunohistoquímica en biopsias de piel fijadas en formalina para el diagnóstico rutinario de bovinos persistentemente infectados con el vDVB en Chile.
MATERIAL Y METODOS
Se utilizaron biopsias de piel (oreja) de 3 bovinos persistentemente infectados y de 3 bovinos seropositivos clínicamente normales provenientes de 10 predios lecheros de la provincia de Valdivia, Chile, diagnosticados en el Instituto de Microbiología de la Facultad de Ciencias de la Universidad Austral de Chile. Se consideraron animales persistentemente infectados aquellos que resultaron seronegativos con el método ELISA mediante el kit CHEKITBVD- SERO® (Dr. Bommeli AG, Suiza); y positivos al aislamiento viral, PCR y a la detección de antígeno con el método ELISA mediante el kit CHEKIT-BVD-VIRUS-II® (Dr. Bommeli AG, Suiza). Las muestras fueron fijadas en formalina tamponada al 10% por 24 horas, procesadas en autotécnico con la finalidad de ser deshidratadas e impregnadas en parafina, cortadas mediante micrótomo a 5 micras, montadas en portaobjetos con poly-l-lisina y procesadas de acuerdo a las consideraciones técnicas de Haines y Chelack (1991).
Los cortes de piel se desparafinaron y rehidrataron por inmersiones secuenciales en xilol (xilol I: 10 minutos y xilol II: 10 minutos), etanol (alcohol 100%: 5 minutos; alcohol 96%: 5 minutos; alcohol 80%: 5 minutos y alcohol 70%: 5 minutos) y agua destilada durante 5 minutos. La peroxidasa del tejido se inactivó, luego de la inmersión del tejido en alcohol 100%, con una solución de 0.5% de peróxido de hidrógeno en metanol absoluto por 30 minutos a temperatura ambiente. Posteriormente, los cortes se lavaron 3 veces en PBS por 5 minutos. El método de desenmascaramiento antigénico se estandarizó para cada anticuerpo primario; se incluyeron tres tratamientos diferentes: 1) Sin tratamiento. 2) Tratamiento con enzima proteolítica: los cortes se sometieron a la acción de proteinasa K (DAKO® Proteinase K Enzyme digestion. Dako Corporation, USA) en concentraciones de 0.04%, 0.004%, 0.002%, 0.001% y 0.0005% en buffer Tris-HCl 0.05 M, pH 7.5. La digestión proteolítica se realizó a 37° C durante 10, 20, 30 y 40 minutos en cámara húmeda. 3) Tratamiento en horno microonda: Los cortes se colocaron en coplin conteniendo buffer citrato 10 mM, pH 6, y tratados en horno microonda Mademsa (poder microonda 650 W, frecuencia nominal 2.450 Mhz) a potencia mínima durante 5, 10, 15 y 20 minutos y 50% de potencia durante 5, 10 y 15 minutos. Luego de cada tratamiento los cortes se lavaron 3 veces en PBS por 5 minutos. Como anticuerpo primario se utilizaron: - Anticuerpo monoclonal 15.c.5: específico para la proteína viral Erns (gp48) del vDVB (cortesía del Dr. Dubovi, New York State College of Veterinary Medicine, Veterinary Diagnostic Laboratory, Cornell University, Ithaca, NY) en diluciones de 1:300 a 1:12000 y Panel de anticuerpos monoclonales: WB162: específico para la proteína viral E2 (gp53) del vDVB; WB210: específico para la proteína viral Erns (gp48) del vDVB; WB215: específico para la proteína viral E2 (gp53) del vDVB y WB160: específico para la proteína viral NS2/3 (p125/ 80) del vDVB y virus de la Enfermedad de la Frontera (Central Veterinary Laboratory, UK) en dilución 1:20. Las secciones se incubaron con los anticuerpos monoclonales toda la noche en cámara húmeda a 4° C. Posteriormente, se lavaron 3 veces en PBS por 5 minutos. Para el revelado de la reacción antígeno anticuerpo se utilizó el sistema biotina-streptoavidinaperoxidasa (DAKO LSAB® 2 System, HRP. DAKO Corporation, USA). El anticuerpo secundario marcado con biotina se incubó con las muestras durante 30 minutos a temperatura ambiente en cámara húmeda y posteriormente se lavó 3 veces en PBS por 5 minutos. El complejo streptavidina-peroxidasa se incubó con las muestras por 30 minutos a temperatura ambiente en cámara húmeda y posteriormente se lavó 3 veces en PBS por 5 minutos. La reacción se visualizó con el cromógeno aminoetilcarbazol (se usó para poder diferenciar la reacción positiva de la melanina), incubado con las muestras durante 15 minutos a temperatura ambiente y posteriormente lavadas con agua destilada. Finalmente, las secciones fueron teñidas con hematoxilina de Mayer y montadas con Faramount (DAKO Corporation, USA, Code S3025).
Como control positivo se emplearon los bovinos persistentemente infectados y como control negativo se emplearon los bovinos seropositivos; además, secciones de cada muestra fueron procesadas en forma idéntica y simultánea reemplazando el anticuerpo primario específico por otro anticuerpo monoclonal irrelevante y PBS. Los resultados se presentaron en forma descriptiva.
RESULTADOS
Montaje y estandarización de la técnica inmunohistoquímica
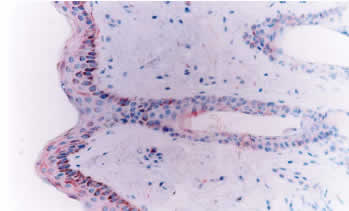
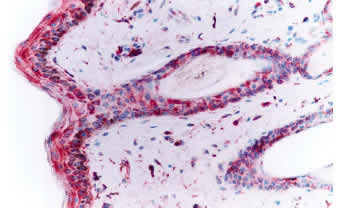
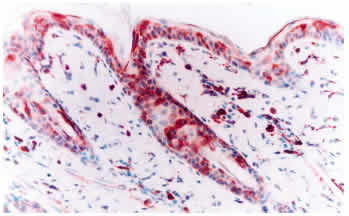
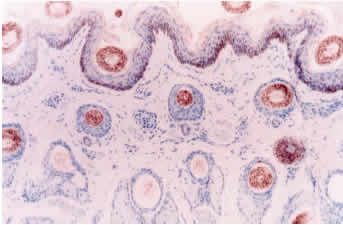
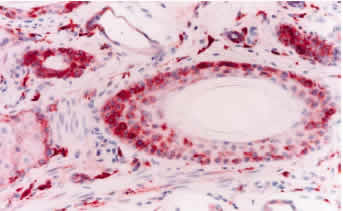
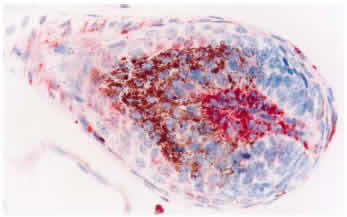
Desenmascaramiento antigénico: 1. Sin tratamiento: La inmunotinción empleando el anticuerpo primario 15.c.5, dilución 1:1000, no fue capaz de teñir todas las estructuras de la piel, ni todas las células de una misma estructura. Se observó una reacción moderada en células de músculo liso y en los epitelios de los folículos pilosos, principalmente los ubicados en el centro del tejido, mientras que fue débil en epidermis, macrófagos y glándulas sebáceas (figura 1). Las diluciones 1:300 y 1:500 fueron poco efectivas en mejorar la intensidad de reacción, por el contrario, originaron reacción inespecífica débil e intensificaron la reacción de fondo. Del panel de anticuerpos monoclonales (WB160, WB162, WB210 y WB215) el anticuerpo WB210, dilución 1:20, origino una reacción débilmente positiva en algunas células del epitelio folicular, epidermis, estroma y músculo piloerector (figura 3). 2. Tratamiento con enzima proteolítica: El desenmascaramiento antigénico proteolítico produjo una gran intensificación en la reactividad de la muestra para el anticuerpo monoclonal 15.c.5. Los tratamientos enzimáticos más efectivos fueron: proteinasa K 0.001% durante 20 y 30 minutos y proteinasa K 0.0005% durante 30 y 40 minutos a 37°C en cámara húmeda. Estos tratamientos fueron capaces de mejorar considerablemente la reacción, se obtuvo una inmunotinción específica (reacción granular de partículas virales intracitoplasmáticas) e intensa en todas las estructuras de la piel. A pesar de no observarse marcadas diferencias entre los tratamientos mencionados, se optó como tratamiento estándar la concentración de proteinasa K 0.0005% durante 40 minutos. Este tratamiento resultó en una reacción intensa en todas las estructuras, no alteró la morfología del tejido y permitió procesar mayor cantidad de muestras a igual cantidad de enzima (figura 2). Los restantes tratamientos resultaron en menor intensidad de reacción o en pérdida de morfología (cuadro 1). Los tratamientos con proteinasa K no mejoraron la reactividad del tejido frente a los anticuerpos monoclonales WB160, WB162, WB210 y WB215. 3. Tratamiento en horno microonda: Los diferentes tratamientos realizados en horno microonda no mejoraron la reacción del tejido frente al anticuerpo primario 15.c.5; por el contrario, la reacción disminuyó en forma drástica y, en los tratamientos más prolongados, afectaron la morfología del tejido y ocasionaron desprendimiento de las muestras. El tratamiento en horno microonda a 50% potencia durante 5 minutos fue el único que aumentó la reactividad del tejido frente al anticuerpo primario WB210, dilución 1:20. Este tratamiento, que registró una temperatura de 100° C al finalizar la irradiación, indujo una reacción moderada a intensa en todas las estructuras de la piel (Figura 4). Sin embargo, alteró levemente la morfología, principalmente a nivel del tejido conectivo, ocasionando en la mayoría de los casos desprendimiento parcial de la muestra. Los diferentes tratamientos térmicos no mejoraron la reactividad del tejido frente a los anticuerpos monoclonales WB160, WB162 y WB215, dilución 1:20.
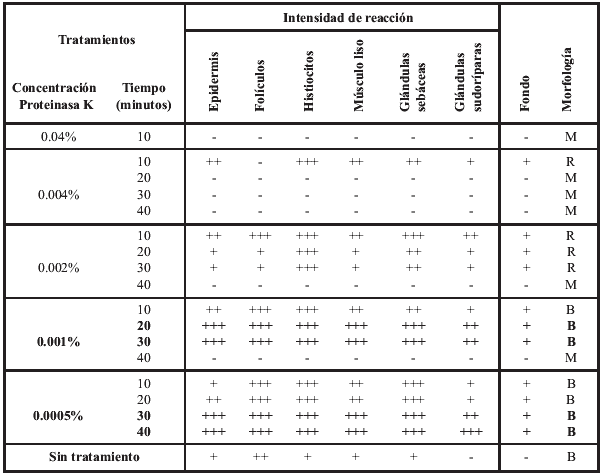
Intensidad
de reacción: - : Sin tinción; + : Tinción débil; ++ : Tinción
moderada; +++ : Tinción intensa. Morfología: B: Preservación de la morfología;
R: Leve digestión del tejido, caracterizado por disociación de células
epiteliales; M: Digestión total del tejido. Fondo: -: Sin tinción de
fondo; +: Tinción de fondo leve; ++: Tinción de fondo moderado; +++:
Tinción específica indiscernible de la tinción de fondo. |
|
|
Fondo |
||||||||||||||
|
|
+ - - - - - |
||||||||||||||
Intensidad de reacción: - : Sin tinción; + : Tinción débil; ++ : Tinción moderada; +++ : Tinción intensa. Fondo: -: Sin tinción de fondo; +: Tinción de fondo leve; ++: Tinción de fondo moderado; +++: Tinción específica indiscernible de la tinción de fondo. * Reacción focal. ç Reacción en células secretoras de algunas glándulas sebáceas. # Bovinos persistentemente infectados N° 1 y 2. ° Bovino persistentemente infectado N° 3. |
Anticuerpos primarios: Los tratamientos realizados no permitieron obtener reacción con los anticuerpos primarios WB160, WB162 y WB215. Este panel de anticuerpos se utiliza en conjunto ya que la utilización de un solo anticuerpo monoclonal (WB210) no identifica todas las variantes antigénicas del vDVB (Edwards y col., 1991). Por este motivo no se estandarizó la dilución de trabajo del anticuerpo monoclonal WB210 y se utilizó al anticuerpo monoclonal 15.c.5 como anticuerpo primario para analizar las muestras de los animales utilizados en este estudio. La dilución más alta del anticuerpo monoclonal 15.c.5 que produjo una tinción útil fue 1:6000. La intensidad de reacción fue semejante en los tres bovinos hasta la dilución 1:6000, disminuyendo la reacción a nivel de epidermis en los bovinos N° 1 y 2 a la dilución 1:12000. Con diluciones 1:1000, 1:2000 y 1:3000 se observó en los animales controles negativos tinción inespecífica de intensidad moderada a débil, principalmente en el estrato espinoso de la epidermis.
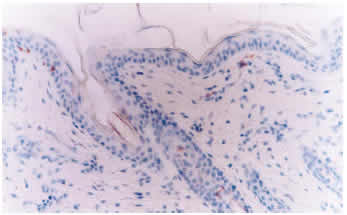
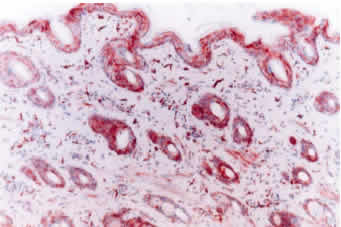
Reacciones control: Los controles negativos no presentaron reacción positiva o inespecífica al incubarse con el anticuerpo primario 15.c.5, dilución 1:6000, previo desenmascaramiento antigénico con proteinasa K 0.0005% durante 40 minutos a 37°C (Figura 5). No se observó reacción inespecífica al sustituir el anticuerpo primario 15.c.5 por los anticuerpos WB160, WB162 y WB215, dilución 1:20, o al remplazar el anticuerpo primario por otro anticuerpo monoclonal irrelevante y PBS en las muestras problemas, previo tratamiento enzimático.
Distribución de la inmunoreacción
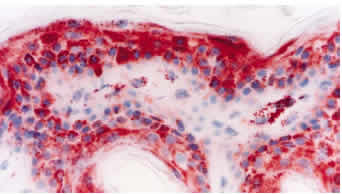
Las biopsias de piel de los tres bovinos persistentemente infectados resultaron positivas al anticuerpo monoclonal 15.c.5, dilución 1:6000, y presentaron similar patrón de tinción y distribución de la inmunoreacción. El patrón de tinción se visualizó como estructuras granulares de distinto diámetro, teñidas de rojo, localizadas en el citoplasma de las células epiteliales de la epidermis y folículos pilosos, células de las glándulas sebáceas, células de las glándulas sudoríparas, histiocitos, músculo liso y células endoteliales (Figura 6). La mayor intensidad de reacción se observó en histiocitos y células epiteliales. La epidermis presentó una tinción granular de distribución difusa (a lo largo de toda la biopsia), concentrada principalmente en las células del estrato espinoso y basal (Figura 7). La reacción se visualizó en todos los folículos pilosos y en sus distintos segmentos. Las distintas células que forman el folículo piloso mostraron reacción positiva, sin embargo, la reacción se concentró especialmente en las células de la vaina radicular externa (Figura 8). En los bulbos pilosos, las células que conforman la papila dérmica son las que presentan una mayor intensidad de tinción, mientras que el número de células positivas e intensidad de tinción fue menor en la matriz del bulbo piloso (Figura 9). También resultaron positivas las células que conforman la vaina de tejido conectivo que soporta al folículo piloso. Una intensa reacción se presentó en macrófagos/histiocitos a nivel de la dermis y, en menor proporción, en linfocitos. Las células del epitelio de las glándulas sudoríparas y, en menor proporción, sus células mioepiteliales y las células basales de las glándulas sebáceas presentaron reacción positiva al antígeno viral. Las células de músculo liso piloerector y de vasos sanguíneos presentaron una intensa reacción; mientras que el número de células positivas e intensidad de reacción fue menor en células endoteliales. También se evidenció reacción en las fibras nerviosas y perineuro y en células del tejido conectivo laxo del músculo estriado a nivel de la hipodermis.
DISCUSION
Los resultados de este trabajo demuestran que la técnica inmunohistoquímica permite diagnosticar bovinos persistentemente infectados a partir de biopsias de piel fijadas en formalina. Desde los informes de Bielefeldt Ohmann (1983) de la presencia de antígeno viral en piel de bovinos persistentemente infectados, han sido varios los estudios que confirman a la piel como una muestra útil y eficaz para la detección del vDVB en dichos animales (Thür y col., 1996; Brodersen y col., 1998; Hilbe y col., 2000; Njaa y col., 2000).
El principal objetivo de este estudio fue montar y evaluar una técnica inmunohistoquímica en biopsias de piel fijadas en formalina y no determinar su eficacia frente a otras técnicas para el diagnóstico de bovinos persistentemente infectados. Sin embargo, esta técnica fue capaz de diferenciar los 3 bovinos persistentemente infectados de los 3 bovinos no infectados diagnosticados previamente en el Instituto de Microbiología de la Facultad de Ciencias de la Universidad Austral de Chile con los métodos ELISA, PCR y aislamiento viral. Estudios previos, empleando el anticuerpo monoclonal 15.c.5 demuestran una concordancia de 97.6% entre el aislamiento viral (prueba de oro) y la inmunohistoquímica en biopsias de piel fijadas en formalina (Njaa y col., 2000). Otro ensayo demuestra una concordancia del 100% entre la inmunohistoquímica en tejido fijado en formalina y el aislamiento viral, empleando el anticuerpo monoclonal 15.c.5 (Baszler y col., 1995). Otras ventajas que han sido informadas son que las muestras fijadas en formalina son más estables que las muestras de sangre, evitándose así falsos negativos por autólisis o putrefacción, por otra parte, permite diferenciar bovinos persistentemente infectados de bovinos con infección aguda con un solo muestreo y permite analizar terneros neonatos ya que los anticuerpos calostrales no interfieren con la técnica (Brodersen y col., 1998; Njaa y col., 2000; Brodersen, 2001*). Además, la colección y remisión de las muestras es simple, es una técnica sencilla que requiere de equipamiento básico y, por tanto, de fácil implementación en los laboratorios de histopatología.
Este estudio sugiere fuertemente que el anticuerpo monoclonal 15.c.5 reconoce al antígeno viral en tejido fijado en formalina y embebido en parafina, previo desenmascaramiento antigénico enzimático. Este anticuerpo fue capaz de inmunolocalizar el vDVB en los 3 bovinos persistentemente infectados con una intensidad de reacción moderada a intensa y sin mostrar reacciones inespecíficas a la dilución empleada. Desde los trabajos de Haines y col. (1992), que demuestran la resistencia a los efectos de la fijación en formalina del epitope de la glicoproteína viral Erns (gp 48) que reconoce el anticuerpo monoclonal 15.c.5, la mayoría de los estudios de inmunolocalización del vDVB realizados en tejido fijados en formalina emplean dicho anticuerpo monoclonal (Baszler y col., 1995; Ellis y col., 1995; Marshall y col., 1996; Hewicker-Trautwein y col., 1997; Thür y col., 1997; Njaa y col., 2000; Haines y col., 2001; Shin y Acland, 2001). Otra observación, realizada en este estudio, que demuestra la resistencia a los efectos de la fijación en formalina del antígeno viral glicoproteína Erns, fue la inmunolocalización de dicho antígeno con el anticuerpo monoclonal WB210 previo desenmascaramiento antigénico en horno microonda. El anticuerpo monoclonal WB210 es una inmunoglobulina G1 que reacciona con un epitope de la glicoproteína viral Erns (Edwards y col., 1991).
Los resultados de este trabajo no permiten concluir si el anticuerpo monoclonal 15.c.5 es capaz de detectar a todos los aislados del vDVB de la región. Sin embargo, trabajos previos también reconocen a este anticuerpo como un excelente candidato para el diagnóstico del vDVB. El anticuerpo monoclonal 15.c.5 es una inmunoglobulina G2b que reacciona con un epitope de la glicoproteína viral Erns altamente conservada entre los aislados del vDVB; capaz de detectar a biotipos citopáticos y no citopáticos, aislados del genotipo 1 y 2 del vDVB; virus de la Peste Porcina Clásica, virus de la Enfermedad de la Frontera del ovino y hay evidencias que demuestran que podría reaccionar con Pestivirus caprinos (Caropi y col., 1990; Haines y col., 1992; Baszler y col., 1995).
La falta de reacción de los anticuerpos monoclonales WB160, WB162 y WB215 en los tejidos fijados en formalina probablemente se debió a los efectos de la fijación sobre los epitopes que reconocen estos anticuerpos. La formalina pudo haber desnaturalizado permanentemente estos epitopes, o los tratamientos efectuados para desenmascarar antígenos no fueron eficaces para recuperar estos antígenos u ocasionaron la destrucción de estos. La formalina afecta la antigenicidad del tejido (Shi y col., 1997) y la inmunolocalización del vDVB con anticuerpos monoclonales en tejido fijado en formalina es difícil, como lo demuestra el estudio de Haines y col. (1992), quienes observaron que la mayoría de los epitopes del virus son altamente vulnerables a los efectos de la fijación.
El patrón de tinción y su distribución fue idéntico en los 3 bovinos persistentemente infectados analizados.El patrón de tinción corresponde a lo esperado para una detección específica de partículas virales de localización intracitoplasmática. La técnica estandarizada en este trabajo permitió detectar inmunoreactividad para el antígeno viral en todos los tipos celulares presentes en la piel, con excepción del músculo esquelético de la hipodermis. La distribución de la reacción se caracterizó por una tinción generalizada de los queratinocitos de la epidermis, epitelio de todos los folículos pilosos y en sus diferentes regiones, glándulas cutáneas e histiocitos. Esta distribución es característica y distintiva de los bovinos persistentemente infectados y debe tomarse en cuenta para la realización del diagnóstico inmunohistoquímico. Estos resultados concuerdan con otros estudios (Bielefeldt Ohmann, 1983; Baszler y col., 1995; Thür y col., 1996; Njaa y col., 2000; Hilbe y col., 2000) y a pesar de que estos autores no mencionan la presencia de inmunoreacción para este antígeno en los nervios cutáneos, es reconocida la presencia del vDVB en neuronas y células de la glía del sistema nerviosos central (Waldvogel y col., 1995) y en neuronas de los ganglios mioentéricos (Wilhelmsen y col., 1991) de bovinos persistentemente infectados.
En conclusión, este estudio confirma el epiteliotropismo del vDVB y demuestra que se pueden diagnosticar bovinos persistentemente infectados a partir de biopsias de piel. La técnica inmunohistoquímica en biopsias de piel fijadas en formalina, utilizando el anticuerpo monoclonal 15.c.5, es una técnica útil para el diagnóstico de bovinos persistentemente infectados que complementa los métodos diagnósticos existentes y permitirá acelerar los programas de control y erradicación de la Diarrea Viral Bovina.
El anticuerpo monoclonal 15.c.5 puede ser considerado como una excelente herramienta para el diagnóstico del vDVB. La dilución óptima de trabajo con el anticuerpo monoclonal 15.c.5 es 1:6000 en las condiciones estandarizadas en este estudio.
La fijación en formalina 10% afecta la antigenicidad del vDVB. Sin embargo, los efectos de la fijación sobre epitopes del antígeno glicoproteína Erns fueron revertidos. Es imprescindible el desenmascaramiento antigénico por digestión proteolítica previa a la incubación con el anticuerpo primario 15.c.5. Los resultados de nuestro estudio permiten recomendar el empleo de proteinasa K 0.0005% (en buffer Tris-HCl 0.05 M, pH 7.5) durante 30 ó 40 minutos o proteinasa K 0.001% durante 20 ó 30 minutos, a 37°C en cámara húmeda. El patrón de tinción y la distribución de la reacción en distintas estructuras de la piel descrito en este estudio es característico de bovinos persistentemente infectados con vDVB.
AGRADECIMIENTOS
Agradecemos especialmente al Dr. Roberto Yulis A. por su asistencia técnica; al Sr. Genaro Alvial por el entrenamiento en la técnica inmunohistoquímica; al Dr. Nestor Tadich por la revisión crítica del manuscrito y facilitar las instalaciones del Hospital Veterinario y a la Sra. María Ines Montecinos por su asistencia en el laboratorio.
BIBLIOGRAFIA
BASZLER, T. V., J. F. EVERMANN, P. S. KAYLOR, T. C. BYINGTON, P. M. DILBECK. 1995. Diagnosis of naturally occurring bovine viral diarrhea virus infections in ruminants using monoclonal antibody-based immunohistochemistry. Vet. Pathol. 32: 609-618.
BIELEFELDT OHMANN, H. 1983. Pathogenesis of bovine viral diarrhea-mucosal disease: distribution and significance of BVDV antigen in diseased calves. Res. Vet. Sci. 34: 5-10.
BRODERSEN, B. W., A. K. WHITE, D. R. SMITH. 1998. Immunohistochemical test on skin biopsies as a method for detection of cattle persistently infected with bovine viral diarrhea virus. Proc. Am. Assoc. Bov. Pract. 31: 246.
BROWNLIE, J.; I. THOMPSON; A. CURWEN. 2000. Bovine virus diarrhoea virus-strategic decisions for diagnosis and control. In Practice 22:176-187.
CAROPI, W. V., R. O. DONIS, E. J. DUBOVI. 1990. Characterization of a panel of monoclonal antibodies and their use in the study of the antigenic diversity of bovine viral diarrhea virus. Am. J. Vet. Res. 51: 1388-1394.
DUBOVI, E. J. 1996. Laboratory diagnosis of bovine viral diarrhea virus infections. Vet. Med. 91: 867-872.
EDWARDS, S., V. MOENNING, G. WENSVOORT. 1991. The development of an international reference panel of monoclonal antibodies for the differentiation of hog cholera virus from other Pestiviruses. Vet. Microbiol. 29: 101-108.
ELLIS, J. A., K. MARTIN, G. R. NORMAN, D. M. HAINES. 1995. Comparison of detection methods for bovine viral diarrhea virus in bovine abortions and neonatal death. J. Vet. Diagn. Invest. 7: 433-436.
HAINES, D. M., B. J. CHELACK. 1991. Technical considerations for developing enzyme immunohistochemical staining procedures on formalin-fixed paraffin embedded tissues for diagnostic pathology. J. Vet. Diagn. Invest. 3:1 01- 112.
HAINES, D. M., E. G. CLARK, E. J. DUBOVI. 1992. Monoclonal antibody-based immunohistochemical detection of bovine viral diarrhea virus in formalinfixed, paraffin-embedded tissues. Vet. Pathol. 29: 27-32.
HAINES, D. M., K. M. MARTIN, E. G. CLARK, G. KEE JIM, E. D. JANZEN. 2001. The immunohistochemical detection of Mycoplasma bovis and bovine viral diarrhea virus in tissues of feedlot cattle with chronic, unresponsive respiratory disease and/or arthritis. Can. Vet. J. 42: 857-860.
HEWICKER-TRAUTWEIN, M., G. TRAUTWEIN, H. R. FREY, B. LIESS. 1997. Immunohistochemische untersuchungen zun organotropismus unterschiedlicher biotypen des BVD-Virus bei experimentell infizierten schaffeten. 1997. Dtsch.tierärztl. Wschr. 104: 436-439.
HILBE. M., K. ZLINSZKY, F. EHRENSPERGER. 2000. Demonstration of bovine viral diarrhea (BVD)-virus in hair root sheaths. European J. Vet. Pathol. 6: 31-32.
HOUE, H. 1999. Epidemiological features and economical importance of bovine viral diarrhoea virus (BVDV) infections. Vet. Microbiol. 64: 89-107.
KELLING, C. L. 1996. The effects of BVDV infection on cattle. Vet. Med. 91: 862-863.
MARSHALL, D. J.; R. A. MOXLEY; C. L. KELLING. 1996. Distribution of virus and viral antigen in specific pathogen-free calves following inoculation with noncytopathic bovine viral diarrhea virus. Vet. Pathol. 33: 311-318.
MOENNIG, V., B. LIESS. 1995. Pathogenesis of intrauterine infections with bovine viral diarrhea virus. Vet. Clin. N. Am: Food Anim. Pract. 11: 477-487.
NJAA, B. L., E. G. CLARK, E. JANZEN, J. A. ELLIS, D. M. HAINES. 2000. Diagnosis of persistent bovine viral diarrhea virus infection by immunohistochemical staining of formalin-fixed skin biopsy specimens. J. Vet. Diagn. Invest. 12: 393-399.
PATON, D. J. 1995. Pestivirus Diversity. J. Comp. Path. 112: 215-236.
REINHARDT, G., S. RIEDEMANN, S. ERNST, M. AGUILAR, R. ENRIQUEZ, J. GALLARDO. 1990. Seroprevalence of bovine viral diarrea/mucosal disease in southern Chile. Prev. Vet. Med. 10: 73-78.
RIEDEMANN, S., G. REINHARDT, N. TADICH, M. AGUILAR, R. AGUILAR, M. I. MONTECINOS, J. C. MIRANDA. 1996. Seroprevalencia de VDVB, VHB-1, PI-3 y VRSB en 12 predios lecheros de la Provincia de Valdivia, Chile. Arch. Med. Vet. 28: 121-124.
SHI SHAN-RONG, R. J. COTE, C. R. TAYLOR. 1997. Antigen retrieval immunohistochemistry: past, present and future. J. Histochem. Cytochem. 45: 327-343.
SHIN, T., H. ACLAND. 2001. Tissue distribution of bovine viral diarrhea virus antigens in persistently infected cattle. J. Vet. Sci. 2: 81-84.
THÜR, B., M. HILBER, M. STRASSER, F. EHRENSPERGER. 1997. Immunohistochemical diagnosis of Pestivirus infections associated with bovine and ovine abortion and perinatal death. Am. J. Vet. Res. 58: 1371-1375.
THÜR, B., K. ZLINSKY, F. EHRENSPERGER. 1996. Immunohistochemical detections of bovine viral diarrhea virus in skin biopsies: a reliable and fast diagnostic tool. J. Vet. Med A 43: 163-166.
TREMBLAY, R., S. CARMAN, D. STEVENSON, P. LUSIS, D. CALDWELL, J. SHAPIRO. 1996. Acute BVD in Ontario. International Symposium Bovine Viral Diarrhea Virus A 50 Year Review, Cornell University, USA, pp. 65.
WALDVOGEL, A.S., F. EHRENSPERGER, O.C. STRAUB, A. POSPISCHIL. 1995. An immunohistochemical study of the distribution of border disease virus in persistently infected sheep. J. Comp. Path. 113: 191-200.
WALZ, P. H., B. A. STEFICEK, J. C. BAKER. 1999. Effect of experimentally induced type II bovine viral diarrhea virus infections on platelet function in calves. Am. J. Vet. Res. 60: 1396-1401.
WILHELMSEN, C. L., S. R. BOLIN, J. F. RIDPATH, N. F. CHEVILLE, J. P. KLUGE. 1991. Lesions and localization of viral antigen in tissues of cattle with experimentally induced or naturally acquired muscosal disease, or with naturally acquired chronic bovine viral diarrhea. Am. J. Vet. Res. 52: 269-275.
Aceptado: 05.05.2003.