Arch. Med. Vet., Vol. XXXV, N° 2, 2003, pp. 139-150
ARTICULOS ORIGINALES
Caracterización funcional y localización del receptor GM-CSF en espermatozoides bovinos*
Functional characterization and localization of GM-CSF receptor in bovine spermatozoa
L. T. VILANOVA1,2,3, M.V., Mg.Cs. Dr. Cs. Vets.; M. C. RAUCH1, BQ.; A. ZAMBRANO1, BQ.; M. BRITO1, T.M.; E. WERNER1, BQ.; I. I. CONCHA1, M.Sc. Dr. Cs
*
Financiado por FONDECYT 199-0994, DID D-200108, FUNDAYACUCHO.
1 Instituto de Bioquímica,
Facultad de Ciencias y 2 Programa de Doctorado
en Ciencias Veterinarias, Universidad Austral de Chile, Valdivia y 3
Facultad de Ciencias Veterinarias, Universidad Centroccidental Lisandro Alvarado,
Barquisimeto, Venezuela.
*Correspondencia: Dra. Ilona I. Concha. Fono: 56-63-221795; Fax: 56-63-221406;
email: iconcha@uach.cl
Summary
The granulocyte-macrophage
colony stimulating factor (GM-CSF) is a pleiotropic cytokine with the main
function of regulating the proliferation and differentiation of myeloid precursor
cells as well as to stimulate the functioning of mature mononuclear granulocytes
and phagocytes. Its receptor is a glycoprotein formed by two subunits, ![]() and ß, and it is expressed in precursor and mature myeloid cells, as well
as in some nonhematopoietic cells. We have recently demonstrated that bull
spermatozoa express functional GM-CSF receptors that signal an increased glucose
and vitamin C uptake. The presence of GM-CSF receptor in epididymal and ejaculated
spermatozoa was determined in this study and the a subunit was found in the
acrosome and tail of the spermatozoa whilst the ß subunit was restricted to
the tail. Computer assisted sperm analysis (CASA) demonstrated that the addition
of GM-CSF to capacitated sperm in the presence of fructose increased the patterns
of sperm motility in the majority of the variables analysed. Altogether, these
findings suggest that GM-CSF is a key molecule to the better understanding
of sperm physiology.
and ß, and it is expressed in precursor and mature myeloid cells, as well
as in some nonhematopoietic cells. We have recently demonstrated that bull
spermatozoa express functional GM-CSF receptors that signal an increased glucose
and vitamin C uptake. The presence of GM-CSF receptor in epididymal and ejaculated
spermatozoa was determined in this study and the a subunit was found in the
acrosome and tail of the spermatozoa whilst the ß subunit was restricted to
the tail. Computer assisted sperm analysis (CASA) demonstrated that the addition
of GM-CSF to capacitated sperm in the presence of fructose increased the patterns
of sperm motility in the majority of the variables analysed. Altogether, these
findings suggest that GM-CSF is a key molecule to the better understanding
of sperm physiology.
Key words: GM-CSFr, sperm physiology, sperm motility.
Resumen
El Factor Estimulador de Colonias
de Macrófagos y Granulocitos (GM-CSF) es una citoquina pleiotrópica que tiene
como principal función regular la proliferación y diferenciación celular de
los precursores de células mieloides, así como también estimular el funcionamiento
de granulocitos mononucleares maduros y fagocitos. Su receptor es una glicoproteína
compuesta por dos subunidades, ![]() y ß, que se expresan en células mieloides precursoras y maduras, así como
también en otras células no hematopoyéticas. Nosotros hemos demostrado recientemente
que los espermatozoides bovinos expresan receptores de GM-CSF funcionales
que señalizan un aumento del transporte de glucosa y vitamina C. En este estudio
se determinó la presencia de este receptor en espermatozoides epididimarios
y eyaculados, localizándose la subunidad
y ß, que se expresan en células mieloides precursoras y maduras, así como
también en otras células no hematopoyéticas. Nosotros hemos demostrado recientemente
que los espermatozoides bovinos expresan receptores de GM-CSF funcionales
que señalizan un aumento del transporte de glucosa y vitamina C. En este estudio
se determinó la presencia de este receptor en espermatozoides epididimarios
y eyaculados, localizándose la subunidad ![]() en la región acrosómica y en la cola de los espermatozoides, y la subunidad
ß en la cola espermática. Mediante análisis computarizado del movimiento espermático
se encontró que el GM-CSF aumenta el patrón de movimiento espermático en la
mayoría de las variables seminales estudiadas en espermatozoides capacitados
en presencia de fructosa. Estos hallazgos sugieren que GM-CSF es una molécula
clave para el mejor entendimiento de la fisiología espermática.
en la región acrosómica y en la cola de los espermatozoides, y la subunidad
ß en la cola espermática. Mediante análisis computarizado del movimiento espermático
se encontró que el GM-CSF aumenta el patrón de movimiento espermático en la
mayoría de las variables seminales estudiadas en espermatozoides capacitados
en presencia de fructosa. Estos hallazgos sugieren que GM-CSF es una molécula
clave para el mejor entendimiento de la fisiología espermática.
Palabras claves: GM-CSFr, fisiología espermática, motilidad espermática.
INTRODUCCION
El Factor Estimulador de Colonias de Granulocitos y Macrófagos (GM-CSF) es una citoquina involucrada en la proliferación y diferenciación de los precursores de células mieloides, en la estimulación funcional de los granulocitos y fagocitos mononucleares maduros, y en la proliferación y diferenciación de las células progenitoras hematopoyéticas.
Este factor de crecimiento es producido por una gran variedad de tipos celulares, incluyendo las células T, células B, macrófagos, células endoteliales y fibroblastos, en respuesta a estímulos celulares (Gasson, 1991).
El GM-CSF media sus efectos
con la interacción de su receptor ubicado en la superficie celular, el cual
es una glicoproteína compuesta por dos subunidades: ![]() y ß (Hayashida y col., 1990) y han sido encontrados también
en células no hematopoyéticas, como trofoblasto de placenta, células endoteliales
y oligodendrocitos en el sistema nervioso (Bussolino y col.,
1989; Gearing y col., 1989; Baldwin y
col., 1993), en algunas neoplasias y líneas celulares tumorales (Baldwin
y col., 1989), en el tracto genital femenino (Zhao y col.,
1995; Gilchrist y col., 2000), en células germinales
masculinas y en espermatozoides bovinos (Zambrano, 2001),
sin que se conozca su papel fisiológico en estas células. En los gametos masculinos
estas subunidades han sido inmunolocalizadas en la cola de los espermatozoides
bovinos, apareciendo la subunidad a adicionalmente en el acrosoma. La funcionalidad
de este receptor fue establecida por Zambrano y col. (2001)
a través del incremento en el transporte de glucosa y vitamina C a través
de los transportadores facilitativos de hexosas (GLUTs), los cuales componen
una familia de proteínas que pueden tener una actividad transportadora multifuncional,
transportando glucosa, fructosa y vitamina C (Vera y col.,
1995; Concha y col., 1997; Angulo y col.,
1998).
y ß (Hayashida y col., 1990) y han sido encontrados también
en células no hematopoyéticas, como trofoblasto de placenta, células endoteliales
y oligodendrocitos en el sistema nervioso (Bussolino y col.,
1989; Gearing y col., 1989; Baldwin y
col., 1993), en algunas neoplasias y líneas celulares tumorales (Baldwin
y col., 1989), en el tracto genital femenino (Zhao y col.,
1995; Gilchrist y col., 2000), en células germinales
masculinas y en espermatozoides bovinos (Zambrano, 2001),
sin que se conozca su papel fisiológico en estas células. En los gametos masculinos
estas subunidades han sido inmunolocalizadas en la cola de los espermatozoides
bovinos, apareciendo la subunidad a adicionalmente en el acrosoma. La funcionalidad
de este receptor fue establecida por Zambrano y col. (2001)
a través del incremento en el transporte de glucosa y vitamina C a través
de los transportadores facilitativos de hexosas (GLUTs), los cuales componen
una familia de proteínas que pueden tener una actividad transportadora multifuncional,
transportando glucosa, fructosa y vitamina C (Vera y col.,
1995; Concha y col., 1997; Angulo y col.,
1998).
También se han aislado distintas citoquinas en el líquido folicular (Mendoza y col., 1999) incluyendo al GM-CSF (Jasper y col., 1996), señalándolas como reguladoras positivas de la fase final del desarrollo del ovocito intrafolicular. Este factor se ha aislado también en oviducto (Zhao y col., 1994), donde podría estar involucrado en las variaciones biológicas y morfológicas que se establecen cíclicamente en este órgano como consecuencia de las fases del ciclo estral. Sin embargo, no se puede descartar que la presencia del factor en el oviducto y en el líquido folicular pudiera ser parte del fenómeno de reclutamiento espermático y/o del proceso de capacitación espermática.
En este estudio se demuestra la presencia del receptor de GM-CSF en espermatozoides bovinos y que la adición de GM-CSF aumenta algunos parámetros de la motilidad espermática.
MATERIAL Y METODOS
Una parte del presente trabajo estudió las modificaciones que pudiera sufrir el receptor GM-CSF durante el tránsito epididimario y, para tal fin, los espermatozoides provenientes del epidídimo se obtuvieron de órganos genitales de 10 toros sacrificados. El estudio sobre la inmunolocalización de las dos subunidades del receptor en espermatozoides maduros se basó en el análisis de 70 eyaculados provenientes de 7 toros adultos de 3 años de edad pertenecientes al Centro de Inseminación Artificial de la Universidad Austral de Chile (CIA-UACh). El análisis computarizado del movimiento espermático se realizó en 10 eyaculados de toros provenientes del CIA-UACh.
Obtención de espermatozoides epididimarios. Todo el contenido escrotal se transportó desde el matadero al laboratorio en un termo previamente enfriado con hielo. Una vez en el laboratorio se disecó el epidídimo, separándolo del testículo y se procedió a cortar la cabeza y cuerpo del epidídimo colocando los trozos de tejido en PBS (NaCl 150 mM, NaH2PO4 15 mM [pH 7,4]) por 5 minutos; posteriormente se filtró la solución obtenida y se centrifugó dos veces por 10 minutos a 1500 g. Para extraer los espermatozoides de la cola del epidídimo, se realizó una incisión sobre dicha porción del órgano y con una pipeta Pasteur se aspiró el fluido espermático. Se centrifugó 2 veces con PBS a 1500 g por 10 minutos.
Inmunocitoquímica
en esparcidos de espermatozoides. Este
procedimiento se realizó tanto en espermatozoides provenientes del epidídimo,
semen descongelado y espermatozoides capacitados. Se depositó el material
seminal (epididimario y semen descongelado) en tubos estériles y se lavaron
con PBS mediante centrifugación a 1500 g por 10 minutos a 4°C. Los espermatozoides
se esparcieron sobre portaobjetos y se fijaron con HistochoiceT. La peroxidasa
endógena se bloqueó con peróxido de hidrógeno (H202)
al 1% y luego se lavaron con PBS para proceder posteriormente a bloquear con
una solución conteniendo leche descremada 5%, BSA 1%, Tritón X-100 0,3% en
PBS. Las muestras se cubrieron con 100 µl de una dilución 1:100 (en solución
de bloqueo) de los anticuerpos contra las subunidades ![]() y ß del receptor del GM-CSF humano (Santa Cruz Biotechnology, Inc.), incubándose
toda la noche a 4°C en cámara húmeda. Se utilizó el DAKOR Quick
Staining Kit HRP para el revelado. Las células se contratiñeron con
hematoxilina y se observaron con microscopía óptica. Los controles negativos
se realizaron incubando las muestras con los anticuerpos preabsorbidos con
el péptido respectivo.
y ß del receptor del GM-CSF humano (Santa Cruz Biotechnology, Inc.), incubándose
toda la noche a 4°C en cámara húmeda. Se utilizó el DAKOR Quick
Staining Kit HRP para el revelado. Las células se contratiñeron con
hematoxilina y se observaron con microscopía óptica. Los controles negativos
se realizaron incubando las muestras con los anticuerpos preabsorbidos con
el péptido respectivo.
Estudio de la motilidad espermática mediante análisis computarizado. Se descongelaron 3 dosis de semen a 40°C por 15 segundos, colocando el semen sobre una columna de Percoll (90% y 45%, respectivamente) para ser centrifugado por 23 minutos a 1500 g. Una vez eliminado el sobrenadante, el sedimento espermático se lavó por centrifugación a 1200 g por 8 minutos con 5 ml con solución de lavado espermático SPW (CaCl2 5.3 mM, MgCl2 0.98 mM, NaCl 249.6 mM, KCl 6.29 mM, NaHCO3 3.99 mM, Na2HPO4 0.65 mM, Piruvato de sodio 2 mM, HEPES 19.97 mM, kanamicina 0.24 mM, lactato de sodio 0.38% y BSA 1.2%). Se eliminó el sobrenadante (hasta 0.5 ml) y se resuspendió con 1 ml de SpTalp conteniendo Heparina 10 µg/ml, conteniendo 5 mM de glucosa o 16 mM de fructosa (grupos control). Las muestras fueron incubadas en un ambiente de máxima humedad, 38°C y 5% de CO2 por 5 horas. Cada hora se tomó una muestra de 4 µl (grupo control) y se llenó la cámara MicroCell de 20 µm de profundidad (Conception Technologies, USA) procediéndose a sellar el borde de entrada con parafina líquida para evitar la desecación de la muestra. Inmediatamente se procedió a analizar el movimiento espermático con el analizador Hobson Sperm Tracker. En el caso del grupo experimental a la tercera hora de incubación se adicionaron a la muestra seminal 4 nM de GM-CSF (concentración final 2 nM) resuspendido en SpTalp con 5 mM de glucosa o 16 mM de fructosa (según el grupo experimental). De esta solución fueron tomados 4 µl procediéndose a llenar la cámara MicroCell, sellando la entrada de la misma forma como anteriormente se explicó y se procedió al análisis del movimiento espermático.
Se evaluaron las siguientes variables seminales: Frecuencia del golpe flagelar (FGF) (Hz), Velocidad curvilínea (VCL) (µm/seg), Desplazamiento angular de la cabeza (DAC) (grados), Movimiento progresivo (MP) (%), Amplitud del Desplazamiento lateral de la cabeza (DALC) (µm), Velocidad en línea recta (VL) (µm/seg), Linealidad (LIN) (%), Porcentaje de espermatozoides activos (PEA) (%).
Análisis estadístico. Los experimentos de CASA fueron realizados en 6 réplicas por cada grupo (grupos controles y experimentales de cada toro), usando espermatozoides de 5 eyaculados por cada una de las 5 réplicas. Los datos para las características del movimiento espermático fueron comparados entre los grupos controles y experimentales por medio del test de Kruskal-Wallis. Estos resultados se presentaron como promedio ± D.E.
RESULTADOS
Inmunolocalización
de las subunidades ![]() y ß del receptor GM-CSF en espermatozoides
epididimarios. Se utilizó la técnica de inmunocitoquímica sobre esparcidos
de espermatozoides obtenidos de las tres porciones del epidídimo (cabeza,
cuerpo y cola) con la finalidad de localizar ambas subunidades del receptor
GM-CSF. En la figura 1 se puede observar la ubicación de
la subunidad
y ß del receptor GM-CSF en espermatozoides
epididimarios. Se utilizó la técnica de inmunocitoquímica sobre esparcidos
de espermatozoides obtenidos de las tres porciones del epidídimo (cabeza,
cuerpo y cola) con la finalidad de localizar ambas subunidades del receptor
GM-CSF. En la figura 1 se puede observar la ubicación de
la subunidad ![]() en espermatozoides obtenidos de la cabeza (panel A), cuerpo (panel B) y cola
(panel C) del epidídimo. La localización de esta subunidad en espermatozoides
de la cabeza del epidídimo se circunscribe a la región acrosómica y a la cola
de los espermatozoides, teniendo la misma inmunolocalización en los espermatozoides
del cuerpo del epidídimo pero con una reacción menos intensa. Mientras que
en los espermatozoides de la cola del epidídimo la inmunorreacción del acrosoma
es poco intensa y con tendencia a desaparecer. La inmunolocalización de la
subunidad ß en espermatozoides obtenidos de las tres porciones del epidídimo
(panel A´, B´ y C´) se mantiene restringida a la cola del espermatozoide de
una manera inalterada y homogénea. En ambos casos, se encontró una intensa
inmunorreacción sobre la gota citoplasmática.
en espermatozoides obtenidos de la cabeza (panel A), cuerpo (panel B) y cola
(panel C) del epidídimo. La localización de esta subunidad en espermatozoides
de la cabeza del epidídimo se circunscribe a la región acrosómica y a la cola
de los espermatozoides, teniendo la misma inmunolocalización en los espermatozoides
del cuerpo del epidídimo pero con una reacción menos intensa. Mientras que
en los espermatozoides de la cola del epidídimo la inmunorreacción del acrosoma
es poco intensa y con tendencia a desaparecer. La inmunolocalización de la
subunidad ß en espermatozoides obtenidos de las tres porciones del epidídimo
(panel A´, B´ y C´) se mantiene restringida a la cola del espermatozoide de
una manera inalterada y homogénea. En ambos casos, se encontró una intensa
inmunorreacción sobre la gota citoplasmática.
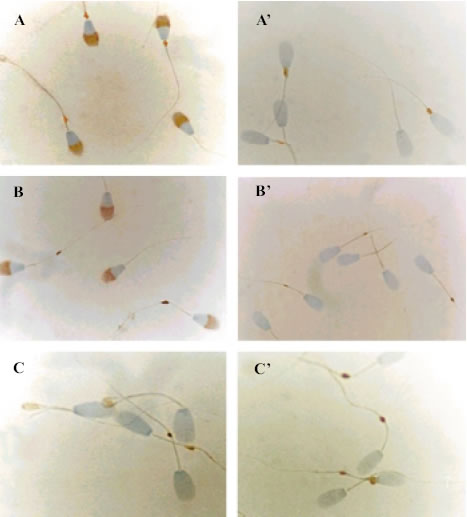
Inmunolocalización
de las subunidades ![]() y ß del receptor GM-CSF en espermatozoides
eyaculados. La subunidad
y ß del receptor GM-CSF en espermatozoides
eyaculados. La subunidad ![]() se inmunolocalizó invariablemente en el acrosoma y en la cola espermática,
aunque sí se evidenció variabilidad en la intensidad de la inmunorreacción
entre los distintos eyaculados usados, siendo esto más notable en el acrosoma
(figura 2, panel A). Con respecto a la subunidad ß, se demostró
que mantiene la misma localización que en los espermatozoides epididimarios,
restringiéndose al flagelo (figura 2, panel B).
se inmunolocalizó invariablemente en el acrosoma y en la cola espermática,
aunque sí se evidenció variabilidad en la intensidad de la inmunorreacción
entre los distintos eyaculados usados, siendo esto más notable en el acrosoma
(figura 2, panel A). Con respecto a la subunidad ß, se demostró
que mantiene la misma localización que en los espermatozoides epididimarios,
restringiéndose al flagelo (figura 2, panel B).

Estudio de la motilidad espermática mediante análisis computarizado. Se estudió mediante análisis computarizado del movimiento espermático, el efecto que produce la adición de GM-CSF 2 nM a espermatozoides bovinos capacitados con 10 µg/ml de heparina en presencia de glucosa 5 mM o de fructosa 16 mM. Inmediatamente después de incubar la muestra seminal en el medio capacitante, se comenzaron a medir las variables seminales cada 1 hora hasta completar las 5 horas de incubación. A las 3 horas de comenzada la incubación se adicionó al medio heparinizado, GM-CSF 2 nM. Se realizaron cinco réplicas en cada grupo. En el cuadro 1 se muestran comparativamente los resultados de las 8 variables seminales después de la incubación de los espermatozoides capacitados con heparina y en presencia de GM-CSF 2 nM y de glucosa 5 mM (grupo E) o sólo en presencia del sustrato (grupo C). Se encontraron diferencias significativas (p<0.05) entre el grupo control y el experimental solamente en el VCL. En el cuadro 2 se pueden observar los resultados de las 8 variables seminales analizadas después de la incubación de los espermatozoides capacitados con heparina y en presencia de GM-CSF 2 nM y de fructosa 16 mM (grupo E) o sólo en presencia del sustrato (grupo C). Se encontraron diferencias significativas (p<0.05) entre el grupo control y el experimental en FGF, VCL, DAC, VL y PEA.
Inmunolocalización
de las subunidades ![]() y ß del receptor GM-CSF en espermatozoides
capacitados. La subunidad
y ß del receptor GM-CSF en espermatozoides
capacitados. La subunidad ![]() se inmunolocalizó en el acrosoma y en la cola espermática (figura
3, panel A) como en el caso de espermatozoides eyaculados no capacitados
(panel B), sin embargo es notable que esta subunidad tiene una tendencia más
fuerte a ubicarse hacia la región ecuatorial de la cabeza de los espermatozoides
y con inmunorreacción más evidente en esta zona que los espermatozoides incubados
en un medio sin heparina. Con respecto a la subunidad ß, se constató que no
hay diferencias de inmunolocalización entre los espermatozoides eyaculados
capacitados (figura 3 panel C) y los incubados en un medio
sin heparina (panel D), restringiéndose exclusivamente a la cola espermática.
se inmunolocalizó en el acrosoma y en la cola espermática (figura
3, panel A) como en el caso de espermatozoides eyaculados no capacitados
(panel B), sin embargo es notable que esta subunidad tiene una tendencia más
fuerte a ubicarse hacia la región ecuatorial de la cabeza de los espermatozoides
y con inmunorreacción más evidente en esta zona que los espermatozoides incubados
en un medio sin heparina. Con respecto a la subunidad ß, se constató que no
hay diferencias de inmunolocalización entre los espermatozoides eyaculados
capacitados (figura 3 panel C) y los incubados en un medio
sin heparina (panel D), restringiéndose exclusivamente a la cola espermática.

DISCUSION
Nuestros hallazgos indican
que los espermatozoides bovinos expresan ambas subunidades del receptor de
GM-CSF y que el GM-CSF aumenta algunos parámetros de motilidad espermática.
La subunidad a del receptor GM-CSF muestra variación en su localización
a medida que los espermatozoides recorren las tres porciones del epidídimo.
En los espermatozoides de la cabeza del epidídimo esta subunidad se encuentra
localizada en el acrosoma y en la cola de los espermatozoides (figura
1), mientras que en los espermatozoides extraídos de la cola del epidídimo,
la subunidad ![]() se restringe a la cola en la mayoría de las células. Se desconoce la
importancia biológica de estos cambios de localización proteica, sin embargo,
está bien determinado que la membrana plasmática de los espermatozoides sufre
una reorganización molecular a medida que las células avanzan por el epidídimo
y que, dichos cambios, inducen nuevas propiedades antigénicas (Jones,
1989). En este proceso andrógeno-dependiente es posible que la glicosilación
de la subunidad a en el acrosoma sufra modificaciones a medida que
el espermatozoide avanza por el epidídimo, cambios que probablemente estén
ligados a la adquisición de la motilidad y capacidad fecundante de los espermatozoides
(Fournier- Delpech y Courot, 1987).
se restringe a la cola en la mayoría de las células. Se desconoce la
importancia biológica de estos cambios de localización proteica, sin embargo,
está bien determinado que la membrana plasmática de los espermatozoides sufre
una reorganización molecular a medida que las células avanzan por el epidídimo
y que, dichos cambios, inducen nuevas propiedades antigénicas (Jones,
1989). En este proceso andrógeno-dependiente es posible que la glicosilación
de la subunidad a en el acrosoma sufra modificaciones a medida que
el espermatozoide avanza por el epidídimo, cambios que probablemente estén
ligados a la adquisición de la motilidad y capacidad fecundante de los espermatozoides
(Fournier- Delpech y Courot, 1987).
La inmunocitoquímica realizada en espermatozoides epididimarios y eyaculados mostró que ambas subunidades colocalizan en la cola del espermatozoide y, también determinó, una localización aislada de la subunidad a en el acrosoma del espermatozoide. En los espermatozoides eyaculados la subunidad a tiene una localización evidente en el acrosoma y en la cola (figura 2). Sin embargo, en espermatozoides capacitados en un medio heparinizado se demuestra que la subunidad a tiene una tendencia a regionalizarse en el segmento ecuatorial de la cabeza espermática, siendo la inmunotinción mucho más fuerte y menos difusa que en los espermatozoides no capacitados (figura 3). Estos resultadosconcuerdan con los hallazgos de Lakamp (2000), quien determinó la localización de la proteína de membrana SP47 en el acrosoma en espermatozoides epididimarios (de las tres regiones del órgano), en espermatozoides eyaculados y capacitados. Sin embargo, este autor observó diferencias de intensidad en la fluorescencia en la región apical del espermatozoide y un cambio de localización debido a una variación de la señal por sobre toda la región del acrosoma. Este cambio de señal fue observado principalmente al final del proceso de capacitación, y viceversa durante la maduración espermática que se establece en el epidídimo. Estos hallazgos de cambios de localización de la proteína SP47, concuerdan con el patrón de inmunolocalización y cambio de intensidad que se encontró en este trabajo para la subunidad a del receptor GM-CSF, sugiriendo que ambas proteínas de membrana puedan estar involucradas en el proceso de capacitación espermática.
Zambrano y col. (2001) demostraron que el GM-CSF aumenta el transporte intracelular de la forma oxidada de la vitamina C y de desoxiglucosa (análogo de la glucosa) en los espermatozoides bovinos, posiblemente mediado por los GLUTs presentes en las células espermáticas (Angulo y col., 1998; Concha y Rauch, 1998). Para el caso de este estudio, resulta interesante que la ubicación celular de las isoformas GLUT3, con alta afinidad por la glucosa, y GLUT5 con alta afinidad por la fructosa (Angulo y col, 1998), coincida con la ubicación del receptor del GM-CSF en espermatozoides bovinos, pues la interacción entre ambas proteínas de membrana puede aumentar el metabolismo celular y, por lo tanto, el movimiento espermático.
En lo que respecta a los espermatozoides capacitados, las variables seminales evidenciaron niveles ligeramente superiores con glucosa como sustrato energético. Teniendo en cuenta que la concentración de glucosa en el tracto genital femenino es de aproximadamente 5 mM, concentración que se empleó en esta investigación, es posible que en ese estado fisiológico, el transporte de glucosa sea canalizado a través del GLUT1 o GLUT 2, de los que se sabe transportan glucosa con baja afinidad (Angulo y col., 1998). Situación contraria se observó en espermatozoides eyaculados (Vilanova y col., 2003), sugiriendo una diferencia en el uso de la energía en los distintos estados fisiológicos del espermatozoide. Es posible que en los espermatozoides eyaculados, la fructosa del plasma seminal sea directamente canalizada, mediante el GLUT5 a las mitocondrias ubicadas en la pieza intermedia de los espermatozoides (Grootegoed y Den Boer, 1990).
Al analizar los resultados de las variables seminales evaluadas por computadora, en la mitad de ellas (FGF, VCL, VL y PEA) es evidente que bajo el efecto del GM-CSF los espermatozoides capacitados con un medio con glucosa (5 mM) muestran niveles levemente más elevados (cuadro 1) que al utilizar la fructosa (cuadro 2). Sin embargo, al promediar los resultados obtenidos en las últimas tres horas de incubación sólo se obtuvieron diferencias significativas en la VCL (p<0.05) entre el grupo control (glucosa) y el experimental (glucosa + GM-CSF) (cuadro 1). Por el contrario, al utilizar la fructosa como sustrato energético (cuadro 2) se encuentran diferencias significativas entre el grupo control y el experimental en la mayoría de las variables seminales evaluadas (FGF, VCL, DAC, VL y PEA). Quizás esto sea debido a que si bien los espermatozoides en presencia de glucosa tienden a tener valores más altos que con fructosa, la diferencia de los promedios de las variables seminales de sus grupos controles no es muy evidente (cuadro 1), situación que sí se establece cuando se utiliza la fructosa como sustrato energético (cuadro 2).
Al estudiar el Desplazamiento Angular de la Cabeza (DAC) en espermatozoides no capacitados de ambos toros (Vilanova y col., 2003) se pone en evidencia que es la única variable seminal que en presencia del GM-CSF y bajo el efecto de la fructosa, se obtienen niveles más bajos que en el grupo control. Sin embargo, cuando se utiliza la glucosa no se encuentran diferencias significativas entre el grupo control y el experimental. Esta situación se repite en espermatozoides capacitados (cuadros 1 y 2) aun cuando los niveles de DAC en espermatozoides capacitados son considerablemente inferiores a los niveles en espermatozoides no capacitados, implicando que en este estado el DAC de los espermatozoides es menor. Esta última situación confirma lo descrito por Fournier-Delpech y Thibault (1993), quienes describieron que durante la capacitación ocurren principalmente dos cambios en el movimiento de los espermatozoides: 1. la amplitud del golpe flagelar aumenta debido a una mayor flexibilidad del flagelo y consecuentemente la cabeza espermática oscila ligeramente en oposición del flagelo y 2. cesa la rotación de la cabeza y la progresión espermática comienza a hacerse circular.
En general, los niveles alcanzados por los espermatozoides capacitados en la mayoría de las variables seminales estudiadas (cuadros 1 y 2), son superiores a los encontrados en espermatozoides eyaculados no capacitados (Vilanova y col., 2003), situación que es consistente con un estado de hiperactivación espermática típica de espermatozoides capacitados. Este estado celular refleja un aumento del metabolismo espermático que le permite a los gametos masculinos incrementar la flexibilidad del movimiento para facilitar su desplazamiento en el útero y el oviducto (Suárez y col., 1991), en los pliegues de la mucosa oviductal y sus secreciones (De Mott y Suárez, 1992) y a la vez aumentar las probabilidades de encontrar al ovocito en el lumen del oviducto (Suárez y col., 1983) para permitir la adhesión espermática a la zona pelúcida (Huang y col., 1981) y facilitar la penetración de ésta (Drobnis y col., 1988).
| Results
of 8 seminal variables studied under sperm capacitation conditions from
the third hour of incubation in the presence of 2 nM GM-CSF and 5 mM
glucose (group E), or in the presence of the energy substrate (group
C). |
|
Variable
Seminal |
Grupo
|
Tiempo
de incubación (horas) |
Promedio |
|||||
0 |
1 |
2 |
3 |
4 |
5 |
horas 3, 4
y 5 |
||
FGF (Hz) |
C E |
17.8 (±2.39) |
16.4 (±2.88) |
15.6 (±2.88) |
18.2 (±3.77) 18.6 (±1.95) |
17.2 (±3.11) 19.2 (±2.28) |
19.8 (±0.84) 20.2 (±3.03) |
18.4 19.33 |
VCL (µm/seg) |
C E |
147.8 ±13.8) |
129.6 ±17.4) |
124.4 (±20.0) |
135. (±17.49) 144.2 (±11.1) |
130.4(±16.0) 147.8(±15.1) |
139.6 (±8.5) 145.8 (±14.8) |
135.0 a 145.93 b |
DAC (°) |
C E |
60.4 (±4.16) |
57 (±2.55) |
57.8 (±5.40) |
50 (±8.75) 52 (±5.34) |
50.6 (±5.46) 48 (±5.43) |
43.2 (±4.15) 46.6 (±4.04) |
47.93 48.86 |
MP (%) |
C E |
80 (±4.24) |
76.6 (±7.16) |
72.2 (±3.77) |
76.8 (±8.47) 72.8 (±6.38) |
74.8 (±7.53) 75.4 (±5.13) |
79 (±3.32) 79.2 (±5.89) |
76.86 75.8 |
DALC
µm) |
C E |
6.4 (±0.89) |
5.2 (± 0.45) |
5.2 (±0.84) |
4.8 (±0.84) 4.6 (±0.55) |
4.6 (±0.55) 4.8 (±0.84) |
4 (±0.00) 4.6 (±0.55) |
4.46 4.66 |
VL
µm/seg) |
C E |
74.8 (±10.35) |
69.6 (±12.1) |
64 (±15.57) |
76.8 (±14.7) 80.6 (±10.6) |
75 (±12.67) 83.4 (±12.1) |
85 (±3.74) 83.8 (±11.82) |
78.9 82.6 |
LIN
(%) |
C E |
44.8 (±3.90) |
44.2 (±4.76) |
40.4 (±5.41) |
46.6 (±7.30) 46 (±5.24) |
46.4 (±6.27) 47.8 (±4.60) |
52 (±2.45) 50 (±4.95) |
48.33 47.93 |
PEA
(%) |
E C |
70.2 (±7.29) |
58.8 (±12.5) |
54.8 (±13.8) |
64.6 (±13.2) 67.6 (±5.50) |
63.6 (±12.9) 72 (±6.32) |
73 (±4.36) 75.6 (±9.86) |
67.06 71.73 |
C: Grupo control; E: Grupo
experimental (GM-CSF). Los resultados se presentan como el promedio ± D.E.
de cinco réplicas. Superíndices (a y b) entre grupos C y E: P<0.05
C: Control group; E: experimental group (GM-CSF). Results are presented as
mean ± S.E.M. from five replicates. Superscripts (a, b) between groups C and
E: P<0.05.
| Results
of 8 seminal variables studied under sperm capacitation conditions from
the third hour of incubation in the presence of 2 nM GM-CSF and 16 mM
fructose (group E), or in the presence of the energy substrate (group
C). |
|
| Variable Seminal |
Grupo |
Tiempo
de incubación (horas) |
Promedio
horas 3, 4 y
5 |
|||||
0 |
1 |
2 |
3 |
4 |
5 |
|||
| FGF
(Hz) |
C E |
16.6
(±0.55) |
17.6
(±3.05) |
17
(±3.81) |
15.8
(±3.56) 18.4 (±4.83) |
17.2
(±3.77) 19.2 (±2.17) |
14.6
(±2.07) 18.2 (±1.92) |
15.86
a 18.8 b |
| VCL (µm/seg) |
C E |
148.8
±4.38) |
140.6
±20.3) |
135.6
(±20.3) |
130
(±18.26) 142.2 (±30.8) |
130.6
(±22.2) 144.2 (±15.1) |
113.4
(±17.3) 139.2 (±12.2) |
124.66
a 141.86 b |
DAC (°) |
C E |
66 (±2.12) |
53.4 (±7.57) |
56.6 (±12.01) |
55.2 (±8.23) 51 (±6.96) |
54 (±8.75) 48.6 (±3.13) |
59.2 (±6.34) 48 (±4.06) |
56.13 a 49.2 b |
MP (%) |
C E |
79.4 (±1.16) |
77.6 (±5.9) |
77.4 (±5.77) |
72.2 (±7.12) 73.6 (±10.9) |
74.2 (±7.16) 72.2 (±6.14) |
65.8 (±7.92) 76.4(±3.85) |
70.73 74.06 |
DALC
(µm) |
C E |
7.2 (±0.45) |
5.8 (±1.10) |
5.8 (±1.48) |
5 (±1,41) 4.6 (±1.14) |
4.2 (±0.45) 3.8 (±0.84) |
3.8 (±1.30) 4.4 (±0.55) |
4.33 4.26 |
VL µm/seg) |
C E |
72.4 (±3.21) |
76.2 (±18.7) |
72 (±19.43) |
69.8 (±12.9) 80.2 (±22.8) |
73 (±18.38) 81.8 (±14.1) |
57.4 (±13.0) 79 (±10.46) |
66.73 a 80.33 b |
| LIN (%) |
C E |
42.2 (±1.30) |
46.2 (±6.14) |
44 (±8.80) |
42 (±6.04) 46.2 (±8.53) |
44.8 (±6.87) 45.6 (±5.94) |
39.4 (±4.83) 48 (±3.74) |
42.06 46.6 |
PEA (%) |
C E |
63.2 (±3.83) |
6.32 (±11.9) |
58.2 (±16.9) |
57.6 (±12.6) 67.6 (±15.7) |
63.4 (±14.1) 68.2 (±7.50) |
53.4 (±9.29) 69.4 (±8.05) |
58.13 a 68.4 b |
C: Grupo control; E: Grupo
experimental (GM-CSF). Los resultados se presentan como el promedio ± D.E.
de cinco réplicas. Superíndices (a y b) entre grupos C y E: P<0.05.
C: Control group; E: experimental group (GM-CSF). Results are presented as
mean ± S.E.M. from five replicates. Superscripts (a, b) between groups C and
E: P<0.05.
AGRADECIMIENTOS
Los autores agradecen al Dr. José F. Cox y colaboradores de la Facultad de Medicina Veterinaria de la Universidad de Concepción por sus consejos y el uso del analizador Hobson Sperm Tracker.
BIBLIOGRAFIA
ANGULO, C., M.C. RAUCH, A. DROPPELMANN, A. REYES, J.C. SLEBE, F. DELGADO-LÓPEZ, V. GUAIQUIL, J.C. VERA, I.I. CONCHA. 1998. Hexose transporter expression and function in mammalian spermatozoa. Cellular localization and transport of hexoses and vitamin C. J. Cell. Biochem. 71: 189-203.
BALDWIN, G.C., J.C. GASSON, S.E. KAUFMAN, S.G. QUAN, R.E. WILLIAMS, B.R. AVALOS, A.F. GAZDAR, D.W. GOLDE, J.F. DIPERSIO. 1989. Nonhematopoietic tumor cells express functional GM-CSF receptors. Blood 73: 1033- 1037.
BALDWIN, G., E. BENVENISTE, G. CHUNG, J. GASSON, D. GOLDE. 1993. Identification and characterization of a high-affinity granulocytemacrophage colony-stimulating factor receptor on primary rat oligodendrocytes. Blood 82: 3279-3282.
BUSSOLINO, F., J. WANG, P. DEFILIPPI, F. TURRINI, F. SANAVIO, C. EDGELL, M. AGLIETA, P. ARESE, A. MANTOVANI. 1989. Granulocyte-macrophage colony-stimulating factor induces human endothelial cells to migrate and proliferate. Nature 337: 471-473.
CONCHA, I. I., F. VELASQUEZ, J. MARTINEZ, C. ANGULO, A. DROPPELMANN, A. REYES, J.C. SLEBE, J.C. VERA, D.W. GOLDE. 1997. Human erythrocytes express GLUT5 and transport fructose. Blood 89: 4190-4195
CONCHA, I. I., M.C. RAUCH. 1998. Transporte de vitamina C en espermatozoides de bovino. Arch. Med. Vet. 30: 125-126.
DeMOTT, R., S. SUAREZ. 1992. Hyperactivated sperm progress in the mouse oviduct. Biol. Reprod. 46: 779-785.
DROBNIS, E., A. YUDIN, G. CHERR, D. KATZ. 1988. Hamster sperm penetration of the zona pellucida: kinematic analysis and mechanical implications. Dev. Biol. 130: 311-323.
FOURNIER-DELPECH, S., M. COUROT. 1987. Sperm zona pellucida binding activity. Oxford Rev. Reprod. Biol. 9: 294-321. Citado por Fournier-Delpech, S., C. Thibault. 1993. Acquisition of sperm fertilizing ability - Epididymal maturation, accessory glands and capacitation. En: Thibault, C., M-C. Levasseur, R.H.F. Hunter (eds.) Reproduction in mammals and man. Ellipses. Paris. pp. 257-279.
FOURNIER-DELPECH, S., C. THIBAULT. 1993. Acquisition of sperm fertilizing ability: Epididymal maturation, accessory glands and capacitation. En: Thibault, C., M-C. Levasseur, R.H.F. Hunter (Eds.) Reproduction in Mammals and Man. Ellipses. Paris. pp. 257-279.
GASSON, J. 1991. Molecular physiology of granulocyte-macrophage colony-stimulating factor. Blood 77: 1131-1145.
GEARING, D., J. KING, N. GOUGH, N. NICOLA. 1989. Expression cloning of a receptor for a human granulocyte-macrophage colonystimulating factor. EMBO J. 8: 3667-3676.
GILCHRIST, R.B., D. ROWE, L. RITTER, S. ROBERTSON, R. NORMAN, D. ARMSTRONG. 2000. Effect of granulocyte-macrophage colonystimulating factor deficiency on ovarian cell function. J. Reprod. Fertil. 120: 283-292.
GROOTEGOED, J., P. Den BOER. 1990. Energy metabolism of spermatids: a review. En Hamilton D.W., Waites GMH Eds.: Scientific basis for fertility regulation. Cellular and molecular events in spermiogenesis. Cambridge.
HAYASHIDA, K., T. KITAMURA, D. GORMAN, K. ARAI, T. YOKOTA, A. MIYAJIMA. 1990. Molecular cloning of a second subunit of the receptor for human granulocyte- macrophage colony stimulating factor (GM-CSF): Reconstitution of a high-affinity GM-CSF receptor. Proc. Natl. Acad. Sci. USA 87: 9655-9659.
HUANG, T., A. FLEMING, R. YANAGIMACHI. 1981. Only acrosome-reacted spermatozoa can bind to and penetration zonae pellucidae: a study using the guinea pig. J. Exper. Zool. 217: 287-290.
JASPER, M., M. BRANNSTROM, J. OLOFSSON, O. PETRUCCO, H. MASON, S. ROBERTSON, R. NORMAN. 1996. Granulocyte-macrophage colony-stimulating factor: presence in human follicular fluid, protein secretion and mRNA expression by ovarian cells. Mol. Hum. Reprod. 2: 555-562.
JONES, R. 1989. Membrane remodelling during sperm maturation in the epididymis. Oxford Rev. Reprod. Biol. 11: 285-337. Citado por Fournier- Delpech S., C.
LAKAMP. A. 2000. Functional characterization of sperm protein SP47. En Funktionelle Charakterisierung des Spermienproteins. pp 145.
MENDOZA, C., N. CREMADES, E. RUIZ, F. MARTINEZ, E. ORTEGA, S. BERNABEU, J. TESARIK. 1999. Relationship between fertilization results after intracytoplasmic sperm injection, and intrafollicular steroid, pituitary hormone and cytokine concentrations. Hum. Reprod. 14: 628-635.
SUAREZ, S., D. KATZ, J. OVERSTREET. 1983. Movement characteristics and acrosomal status of rabbit spermatozoa recovered at the site and time of fertilization. Biol. Reprod. 29: 1277-1287.
SUAREZ, S., D. KATZ, D. OWEN, J. ANDREW, R. POWELL. 1991. Evidence for the function of hyperactivated motility in sperm. Biol. Reprod. 44: 375-381.
VERA, J.C., F.V. VELAZQUEZ, R.H. ZHANG, I.I. CONCHA, D.W. GOLDE. 1995. Resolution of the facilitated transport of dehydroascorbic acid from its reduction-dependent intracellular accumulation. J. Biol. Chem. 270: 23706-23712.
VILANOVA, L.T., M.C. RAUCH, A. MANSILLA, A. ZAMBRANO, M. BRITO, E. WERNER, V. ALFARO, J.F. COX, I.I. CONCHA. 2003. Expression of GM-CSF in male germ cells: GMCSF enhances sperm motility. Theriogenology 60:1083-1095.
ZAMBRANO, A., C. NOLI, M.C. RAUCH, E. WERNER, M. BRITO, R. AMTHAUER, J.C. SLEBE, J.C. VERA, I.I. CONCHA. 2001. Expression of GM-CSF receptors in male germ cells and their role in signaling for increased glucose and vitamin C transport. J. Cell. Biochem. 80: 625-634.
ZHAO, Y., H. RONG, N. CHEGINI. 1994. Human fallopian tube expresses granulocyte-macrophage colony stimulating factor (GM-CSF) and GMCSF alpha and beta receptors and contain immunoreactive GM-CSF protein. J. Clin. Endocrinol. Metab. 79: 662-665.
ZHAO, Y.,
H. RONG, N. CHEGINI. 1995. Expression and selective cellular localization
of granulocyte-macrophage colony-stimulating factor (GM-CSF) ![]() and ß receptor messenger ribonucleic acid and protein in human ovarian tissue.
Biol. Reprod. 53: 923-930.
and ß receptor messenger ribonucleic acid and protein in human ovarian tissue.
Biol. Reprod. 53: 923-930.
Aceptado: 09.09.2003.