Arch. Med. Vet., Vol. XXXV, N° 2, 2003, pp. 151-158
ARTICULOS ORIGINALES
Secreción pulsátil diurna de la hormona foliculo estimulante (FSH) en ovejas prepúberes con y sin restriccion alimenticia*
Pulsatile follicle stimulating hormone (FSH) secretion in prepubertal female sheep with and without food restriction
S. E. RECABARREN, Biol., M.Sc.; A. LOBOS, M.V., Mg.S.; O. POBLETE, M.V.; P. MUÑOZ, J. PARILO, Ing. Agr.
*Financiado por
el proyecto FONDECYT 1990389.
Laboratorio de Fisiología y Endocrinología Animal,
Facultad de Medicina Veterinaria, Universidad de Concepción, Campus Chillán
Summary
Food restriction delays the onset of puberty due to a low secretion of LH and probably the FSH as well. The objective of this work was to assess and to compare the diurnal pulsatile secretion of FSH in normal growing and in growth-retarded ewe lambs due to food restriction. Five Suffolk ewe lambs were fed at 2% of their body weight in two daily rations whereas the other 5 were fed ad-libitum from 20 and until 30 weeks of age and served as a control group. A FSH pulsatile study was conducted, before and after six and ten weeks of food restriction corresponding to 20, 26 and 30 weeks of age respectively. The FSH pulsatile study consisted in collecting blood samples every 10 minutes for 5 hours from 10 AM onwards. In the obtained plasma the FSH was measured by RIA. The characteristics of the pulsatile FSH secretion were assessed using the CLUSTER program. Data obtained from the CLUSTER program were analyzed with analysis of variance for repeated measures. Mean plasma FSH concentrations (ng/mL/5h) increased in almost 50% in control ewe lambs between 20 and 30 weeks of age but without statistical difference. At 30 weeks of age, control lambs had a 50% higher mean plasma FSH concentrations and mean FSH pulse amplitude than food-restricted lambs. FSH pulse frequency did not show any difference between ages within a group or between groups. Results suggest that food restriction has a partial suppressor effect on the FSH secretion. The delay on the onset of puberty due to food-restriction in the ewe lamb could be attributed more to an insufficient LH secretion GnRH-stimulated than to an inadequate FSH secretion.
Key words: FSH, lambs, puberty, food restriction.
Resumen
La restricción alimenticia retarda el inicio de la pubertad, producto de una disminución de la secreción pulsátil de LH y probablemente de FSH. El objetivo del presente trabajo fue conocer y comparar la secreción pulsátil diurna de FSH entre borregas con crecimiento normal y con crecimiento retrasado, producido por la restricción alimenticia. Cinco borregas Suffolk se alimentaron al 2% de su peso corporal con alimento concentrado en dos raciones diarias, mientras que otras 5 se alimentaron a voluntad a partir de las 20 y hasta las 30 semanas de edad. A las 20, 26 y 30 semanas de edad, se realizó un estudio de pulsatilidad de FSH. Este estudio consistió en la colección de muestras de sangre cada 10 minutos desde las 10 AM, por cinco horas, en cuyo plasma se midió FSH por RIA . Las características de la secreción pulsátil durante las cinco horas del estudio se reconocieron por medio del programa computacional CLUSTER. Los datos se analizaron con Andeva para muestras repetidas. Las concentraciones plasmáticas promedio (ng/ mL/5h) aumentaron en alrededor de un 50% en las borregas controles, entre las 20 y 30 semanas de edad, pero sin significancia estadística. A las 30 semanas de edad, las borregas controles tenían una concentración promedio de FSH plasmática y una amplitud de pulsos un 50% más alta que en las borregas con restricción alimenticia. La secreción de FSH no aumentó estadísticamente entre las 20 y 30 semanas de edad en las borregas controles, mientras que tendió a disminuir en las borregas con restricción alimenticia. La frecuencia de pulsos de FSH no mostró diferencias entre las edades o entre los grupos. Los resultados sugieren que la restricción alimenticia tiene un efecto supresor parcial sobre la secreción de FSH durante el desarrollo prepuberal de la borrega. El retraso en el inicio de la pubertad, debido a restricción alimenticia en la borrega, se podría atribuir más bien a una insuficiente secreción de LH que a una deficiencia en la secreción de FSH.
Palabras claves: FSH, borregas, pubertad, restricción alimenticia.
INTRODUCCION
Los factores que regulan el inicio de la pubertad en la hembra de los mamíferos son complejos. Se ha propuesto que la información sobre el estado metabólico de la hembra en crecimiento se capta mediante sensores ubicados en el sistema nervioso central y transmitidos hacia las neuronas que controlan la secreción de hormona liberadora de gonadotropinas (GnRH) (Steiner y col., 1983; Wade y col., 1996). Estas señales de carácter hormonal y/o químicas regularían el patrón de secreción de GnRH mediante su acción sobre circuitos neuroendocrinos que incluyen entre otros a opioides, neuropéptido Y, catecolaminas y galanina (Kalra y Kalra, 1996). La deficiencia en la cantidad de energía disponible para la hembra en crecimiento tiene como consecuencia un retraso en el inicio de la pubertad, la cual se produciría como consecuencia del efecto sobre la secreción de GnRH. Algunas estrategias experimentales usadas para reconocer los efectos y mecanismos por los cuales la hembra reconoce el estado metabólico y su consecuencia sobre la secreción de GnRH/LH son el ayuno y la restricción alimenticia. En la primera, se evita completamente la alimentación. En la segunda alternativa, la cantidad de alimento a entregar es variable, según el objetivo del trabajo, desde una cantidad que permita la mantención del peso corporal o una cantidad que permita una tasa de crecimiento o ganancia de peso a determinados porcentajes del que presenta normalmente la hembra en crecimiento. La medición de GnRH en la sangre portal hipotálamica hipofisiaria en condiciones de restricción alimenticia ha permitido comprobar que el efecto de la restricción alimenticia sobre el eje gonadal en parte se explica por una disminución en la secreción de GnRH (I'Anson y col., 2000) y no dependería de una disminución de la sensibilidad hipofisiaria a la GnRH o de una hiperactividad del eje adrenal producida por estrés (Cameron y col., 1991; Schreihofer y col., 1993; I´Anson y col., 1994, Recabarren y col., 1999). Por lo tanto, si se considera que la restricción alimenticia resulta en una menor secreción de GnRH y que esta neurohormona hipotalámica estimula tanto la secreción de LH como de FSH, es posible hipotetizar que la menor secreción de GnRH en condiciones de bajo aporte alimenticio también debería reflejarse en una menor secreción pulsátil de FSH.
El objetivo del presente trabajo fue reconocer las características de la secreción pulsátil diurna de FSH en ovejas prepúberes con alimentación restringida por 6 a 10 semanas y compararlas con la secreción de FSH exhibidas por borregas sin restricción alimenticia de las mismas edades.
MATERIAL Y METODOS
Manejo general de las ovejas prepúberes. Se utilizaron 10 borregas de raza Suffolk provenientes de la Unidad de Producción Ovina de la Facultad de Agronomía de la Universidad de Concepción, nacidas a fines de agosto y destetadas a los 3 meses de edad. A su llegada a la Facultad de Medicina Veterinaria se alimentaron con pradera y alimento concentrado peletizado (Novillina Champion®). A las 20 semanas de edad, las borregas se separaron al azar en 2 grupos: un grupo control y uno experimental. Con el fin de controlar la alimentación, las borregas se mantuvieron estabuladas y recibieron solo alimento concentrado. Las borregas del grupo control (n=5) recibieron alimento a voluntad, mientras que las borregas del grupo experimental (n=5) recibieron alimento concentrado en cantidad equivalente al 2% del peso corporal. Ambos grupos recibieron dos raciones al día. Con este esquema de alimentación se buscó mantener el peso en las borregas del grupo experimental durante el período de restricción alimenticia. Tres días antes de los estudios de pulsatilidad de FSH, las borregas se trasladaron a la sala de experimentación, donde se colocaron en bretes individuales, manteniéndose el régimen de alimentación y con libre acceso a agua. Las borregas se cateterizaron en la vena yugular de acuerdo al procedimiento descrito por Recabarren y col. (1995). Se procedió a realizar muestreos sanguíneos de acostumbramiento siguiendo el mismo protocolo del estudio de pulsatilidad por una hora, dos veces al día, el día anterior al inicio del experimento, con el fin de minimizar los riesgos de estrés.
Estudio de pulsatilidad de FSH. El estudio de pulsatilidad de FSH consistió en la colección de muestras de sangre (3 mL) por medio del catéter yugular implantado previamente, a intervalos de 10 minutos por un período de 5 horas (10:00- 15:00 horas) a las 20, 26 y 30 semanas de edad, después de 0. 6 y 10 semanas de restricción alimenticia del grupo experimental. Las muestras de sangre se depositaron en tubos heparinizados (10 UI de heparina/mL de sangre), se centrifugaron a 1000 x g, por 15 minutos, el plasma se separó y se congeló a -20°C, hasta el posterior análisis de las concentraciones plasmáticas de FSH por radioinmunoensayo (RIA).
Radioinmunoensayo de FSH. El radioimmunoensayo de FSH se realizó con materiales provenientes de la NIADDK (USA) siguiendo el protocolo indicado con los materiales. Brevemente, se incubaron 200 µl de FSH ovina standard (oFSHRP) en un rango de 0.02 a 25.6 ng/tubo o 200 µl de muestra desconocida, con 100 µL de FSH iodada (oFSH I-1 AFP 5679 C) y 100 µL de antisuero contra FSH ovina (AFP C 5228113) por 24 horas a temperatura ambiente. Luego, se agregaron 100 µL de segundo anticuerpo y se continuó la incubación por 48 horas. Posteriormente, los tubos se centrifugaron a 1000 x g por 40 min a 4° C, se descartó el sobrenadante y se cuantificó el pellet en un gammaespectrómetro LKB. La concentración mínina detectable correspondiente al 90% del buffer control fue de 0.2 ng/mL., con un coeficiente de variación intraensayo de 6% e interensayo de 10%.
Determinación de las características de la secreción pulsátil de FSH. Las concentraciones plasmáticas de FSH de cada oveja se analizaron en forma individual usando el programa computacional CLUSTER, desarrollado por Veldhuis y Johnson (1986). Este programa permite identificar, mediante un algoritmo reiterativo, las fluctuaciones hormonales definidas como pulsos en una serie consecutiva de muestras, utilizando como parámetro de identificación el coeficiente de variación del RIA, la frecuencia de muestreo, la forma definida del pulso asignada por el operador (usando 1 o más puntos para el "peak" y uno o más puntos para el nadir), y las diferencias estadísticas entre puntos. El programa además identifica la amplitud media de los pulsos, el intervalo entre pulsos, la duración de los pulsos y el nadir (promedio de las concentraciones plasmáticas entre los pulsos). Para la identificación de los pulsos de FSH se escogió una forma de pulso de 3x3 para definir el máximo y el mínimo respectivamente con un test de t de 2.75 (Veldhuis y Johnson, 1986). Con este procedimiento las probabilidades de identificar un pulso falso positivo fue menor de 5%.
Análisis estadístico. Los parámetros de la secreción pulsátil de FSH: promedio transversal del período (ng/mL/5h), frecuencia de pulsos (número de pulsos/5h), amplitud de los pulsos (ng/mL) y nadir (ng/mL) presentes a las 20, 26 y 30 semanas se analizaron en un mismo grupo mediante análisis de varianza para muestras repetidas en un diseño de bloques, con comparación entre los promedios con el test de Newman Keuls utilizando el programa estadístico GB.Stat v.6. Los datos se muestran como promedio ± error estándar. Se consideró un P<0.05 como una diferencia estadísticamente significativa.
RESULTADOS
En el cuadro 1 se entregan los resultados del estudio de pulsatilidad de FSH en las borregas controles y en las borregas con restricción alimenticia. El promedio transversal de la concentración de FSH (ng/mL/5h) aumentó cerca de un 50% entre las 20 y las 30 semanas de edad en el grupo de borregas controles (P>0.05). En cambio, en las borregas sometidas a restricción alimenticia se observó una tendencia a disminuir entre las 20 y las 30 semanas de edad, al cabo de 10 semanas de restricción. La concentración plasmática promedio de FSH (ng/mL/5h) en el grupo de borregas experimentales fue menor en más de un 50% en comparación con las concentraciones plasmáticas de FSH de las borregas controles (P>0.05).
Como se muestra en el cuadro 1, la frecuencia de los pulsos de FSH no presentó diferencias estadísticas entre las edades en un mismo grupo ni entre los grupos. La amplitud de los pulsos de FSH tendió a aumentar entre las 20 y 30 semanas de edad en el grupo control, con una disminución mayor de un 50% en las borregas con alimentación restringida entre las 20 y 30 semanas de edad (P>0.05). La amplitud de los pulsos tendió a ser menor en las borregas con restricción alimenticia que en el grupo control a las 30 semanas de edad (P=0.079), luego de 10 semanas de restricción alimenticia.
El nadir disminuyó en un 50% luego de 10 semanas de restricción alimenticia en las borregas con restricción alimenticia, pero sin significancia estadística entre las edades ni entre los dos grupos de borregas.
| Characteristics
of the FSH secretion in normal fed and in food-restricted ewe lambs
at 20, 26 and 30 weeks of age (n=5, mean ± s.e.m.). |
|
| EDAD | PRO |
FRE |
AMP |
NA |
| Borregas
Controles Control ewe lambs Semana 20 Semana 26 Semana 30 |
2.49
± 0.4 2.44 ± 0.6 3.68 ± 1.1 |
2.20
± 0.4 2.44 ± 0.6 2.20 ± 0.2 |
4.24
± 1.1 6.25 ± 2.0 6.14 ± 1.5 |
2.12±
0.5 1.52 ± 0.5 1.82 ± 0.7 |
| Borregas
con Restricción alimenticia Food-restricted ewe lambs Semana 20 Semana 26 Semana 30 |
2.41
± 0.6 2.29 ± 0.2 1.56 ± 0.2 |
1.80
± 0.4 1.40 ± 0.2 2.00 ± 0.3 |
5.09
± 1.8 4.43 ± 1.2 2.34 ± 0.3 |
1.70±
0.6 1.22 ± 0.4 0.96 ± 0.3 |
| PRO: Promedio: concentración de FSH (ng/mL) FRE: Frecuencia: numero de pulsos (n° pulsos/5h) AMP: Amplitud: de los pulsos (ng/mL) NA: Nadir: promedio entre pulsos (ng/mL) |
Con relación a los perfiles de las concentraciones plasmáticas de FSH de cada borrega, en las borregas controles, a las 30 semanas de edad, con excepción de una borrega, se observa que la secreción pulsátil de FSH se ha acentuado con respecto a las 20 y 26 semanas de edad (figura 1). Por el contrario, en las borregas con alimentación restringida, la pulsatilidad de la secreción de FSH está disminuida en comparación con las borregas controles de la misma edad (figura 2).
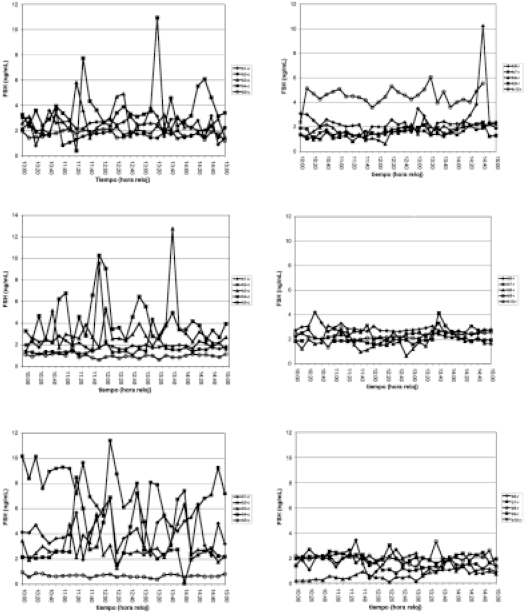
| Individual
profiles of plasma FSH concentrations in control ewe lambs at 20 (upper
panel), 26 (middle panel) and 30 (lower panel) weeks of age. |
Individual profiles
of plasma FSH concentrations in food-restricted ewe lambs at 20 (upper
panel), 26 (middle panel) and 30 (lower panel) weeks of age, after 0,
6 and 10 weeks of food restriction respectively. |
DISCUSION
Se ha postulado que la restricción alimenticia retrasa el inicio de la pubertad en borregas, lo cual se debería a una menor secreción de GnRH, asociada a una menor secreción de LH. El objetivo de este estudio fue reconocer si la restricción alimenticia podría influir también en la secreción de FSH, teniendo presente que la FSH así como la LH se secreta desde la hipófisis en respuesta a la GnRH.
Los resultados obtenidos en el presente estudio muestran que las concentraciones plasmáticas promedio, la frecuencia, la amplitud de los pulsos y el nadir de FSH tienden a aumentar entre las 20 y 30 semanas de edad en las borregas controles. Estos resultados concuerdan con los obtenidos por Padmanabhan y col. (1992), quienes encontraron que la concentración plasmática de FSH immunoreactiva de borregas prepúberes y púberes no presenta diferencias, aunque la FSH bioactiva aumenta. Estos autores demostraron también que en las hembras púberes hubo un aumento de la inhibina y del estradiol plasmático (Padmanabhan y col., 1992). En contraste con lo observado en las borregas controles, en las borregas con restricción alimenticia la concentración promedio y la amplitud de los pulsos de FSH tienden a disminuir entre las 20 y las 30 semanas de edad, luego de 10 semanas de restricción alimenticia, aunque sin cambios en la frecuencia de pulsos de FSH. Estos resultados concuerdan también con la demostración que la restricción proteica durante el desarrollo prepuberal de ovejas tampoco influye en la síntesis de FSH, pero sí lo hace sobre la síntesis de LH (Polkowska y col., 2003). Estos resultados sugieren que la restricción alimenticia tendría un efecto supresor parcial sobre la secreción de FSH, de tal forma que el retraso en el inicio de los ciclos estrales en borregas con restricción alimenticia sería consecuencia de otros mecanismos en los cuales no estaría comprometida la secreción de FSH, y si lo fuese, la FSH no sería un factor determinante en este fenómeno.
Los resultados del presente trabajo concuerdan con los descritos en un estudio realizado en vaquillas con restricción alimenticia. En este estudio se encontró que las vaquillas exhibieron menor secreción de LH como consecuencia de una disminución en la producción y secreción de GnRH, pero sin cambios en la secreción de FSH (Viscarra y col., 1997). Para estos investigadores, la FSH no es esencial en los eventos que conducen al inicio de la reproducción en la vaca, ya que sus concentraciones plasmáticas no se modificaron con la restricción alimenticia. Es posible entonces que en la borrega ocurra algo similar a lo descrito en vaquillas, ya que en un estudio complementario al presente trabajo, en el cual se midió la concentración plasmática de LH (Recabarren y col., 2001), se demostró que la restricción alimenticia postergó el inicio de la pubertad acompañada con una disminución significativa en la secreción de LH. Este concepto es respaldado por el hecho de que en las borregas controles hubo una tendencia a que la secreción de FSH aumentara entre las 20 y 30 semanas de edad. Por consiguiente, estos datos colectivamente sugieren que la secreción de LH es más decisiva en los eventos que anteceden a la pubertad, independiente del hecho de que ambas gonadotropinas dependen de la GnRH para su secreción. Una situación similar se ha reconocido en machos. En carneros Merino adultos castrados con sustitución de testosterona y de inhibina, alimentados a la mitad de una dieta de mantención, no mostraron diferencias en la secreción de FSH con respecto a machos alimentados con dieta de mantención (Tjondronegoro y col., 1996), resultados que confirman la hipótesis de que la nutrición ejerce escasa influencia sobre la secreción de FSH.
De acuerdo a los estudios de Wildt y col. (1981), la frecuencia de pulsos de GnRH determina el tipo de gonadotropina que secreta la hipófisis. Altas frecuencias de pulsos de GnRH favorecen la secreción de LH y reducen la secreción de FSH, mientras que bajas frecuencias de pulsos de GnRH disminuyen la secreción de LH, pero facilitan la secreción de FSH. En el presente estudio, es posible suponer que la restricción alimenticia disminuyó la secreción pulsátil de GnRH. Esto es posible deducirlo por medio del análisis de las características de la secreción pulsátil de LH, ya que hay una estrecha asociación entre la secreción de GnRH y LH. Sin embargo, en el estudio paralelo a éste y que se ocupó del análisis de la secreción de LH (e indirectamente de la secreción de GnRH por la estrecha dependencia entre ambas hormonas) en borregas con restricción alimenticia, no se observaron cambios en la frecuencia de pulsos de LH, por lo que se puede asumir que la frecuencia de pulsos de GnRH no se modificó, pero sí hubo una disminución significativa en la concentración plasmática de LH y en la amplitud de los pulsos. Esto podría explicar en parte la parcialidad del efecto de la restricción alimenticia sobre la secreción de FSH, ya que si hubiese habido una disminución en la frecuencia de los pulsos de GnRH, debería haber aumentado la secreción de FSH. Es posible entonces suponer que la restricción alimenticia podría estar influyendo en la secreción de FSH mediante otros mecanismos no dependientes de la GnRH.
Otros importantes reguladores de la secreción de FSH en hembras son las inhibinas, activinas y foliculostatinas (Welt, 2002). Se desconoce si en la oveja prepúber la restricción alimenticia podría influir en la secreción de inhibina, o en la concentración de activinas o en la actividad de la foliculostatina lo que podría explicar la disminución en las concentraciones plasmáticas de FSH. Se ha demostrado que ovejas Merino delgadas tienen mayor cantidad de inhibina en los ovarios que ovejas obesas (Boukhliq y col., 1996), por lo que se podría especular que las borregas con bajo peso corporal, producto de la restricción alimenticia, podrían sintetizar y secretar mayores cantidades de inhibina que las borregas con crecimiento normal y contribuir al control de la secreción de FSH. En carneros, alimentados con la mitad de la dieta de mantención, la administración de líquido folicular bovino disminuyó en mayor proporción la FSH plasmática que en carneros alimentados con el doble de la dieta de mantención (Tjondronegoro y col., 1996), lo que sugeriría que los carneros sub-alimentados serían más sensibles al efecto inhibidor de la inhibina. Sin embargo, el efecto de la sub-alimentación sobre la producción de inhibina en borregas tampoco sería muy destacable, de lo contrario se debería haber observado una importante disminución de la secreción de FSH al sumarse los efectos hipotalámicos y los de origen ovárico sobre la secreción de FSH.
En resumen, las concentraciones plasmáticas de FSH no aumentan significativamente entre las 20 y 30 semanas de edad en borregas con un régimen de alimentación normal, mientras que en borregas con restricción alimenticia la FSH plasmática tiende a disminuir. Los resultados sugieren que la restricción alimenticia tendría un efecto supresor parcial sobre la secreción de FSH, de tal forma que el retraso en el inicio de los ciclos estrales en borregas con restricción alimenticia sería consecuencia de otros mecanismos en los cuales no estaría comprometida la secreción de FSH, o si lo fuese, la FSH no sería un determinante en este fenómeno.
AGRADECIMIENTOS
Los autores agradecen a la NIADDK y al Dr A. Parlow por su generosa entrega de reactivos para el RIA de FSH. Al Dr José Cox por facilitarnos la sala de experimentación.
REFERENCIAS
BOUKHLIQ, R., N. R. ADAMS, G. B. MARTIN. 1996. Effect of nutrition on the balance of production of ovarian and pituitary hormones in ewes. Anim. Reprod. Sci. 45: 59-70.
CAMERON, J. L., T. E. WELTZIN, C. MC CONAHA, D. L. HELMREICH, W. H. KAYE. 1991. Slowing of pulsatile luteinizing hormone secretion in men after forty-eight hours of fasting. J. Clin. Endocrinol. Metab. 73: 35-41.
I'ANSON, H., E. H. QUINT, R. I. WOOD, B.C. ENGLAND, D. L. FOSTER. 1994. Adrenal axis and hipogonadotropism in the growth-restricted female lamb. Biol. Reprod. 50: 137-143.
I'ANSON, H., J. M. MANNING, C. G.HERBOSA, J. PELT, C. R. FRIEDMAN, R. I. WOOD, D. C. BUCHOLTZ, D. L. FOSTER. 2000. Central inhibition of gonadotropin-releasing hormone secretion in the growth-restricted hypogonadotropic female sheep. Endocrinology 141: 520-527.
KALRA, S. P., P. S. KALRA, 1996. Nutritional infertility: The role of the interconnected hypothalamic neuropeptide Y-galanin-opioid network. Front. Neuroendocrinol. 17: 371-401.
PADMANABHAN, V., C. D. MIEHER, M. BORONDY, H. I'ANSON, R. I. WOOD, T.D.LANDEFELD, D. L. FOSTER, I. Z. BEITINS. 1992. Circulating bioactive folliclestimulating hormone and less acidic folliclestimulating hormone isoforms increase during experimental induction of puberty in the female lamb. Endocrinology 131: 213-220.
POLKOWSKA J, Y. LERRANT, M. WANKOWSKA, A. WOJCIK-GLADYSZ, A. STARZEC, R. COUNIS. 2003. The effect of dietary protein restriction on the secretion of LH and FSH in pre-pubertal female lambs. Anim. Reprod. Sci. 76: 53-66.
RECABARREN, S. E., A. URRUCELQUI, M. ROBBIANO, A. LOBOS, P. ORELLANA, J. PARILO. 1995. Efecto de la infusión endovenosa de L-Arginina y L-Ornitina sobre la secreción de hormona del crecimiento en ovejas prepúberes. Arch. Med. Vet. 28: 99-103.
RECABARREN, S. E., A. LOBOS, E., ABALOS C. ARRIAGADA. 1999. Effect of naloxone infusions on the pulsatile LH secretion, insulin and cortisol plasma concentrations in fasted ewe lambs. Exp. Clin. Endocrinol. Diabetes 107 (suppl 1): S49. Abstract P-12.
RECABARREN, S. E., A. LOBOS, V. TORRES, R. OYARZO. 2001. Effect of food restriction on leptin and luteinizing hormone secretion in ewe lambs. 83rd Annual Meeting of the Endocrine Society, Denver, Co. USA. Abstract P3-312.
SCHREIHOFER, D. A., D. B. PARFITT, J. L. CAMERON. 1993. Suppression of luteinizing hormone secretion during short-term fasting in male rhesus monkey: the role of metabolic versus stress signals. Endocrinology 132: 1881-1889.
STEINER, R. A., J. L. CAMERON, T. H. MCNEILL, D. K.CLIFTON, W. J. BREMMER. 1983. Metabolic signals for the onset of puberty. En: Neuroendocrine aspects of reproduction. Ed: RL Norman, pp 183-228, Academic Press, NY.
TJONDRONEGORO, S., G. B. MARTIN, S. R. SUTHERLAND, R. BOUKHLIQ. 1996. Interactions between nutrition, testosterone and inhibin in the control of gonadotrophin secretion in mature rams. Reprod. Fertil. Dev. 8: 855-862.
VELDHUIS, J. D., M. L. JOHNSON. 1986. Cluster analysis: a simple, versatile, and robust algorithm for endocrine pulse detection. Am. J. Physiol. 250: E468-E493.
VIZCARRA, J. A., R. P. WETTEMANN, T. D. BRADEN, A. M. TURZILLO, T. M. NETT. 1997. Effect of gonadotropin-releasing hormone (GnRH) pulse frequency on serum and pituitary concentrations of luteinizing hormone and follicle-stimulating hormone, GnRH receptors, and messenger ribonucleic acid for gonadotropin subunits in cows. Endocrinology 138 : 594-601.
WADE, G. H., J. E. SCHNEIDER, H-Y. LI. 1996. Control of fertility by metabolic cues. Am J Physiol. 270: E1-E19.
WELT, C. K. 2002. The physiology and pathophysiology of inhibin, activin, and follistatin in female reproduction. Curr. Opin. Obstet. Gynecol. 14: 317-323.
WILDT, L., A. HÄUSLER, G. MARSHALL, J. S. HUTCHISON, T. M. PLANT, P. E. BELCHETZ, E. KNOBIL. 1981. Frequency and amplitude of gonadotropin-releasing hormone stimulation and gonadotropin secretion in the rhesus monkey. Endocrinology 109: 376-385.
Aceptado: 09.09.2003.