Arch. Med. Vet., Vol. XXXVI N° 2, 2004, pp. 183-195
ARTICULOS ORIGINALES
Detección inmunohistoquímica del antígeno del virus del síndrome respiratorio y reproductivo (vPRRS) en cerdos inoculados*
Immunohistochemical detection of PRRS virus antigen in inoculated pigs
M. QUEZADA 1 M.V., Dr. Vet., F. VARAS 1 M.V., A.RUIZ 1 M.V. Ph.D., A. ISLAS 1 M.V. M.Sc., N. DIAZ 2 M.V., C. LECOCQ 2 M.V.
1 Facultad
de Medicina Veterinaria, Universidad de Concepción, Av. Vicente Méndez 595,
Chillán, Chile. mquezad@udec.cl
2 Departamento Laboratorios y Estación Cuarentenaria
Agrícola y Pecuaria, Servicio Agrícola y Ganadero. Av. Bulnes 140, Chillán,
Chile.
* Financiado por el Proyecto FONDECYT 1020217
Resumen
El Síndrome Respiratorio y Reproductivo
Porcino (PRRS) es una enfermedad de origen viral en el cerdo que se conoce desde
la década de los 80 en Estados Unidos. La enfermedad se caracterizó inicialmente
por propagarse rápidamente entre los planteles porcinos, difundiéndose casi
a todos los Estados Unidos y luego a Canadá y países europeos. En Chile, el
PRRS se diagnosticó a fines de 1999 y en la actualidad está sometida a un programa
de erradicación.
Con el fin de contribuir al diagnóstico de la enfermedad en nuestro medio y
caracterizar la distribución del antígeno vírico en los tejidos de cerdos inoculados,
se realizó un estudio inmunohistoquímico (IHQ), utilizando 12 cerdos híbridos
provenientes de planteles con pirámide genética libre de PRRS. De ellos, 9 fueron
inoculados con el aislado nacional del virus PRRS y 3 cerdos se usaron como
controles. Los cerdos inoculados recibieron una dosis por vía intranasal de
7.0 ml de suero virémico, proveniente de cerdos inoculados con una dosis de
105.4 TCID50; para reactivar el virus; además, se inocularon
estos animales con 0.7 ml del mismo suero por vía intramuscular. Los cerdos
del grupo control fueron sacrificados a los 0 dpi y los cerdos inoculados a
los 7, 14, 21 dpi. De todos los animales se recolectaron muestras de tonsila,
nódulos linfáticos retrofaríngeos y mediastínicos, timo, bazo, cornete nasal,
pulmón, corazón e hígado, las que fueron fijadas, deshidratadas e incluidas
en parafina. Adicionalmente, se obtuvieron muestras de macrófagos alveolares
pulmonares mediante lavado bronquioalveolar. Todas las muestra fueron inmunoteñidas
usando el anticuerpo monoclonal SDOW-17 y el método del complejo ABC.
Se detectó antígeno viral en macrófagos de todos los tejidos estudiados desde
los 7 a los 21 dpi. Los órganos que presentaron mayor intensidad de reacción
fueron el pulmón y el bazo. Debido a que el antígeno viral se encontró en mayor
cantidad y de forma más constante en estos órganos, estos constituirían la fuente
de muestras más adecuada para el diagnóstico de la enfermedad ya sea por IHQ
u otros métodos que detecten el antígeno o genoma viral.
Palabras clave: PRRv, inmunohistoquímica, pulmón.
Summary
Porcine Reproductive and Respiratory
Syndrome (PRRS), is a viral disease of swine that has been known in the United
States since the 1980's. The sickness was initially characterized by rapid propagation
through pork farms, spreading through almost all the United States and later
Canada and European countries. In Chile, PRRS was diagnosed at the end of 1999
and is currently part of an eradication program.
To contribute to the diagnosis of the disease in our environment and to characterize
the distribution of the viral antigen in the tissues of inoculated pigs, using
an immunohistochemical (IHC) study was carried out utilizing 12 hybrid pigs
originated from a PRSS free genetic pyramid. Nine were inoculated with the national
isolate of the PRRS virus and three were used as controls. The inoculated pigs
received an intranasal dosage of 7.0 ml of viremic serum from inoculated pigs
with a cellular culture dose of 105.4 TCID50 in order to reactivate its pathogenicity;
they were also inoculated intramuscularly with 0.7 ml of the same serum. The
pigs of the control group were sacrificed at 0 dpi and the inoculated pigs at
7, 14 and 21 dpi, At necropsy time, tonsils, retropharyngeal and mediastinal
lymphatic nodes, thymus, spleen, nasal turbinates, lung, heart and liver were
dissected, fixed, dehydrated and paraffin embedded. Additionally, lung alveolar
macrophages were collected via a bronchoalveolar lavage. All these samples were
immunostained using the monoclonal antibody SDOW-17 and the ABC complex method.
Viral antigen was detected in the macrophages of all the tissues studied from
7 to 21 dpi. The organs that showed greatest intensity of reaction were the
lungs and spleen. The consistent finding of greater quantity viral antigen of
in these organs, these tissues suggest constitute the best source of samples
for diagnosing the disease whether by IHC or other methods that detect the viral
antigen or its genome.
Key words: PRRSV, immunohistochemistry, lung.
INTRODUCCION
El Síndrome Respiratorio y Reproductivo Porcino (PRRS) es una enfermedad de gran importancia económica para la industria porcina, causada por un virus RNA del género Arterivirus, Familia Arteriviridae, del orden Nidovirales, al igual que el virus del aumento de la deshidrogenasa láctica del ratón, virus de la arteritis viral equina y virus de la fiebre hemorrágica del simio (Rossow y col., 1994; Neulenberg y col., 1993). La enfermedad se caracteriza por causar aborto tardío en cerdas y chanchillas y un severo cuadro respiratorio en lechones (Collins y col., 1992). Fue observada primeramente en 1987 en Estados Unidos, difundiéndose ampliamente y afectando a Canadá, alcanzando más tarde a Europa en 1990 (Nodelijk, 2002).
El virus del PRRS, al igual que otros Nidovirales, se multiplica en distintas poblaciones de macrófagos que incluyen a los macrófagos alveolares (MAPs), macrófagos intersticiales (MIs), macrófagos intravasculares pulmonares (MIPs), macrófagos esplénicos y células de la microglia del cerebro (Rossow y col, 1996; Molitor y col., 1997; Thanawongnuwech y col., 1997).
La transmisión de la enfermedad ocurre generalmente cuando hay contacto estrecho entre los cerdos, preferentemente por vía nasal, aunque existe descripción de otras vías de transmisión como la vía oral, intramuscular, intraperitoneal y vaginal (Zimmerman y col., 1998). Por otra parte, se ha demostrado que el virus del PRRS puede transmitirse a través del semen de verracos infectados (Christopher-Hennings y col., 1995), lo cual puede traer devastadoras consecuencias en la industria porcina que utiliza inseminación artificial (Gradil y col., 1996) y puede ser uno de los principales mecanismos de transmisión del virus a grandes distancias (Shin y Molitor, 2002). Además, tienen importancia la transmisión transplacentaria (Dee y Molitor, 1998) y por fomites como botas, ropas y agujas entre otros (Otake y col., 2002).
El virus ingresa primariamente por vía nasal, y se múltiplica en macrófagos asociados a cornete nasal, tonsila o pulmón (Rossow, 1998; Cheon y Chae, 1999), para posteriormente continuar por vía linfática a los nódulos regionales, donde se puede multiplicar secundariamente en los macrófagos residentes de estos tejidos, alcanzando más tarde la sangre y así llegar a todos los tejidos, multiplicándose masivamente en macrófagos por todo el organismo. Se ha demostrado la presencia de antígenos virales mediante inmunohistoquímica en cornetes nasales, pulmón, nódulos linfáticos, corazón, timo, vasos sanguíneos, bazo, hígado, glándulas adrenales, riñones, intestino, cerebro y testículos (Halbur y col., 1995; Halbur y col., 1996; Rossow y col., 1996; Larochelle y Magar, 1997; Sur y col., 1998). El virus tiene preferencia por los macrófagos alveolares, especialmente de cerdos menores de 6 semanas de edad, y por macrófagos inmaduros o recientemente activados (Molitor y col., 1997). También se ha demostrado que el virus se puede multiplicar en los testículos de verracos infectados, específicamente en las células del epitelio germinal de los túbulos seminíferos y en macrófagos localizados en el intersticio de los testículos (Sur y col., 1998).
Los cerdos con PRRS tienen fiebre prolongada, hiperapnea, letargia y edema periocular, presentando lesiones macroscópicas inespecíficas como cambios de color del pulmón y aumento de varios nódulos linfáticos superficiales y viscerales (Collins y col., 1992; Rossow y col., 1995). Histopatológicamente se presentan: rinitis, neumonitis, linfoadenopatia (necrosis linfoide, degeneración poliquística del tejido linfoide con policariocitos), vasculitis, miocarditis y encefalitis (Collins y col., 1992; Rossow y col., 1994; Halburt y col., 1995; Rossow y col., 1995).
En la actualidad, el diagnóstico del PRRS se puede realizar por aislamiento viral, detección del antígeno viral por inmunohistoquímica (IHQ), reacción en cadena de la polimerasa de transcripción reversa (RT-PCR) e hibridación in situ (Rossow y col., 1996; Cheon y Chae, 2001; Chung y col., 2002; Nodelijk, 2002;) y detección de anticuerpos por ELISA (Molitor y col., 1997).
El empleo de anticuerpos monoclonales en IHQ tiene la ventaja de su menor costo que otras técnicas que demuestran el antígeno viral y de poder realizarse sobre material obtenido rutinariamente para diagnóstico histopatológico; sin embargo, se ha demostrado que la fijación por más de 3 días reduce la sensibilidad de la técnica (Van Alstine y col., 2002), al igual que el examen de un número reducido de muestras por animal, sugiriéndose al menos 5 (Yaeger, 2002). Por otra parte, algunos anticuerpos monoclonales no detectan adecuadamente los serotipos europeos (anticuerpos monoclonales VO17 y EP147), mientras que la mayoría de los serotipos norteamericanos reaccionan con estos. Sin embargo, el anticuerpo monoclonal SDOW-17, dirigido a la proteína N de la nucleocápside del virus (Nelson y col., 1993) reacciona con ambos serotipos: norteamericanos y europeos, por lo que este se puede usar para el diagnóstico universal en la detección PRRS (Cheon y Chae, 2000).
En Chile, el primer diagnóstico del PRRS se realizó a fines del año 1999 y en la actualidad la enfermedad está sometida a un programa de erradicación. El propósito del presente trabajo es contribuir al diagnóstico de la enfermedad en nuestro medio y caracterizar la distribución en los tejidos del antígeno víral en los tejidos utilizando una técnica IHQ.
MATERIAL Y METODOS
Virus. Se utilizó el aislado chileno del vPRRS (cepa 2402), serotipo norteamericano, proporcionado por el Servicio Agrícola y Ganadero (SAG), mantenido en cultivos celulares de línea MARC- 145, sometida a dos pasajes y a una concentración de 105.4 TCID50 (dosis infectante de cultivo celular). El virus fue inoculado inicialmente en tres cerdos provenientes de núcleos genéticos de alta salud, libres de PRRS, para reactivar su patogenicidad. Los cerdos fueron mantenidos en la Unidad de Control Biológico del Complejo Lo Aguirre del SAG (Chile), el cual dispone de todas las medidas de bioseguridad para evitar su difusión al exterior. De estos animales se obtuvo suero en fase virémica (7 dpi), comprobado por RT-PCR, el cual se filtró utilizando filtros de microporo de 0,2 µm y se le adicionaron 100 UI/ ml de penicilina y 100 mg/ml de estreptomicina, 24 horas antes de la inoculación de los cerdos del grupo experimental.
Cerdos experimentales. Para este estudio, se utilizaron 12 cerdos híbridos, de ambos sexos (5 hembras y 7 machos), de 3 semanas de edad y 6 kg de peso vivo al inicio de la experiencia. Los cerdos se obtuvieron del mismo origen que los cerdos utilizados para la reactivación viral y fueron mantenidos en la Unidad de Control Biológico del Complejo Lo Aguirre del SAG. Los animales permanecieron una semana en aclimatación, manteniéndose en unidades de aislamiento debidamente acondicionadas que cumplen con todas las normas de ética y bienestar animal. Durante este período se determinó que los animales estaban libres de vPRRS mediante ELISA (IDEXX®) y RT-PCR, así como de patógenos bacterianos más comunes mediante cultivos. Posteriormente, los animales fueron divididos, al azar, en 4 grupos de 3 animales cada uno y mantenidos en unidades de aislamiento debidamente separadas. Uno de los grupos se utilizó como control y los tres grupos restantes fueron inoculados con 7 ml intranasal y 0.7 ml intramuscular de suero de cerdos virémicos.
Toma de muestras de sangre. Previo al sacrificio de los animales, se obtuvieron muestras de sangre a los 0, 7, 14 y 21 dpi mediante una punción en la vena cava anterior, utilizando tubos al vacío (VACUTAINER®) sin anticoagulante, para obtener suero para realizar los ELISA, siguiendo el protocolo del fabricante y RT-PCR (Shin y col., 1997).
Sacrificio, necropsia y toma de muestras para inmunohistoquímica. El grupo control se sacrificó a los 0 dpi, mientras que los grupos inoculados fueron eutanasiados a los 7, 14 y 21 dpi. Los animales fueron tranquilizados con acepromazina al 1% (PACIFOR®, Laboratorio Drag Pharma), utilizando una dosis de 0.5 mg/kg de peso vivo vía intramuscular, y anestesiados con tiopental sódico (Laboratorio Chile, S.A., Santiago) diluido al 5%, utilizando una dosis de inducción de 50 mg/kg. Posteriormente se utilizó el método de perfusión intravascular con tampón fosfato 0.1 M (pH 7.4), a una presión de 80 mm de mercurio. Por otra parte, el pulmón derecho fue lavado con tampón fosfato salino (PBS)* estéril para la recuperación de macrófagos alveolares. Adicionalmente, se observaron y registraron las lesiones externas presentadas por cada uno de los cerdos sacrificados y se obtuvieron muestras de cornetes nasales, tonsila, nódulos linfáticos retrofaríngeos y mediastínicos, pulmón (segmento medio del lóbulo cardiaco izquierdo), bazo, timo, corazón e hígado para histopatología e inmunohistoquímica, las cuales fueron fijadas, por 24 a 48 horas, en formol tamponado al 10%**.
PROCESAMIENTO DE LAS MUESTRAS
Lavado bronquiolaveolar. Una vez obtenidas las muestras para histopatología e inmunohistoquímica se pinzó el bronquio primario izquierdo y se procedió a lavar el pulmón derecho mediante una sonda intratraqueal con 250 ml de PBS estéril, posteriormente se separó el pulmón de la cavidad toráxica y se llevó a una campana de flujo laminar, donde primero se presionó levemente la superficie pulmonar para después recuperar el fluido alveolar en forma estéril. Posteriormente, el fluido alveolar se sometió a centrifugación a 1.500 rpm por 15 minutos a 4°C. Una vez obtenido el pellet de células alveolares, se realizó el frotis depositando los macrófagos alveolares en portaobjetos y se fijaron en formalina al 10% por 5 minutos. Posteriormente, las láminas se lavaron con agua destilada por 5 minutos, se secaron en estufa a 37°C por 30 minutos y se almacenaron a temperatura ambiente hasta ser inmunoteñidas con anticuerpo SDOW-17, como se describe más adelante para los tejidos.
Histopatología e Inmunohistoquímica. Los tejidos fueron incluidos en parafina, utilizando un procesador Shandon, Citadel 1000 con bomba de vacío y un Centro de Inclusión Microm (modelo AP280-2). De los bloques de parafina se realizaron cortes de 4 µm con un micrótomo marca Leica (modelo RM2045), los que fueron montados en portaojetos cubiertos con poli-L-lisina.
Para la demostración inmunohistoquímica del antígeno viral se realizó la técnica del complejo ABC, para ello, los cortes fueron desparafinados, deshidratados e incubados con peróxido de hidrógeno al 1% en metanol, por 30 minutos, para inactivar la acción de peroxidasas endógenas, luego se trataron con pronasa al 0.1% (PRONASA 0.1%: 0.01g Pronasa + 10 ml PBS) por 10 minutos a temperatura ambiente (Portease E, Sigma Chemical Co, St. Louis, MO, USA). Después de 3 lavados con PBS a pH 7,2 las secciones fueron incubadas con suero normal de cabra al 10% diluido en PBS por 30 minutos.
Como anticuerpo primario se utilizó el anticuerpo monoclonal SDOW-17, producido directo contra la proteína N de la nucleocápside del vPRRS (Nelson y col., 1993), específico para cepas europeas y americanas de vPRRS. Los cortes fueron incubados con el anticuerpo primario durante 18 horas a 4°C, utilizando una dilución de trabajo de 1:500 en PBS. Posteriormente, se incubó con el segundo anticuerpo o anticuerpo biotinilado del kit ABC (Vector Laboratories, Burlingame, CA, USA), durante 30 minutos a temperatura ambiente. Después de 3 lavados de 5 minutos en PBS, las secciones fueron incubadas con el Complejo Avidina-Biotina- Peroxidasa, durante una hora en oscuridad y a temperatura ambiente. Las secciones fueron posteriormente lavadas 3 veces con tris buffer salino (TBS)*** a pH 7.6 e incubadas durante 1 a 2 minutos con el cromógeno DAB (3.3'- diaminobenzidine tetrahydrochloride) (Sigma Chemical Co, St Louis, MO, USA), diluido al 0.035% en TBS con peróxido de hidrógeno al 30%, lavadas en agua corriente, contrateñidas con Hematoxilina de Mayer, deshidratadas y montadas.
Como controles negativos se empleó PBS, o suero no inmune, en lugar de los anticuerpos primario específicos en cortes de pulmón dispuestos con este propósito al realizar cada inmunoquímica. Como control positivo se emplearon secciones de un pulmón de cerdo inoculado con vPRRS,1 Posteriormente los tejidos fueron observados y fotografiados con un microscopio Zeiss, modelo Axioskop 50.
RESULTADOS
En el 100% de los cerdos inoculados se detectó el virus, mediante RT-PCR, en muestras de suero sanguíneo a los 7 y 14 dpi, disminuyendo estos valores a 67% a los 21 dpi. Los anticuerpos anti-vPRRS fueron detectados por ELISA desde los 14 dpi en el 50% de los cerdos y en el 100% de ellos a los 21 dpi. Los cerdos controles fueron negativos para ambas pruebas.
Las principales lesiones macroscópicas fueron leves y se caracterizaron por la presentación de conjuntivitis, edema periocular y leve aumento de tamaño de los linfonódulos, especialmente a los 21 dpi. Histopatológicamente se detectó neumonía intersticial en el 100% de los animales inoculados, depleción linfoide de los folículos en los órganos linfoides, rinitis, hepatitis, miocarditis y encefalitis no purulenta en algunos animales.
El anticuerpo monoclonal reaccionó positivamente con los tejidos infectados con el vPRRS; sin embargo, no se observó inmunotinción en ninguno de los tejidos analizados de los cerdos controles ni en los tejidos de pulmón usados como controles negativos. La reacción específica se observó en el citoplasma de los macrófagos, con un aspecto microgranular en sectores u ocupando gran parte del citoplasma en otros. En las células infectadas no se observaron efectos citopáticos al compararlas con las células no teñidas de los tejidos vecinos. No se observó tinción de fondo en la mayoría de los tejidos analizados, y en los casos que estuvo presente, ésta apareció como difusa y homogénea en toda la sección.
La inmunorreacción fue observada en cornetes nasales, tonsilas, nódulos linfáticos retrofaríngeos y mediastínicos, parénquima pulmonar, bazo, timo, corazón e hígado, afectando preferentemente macrófagos residentes de los tejidos analizados. Además, se observó inmunotinción en el endotelio arteriolar de los cornetes nasales a los 7 dpi, en el epitelio de las glándulas de los cornetes nasales a los 7 dpi y en los osteoclastos de los cornetes nasales a los 7, 14 y 21 dpi. 1.
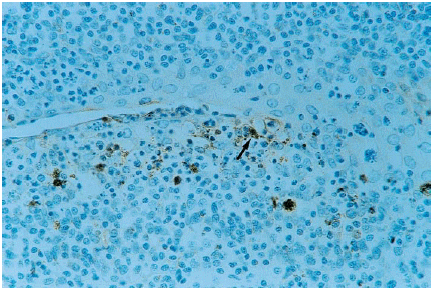
1. Organos linfoides. Tonsila: Se encontró inmunorreacción específica en macrófagos de la zona central de los folículos linfoides, en macrófagos aislados de las áreas interfoliculares, así como en macrófagos y restos celulares localizados en las criptas de la tonsila (figura 1). La inmunotinción en la tonsila se observó a los 7, 14 y 21 dpi, siendo más intensa a los 7 dpi (cuadro 1).
Immunohistochemical
findings in tissues of pigs inoculated with the PRRS virus. |
| Organos y tejidos | Días postinoculación |
||||||||
7 |
14 |
21 |
|||||||
(1) |
(2) |
(3) |
(1) |
(2) |
(3) |
(1) |
(2) |
(3) |
|
| Organos linfoides Tonsila Timo N.L. Retrofaríngeo N.L. Mediastínico Bazo Organos respiratorios Cornete nasal Pulmón Corazón Hígado Lavado bronquioalveolar |
+ – – –/+ + + –/+ + – – ++ |
++ + + – + + + ++ – – + |
+ –/+ –/+ + + + + ++ – + + |
+ + + + ++ + + +++ + + ++ |
+ + + + ++ + + ++ + + + |
+ -/+ -/+ + ++ + -/+ +++ + + ++ |
–/+ + –/+ –/+ + + + ++ – –/+ + |
+ + + – – + –/+ + + + + |
+ + –/+ –/+ + + + + – + + |
Cantidad de células
inmunoteñidas por tejido: –: ausencia; +: leve; ++: moderada;
+++: intensa ( ): identificación del animal por cada día de sacrificio N. L.: Nódulo linfático. |
 |
Tonsil. SDOW-17 antibody
immunostaining of macrophages (arrow) and cellular remains close to a
crypt of a sacrificed pig 14 dpi. ABC complex, counterstained with hematoxylin.
400X. |
Timo: Se observó inmunotinción en macrófagos localizados en corteza y médula a los 7 y 14 y 21 dpi (cuadro 1).
Nódulo linfático retrofaríngeo y mediastínico: A los 7, 14 y 21 dpi había inmunotinción en macrófagos de los folículos y del tejido linfoide difuso de la corteza. Se observaron también algunas células inmunopositivas con prolongaciones citoplasmáticas compatibles con la morfología de células dendríticas, localizadas en los folículos (cuadro 1). El nódulo linfático mediastínico tenía mayor cantidad de células positivas que el retrofaríngeo.
Bazo: Este órgano presentó una gran cantidad de células inmunoteñidas con abundante citoplasma, localizadas en folículos, vainas periarteriales y en la pulpa esplénica (figura 2). Estas células presentaron morfología de macrófagos. Se observaron células inmunoteñidas a los 7, 14 y 21 dpi (cuadro 1).
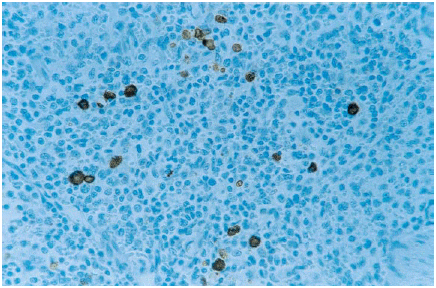 |
Spleen. Intense PRRSv
immunoreaction in macrophages of the splenic pulp. ABC complex, counterstained
with hematoxylin. 200X. |
2. Organos respiratorios. Cornete nasal: Las células con antígeno del vPRRS se encontraron dispersas en la mucosa o en los acúmulos de células inflamatorias localizadas en la mucosa especialmente a los 14 y 21 dpi. También se observaron macrófagos inmunoteñidos, de localización intraepitelial, a los 7, 14 y 21 dpi. Además, a los 7 dpi había positividad en el epitelio de las glándulas mucosas, en el endotelio de arteriolas y en osteoclastos de las laminillas óseas (cuadro 1).
Pulmón: Se observaron células inmunoteñidas, distribuidas de forma dispersa en el parénquima, existiendo zonas con mayor cantidad de células positivas a los 14 dpi. Este hallazgo coincidió con la presencia de áreas de neumonitis con predominio de infiltrado mononuclear, específicamente de macrófagos. La morfología y localización de las células inmunoteñidas correspondieron a la de macrófagos septales (MIPs y MIs) y macrófagos alveolares pulmonares (MAPs) (figura 3). También se observaron macrófagos inmunoteñidos en el tejido conectivo peribronquial y bronquiolar, especialmente a los 21 dpi (cuadro 1).
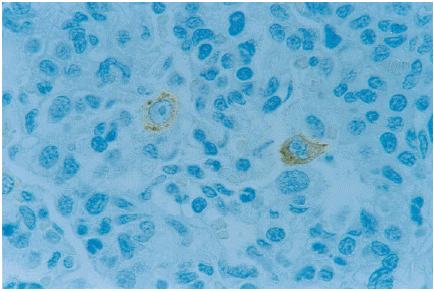 |
Lung. Alveolar macrophages
immunostained with SDOW-17 antibody. Pig sacrificed at 14 dpi. ABC Complex,
counterstained with hematoxylin. 630X. |
3. Corazón. Este órgano presentó una escasa inmunotinción, limitada a macrófagos del intersticio perivascular y de focos de miocarditis, especialmente a los 14 dpi.
4. Hígado. El antígeno vPRRS se detectó en macrófagos de los espacios perivasculares (figura 4), siendo más intensa la inmunotinción a los 14 dpi (cuadro 1).
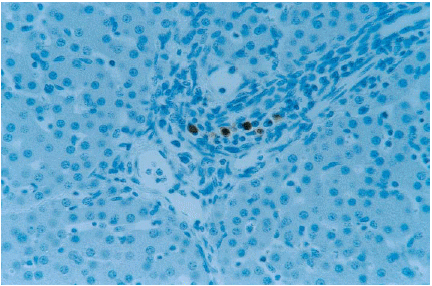 |
Liver. SDOW-17 antibody
immunostained macrophages in the periportal space. Pig sacrificed at 14
dpi. ABC complex, counterstained with hematoxylin. 400X. |
5. Lavado bronquioalveolar. Se observó un predominio de macrófagos alveolares con citoplasma amplio y espumoso; sin embargo, los macrófagos inmunoteñidos generalmente correspondieron a células macrofágicas más pequeñas de núcleo ovalado. Por lo general, la inmunotinción se observó en todo su citoplasma (figura 5 ). Este hallazgo fue constante en todos los animales inoculados.
DISCUSION
Usando un anticuerpo monoclonal se pudo demostrar el antígeno vPRRS en muestras de tejidos de cerdos infectados experimentalmente con el aislado chileno del vPRRS, este anticuerpo monoclonal murino está dirigido contra las proteínas de la nucleocápside del virus (Nelson y col., 1993) y reacciona tanto con el serotipo norteamericano como con el serotipo europeo del vPRRS (Nelson y col., 1993). El anticuerpo SDOW-17 reaccionó con el aislado chileno, el que corresponde a un serotipo norteamericano, no vacunal (Ruiz y col., 2003). Adicionalmente, se pudieron observar lesiones inflamatorias de algunos tejidos que contenían antígeno viral, resaltando la importancia de la técnica inmunohistoquímica, que permite detectar al agente asociado con la lesión.
El empleo de este anticuerpo monoclonal, permitió encontrar el vPRRS en varios tejidos, incluyendo tejidos respiratorios y linfoides, lo que concuerda con trabajos previos (Halbur y col., 1995; Rossow y col., 1996; Chung y col., 2002), demostrándose la importancia de la técnica IHQ para detectar el virus en los animales infectados, como en este caso que además demuestra que la enfermedad causada por el aislado chileno también es multisistémica, como la observada para aislados virulentos (Halbur y col., 1996; Rossow y col., 1996), ya que a los 7 dpi se encontró prácticamente en todos los tejidos analizados. En el pulmón y bazo se observó una reacción intensa y constante, especialmente a los 14 dpi. En tejidos como mucosa nasal, pulmón e hígado, en los que se observaron infiltrados inflamatorios, el virus se detectó en mayor cantidad a los 14 dpi y se redujo de forma importante a los 21 dpi. Estas observaciones son coincidentes con lo comunicado por Rossow y col. (1996), quienes realizaron inmunohistoquímica frente al antígeno viral y a los leucocitos presentes en los tejidos, encontrando una importante reducción de antígeno viral en los infiltrados leucocitarios de los tejidos con mayor grado de inflamación, en los que aumentaron de forma importante los linfocitos T y B a los 14 y 21 dpi.
El antígeno vPRRS fue identificado en macrófagos del tejido conectivo de diversos órganos y tejidos, en algunas células con prolongaciones citoplasmáticas de morfología similar a células dendríticas en el tejido linfoide, macrófagos alveolares, intravasculares e intersticiales del pulmón a los 7, 14 y 21 dpi. Además, se observó inmunotinción del epitelio de las glándulas de la mucosa nasal, en endotelio y en osteoclastos de los cornetes nasales a los 7 dpi. Estas observaciones son coincidentes con lo encontrado por otros autores (Pol y col., 1991; Magar y col., 1993; Halbur y col., 1995), quienes han descrito un compromiso de los macrófagos con la multiplicación viral in vivo o de sus precursores: los monocitos in vitro (Voicu y col., 1994).
En este estudio, el pulmón y el bazo resultaron ser los órganos con mayor cantidad de células inmunoteñidas, lo que estaría relacionado directamente con la vía de transmisión y con la gran población de macrófagos presentes en estos órganos. Las células inmunoteñidas en el pulmón correspondieron a MIPs, MI y MAPs y en el bazo a macrófagos de los folículos, vainas linfoides periarteriales y pulpa esplénica. Si bien el pulmón es uno de los órganos más importantes para la multiplicación del virus, ésta ocurre fundamentalmente en la población de macrófagos (MAPs, MI, MIPs). Así, los MAPs han sido el tipo celular predominante donde el antígeno viral se ha encontrado (Bautista y col., 1993) y son las células de elección para el aislamiento del virus (Bautista y col., 1993; Wensvoort y col., 1991), por lo que fueron usadas inicialmente con fines diagnósticos. En este trabajo, los MAPs obtenidos por lavado bronquioalveolar presentaron una fuerte inmunotinción a los 7, 14 y 21 dpi. Las células imnunoteñidas más pequeñas observadas en el pulmón corresponderían a macrófagos recientemente activados, ya que las células del linaje monocito/macrófago no activadas son refractarias al virus (Labarque y col., 2000). El lavado bronquialveolar del pulmón aumenta considerablemente la sensibilidad de la técnica IHQ, ya que las células recuperadas en el lavado provienen de diferentes partes del pulmón. En esta experiencia el 100% de los animales inoculados tenía MAPs inmunoteñidos, lo que concuerda con Yaeger (2002), quien señala que la sensibilidad de la IHQ aumenta >90% tomando 5 muestras de zonas anteroventrales del pulmón.
La multiplicación en otros tipos celulares diferentes a los macrófagos no se ha demostrado; sin embargo, se ha observado la inmunotinción en células epiteliales de los bronquios, sincicios del pulmón y células endoteliales (Rossow y col., 1996). En este estudio, se observó inmunotinción de acinos glandulares, células endoteliales y osteoclastos del cornete nasal a los 7 dpi. Aunque este hallazgo demuestra la presencia del antígeno vírico en componentes celulares no habituales para Rossow y col. (1996), esto no constituiría multiplicación; sin embargo, demuestra la presencia del antígeno viral en la mucosa nasal, lo cual tiene importancia en la patogenia de la enfermedad, ya que este hallazgo puede estar asociado a la entrada o salida de virus. Por otra parte, en este trabajo no se observó inmunotinción de células epiteliales de conductos ni de alvéolos. En un estudio anterior, utilizando también el anticuerpo SDOW-17, se encontró positividad en células epiteliales de los bronquios y en sincicios en los alvéolos, no relacionadas a multiplicación viral (Rossow y col., 1996).
En estudios con cepas virulentas, las lesiones pulmonares han sido muy intensas y el virus se ha detectado en macrófagos del pulmón desde las 12 hpi; sin embargo, la mayor extensión y cantidad de células comprometidas se observó entre los 14 y 21 dpi (Rossow y col., 1996). En el presente estudio, la detección inmunohistoquímica del antígeno se realizó desde los 7 a 21 dpi; sin embargo, se encontró una distribución menos extensa en los tejidos que la informada para cepas virulentas por Rossow y col. (1996), observándose, además, una baja cantidad de antígeno. En términos relativos el pulmón y bazo presentaron una distribución más extensa e intensa de antígeno que la observada en otros tejidos, por lo que estos órganos constituirían la fuente de muestras más adecuada para el diagnóstico de la enfermedad en nuestro medio, ya sea por el empleo de IHQ o por otros métodos que detecten el antígeno o genoma viral.
AGRADECIMIENTOS
Este trabajo fue financiado por el proyecto FONDECYT (CHILE) N° 1020217. Los autores desean agradecer a las autoridades del Servicio Agrícola y Ganadero por el apoyo al proyecto y al Dr. Fernando Osorio, de la Universidad de Nebraska, Lincoln, USA, por el asesoramiento virológico.
NOTAS
* PBS: 7.2 g NaCl + 1.48 g Na2HPO4 +0.43 g KH2PO4 + 1000 ml H2O destilada.
** Formol tamponado: 100 ml de formalina comercial (37%) + 900 ml agua destilada + 4.0 g fosfato de sodio monobásico + 6.5 g de fosfato de sodio dibásico.
*** TBS: 1 parte de TRIS madre + 9 partes de suero salino; TRIS madre: 60,57 g TRIS + 500 ml de agua destilada + 320-400 ml HCl 1N hasta alcanzar pH 7,6.
1 Proporcionado gentilmente por el Dr. Fernando Osorio de la Universidad de Nebraska, Lincoln, USA.
BIBLIOGRAFIA
BAUTISTA, E.M., S.M. GOYAL, I.J. YOON, H.S. JOO, J.E. COLLINS. 1993. Comparison of porcine alveolar macrophages and CL2621 for the detection of porcine reproductive and respiratory syndrome (PRRS) virus and anti-PRRS antibody. J. Vet. Diagn. Invest. 5: 163-165.
CHEON, D.S., C. CHAE. 1999. Distribution of a Korean strain of porcine reproductive and respiratory syndrome virus in experimentally infected pigs, as demonstrated immunohistochemically and by in situ hybridization. J. Comp. Pathol. 120: 79-88.
CHEON, D.S., C. CHAE. 2000. Antigenic variation and genotipe of isolates of porcine reproductive and respiratory syndrome virus in Korea. Vet. Rec. 147: 215-218.
CHEON, D.S., C. CHAE. 2001. Distribution of porcine reproductive and respiratory syndrome virus in stillborn and liveborn piglets from experimentally infected sows. J. Comp. Pathol. 124: 231-237.
CHUNG, H.K., C. CHOI, J. KIM, C. CHAE. 2002. Detection and differentiation of North American and European genotypes of porcine reproductive and respiratory syndrome virus in formalin-fixed, paraffin-embedded tissues by multiplex reverse transcription-nested polymerase chain reaction. J. Vet. Diagn. Invest. 14: 56-60.
COLLINS, J. E., D. A. BENFIELD, W. T. CHRISTIANSON, L. HARRIS, D. P. SHAW, S. M. GOYAL, S. McCULLOUGH, R. B. MORRISON, H. S. JOO, D. GORCYCA, D. CHLADEK, 1992. Isolation of swine infertility and respiratory syndrome virus in North America and experimental reproduction of the disease in gnotobiotic pigs. J. Vet. Diagn. Invest. 4: 117-126.
CHRISTOPHER-HENNINGS, J., E.A. NELSON, J.K. NELSON, R.J. HINES, S.L. SWENSON, H.T. HILL, J.J. ZIMMERMAN, J.B. KATZ, M.J. YAEGER, C.C. CHASE, D.A. BENFIELD. 1995. Detection of Porcine Reproductive and Respiratory Syndrome in boar semen by PCR. J. of Clin. Microbiol. 33: 1730-1734.
DEE, S.A., T.W. MOLITOR. 1998. Elimination of porcine reproductive and respiratory syndrome virus using a test and removal process. Vet. Rec. 143: 474-476.
GRADIL, C., C. DUBUC, M.D. EAGLESOME. 1996. Porcine reproductive and respiratory syndrome: seminal transmission. Vet. Rec. 138: 521-522.
HALBUR, P.G., L.D. MILLER, P.S. PAUL, X.J. MENG, E.L. HUFFMAN, J.J. ANDREWS. 1995. Immunohistochemical identification of porcine reproductive and respiratory syndrome virus (PRRSV) antigen in the heart and lymphoid system of three-week-old calostrum-deprived pigs. Vet. Pathol. 32: 200-204.
HALBUR, P.G., P.S. PAUL, M.L. FREY, J. LANDGRAF, K. EERNISSE, X.J. MENG, J.J. ANDREWS, M.A. LUM, J.A. RATHJE. 1996. Comparison of the antigen distribution of two US porcine reproductive and respiratory syndrome virus isolates with that of the Lelystad virus. Vet. Pathol. 33: 159-170.
LAROCHELLE, R., R. MAGAR. 1997. Detection of porcine and reproductive and respiratory syndrome virus in paraffin-embedded tissues: comparison of inmunohistochemistry and in situ hybridization. J. Virol. Methods. 63: 227-235.
LABARQUE, G., H. NAUWYNCK, K. VAN REETH, M. PENSAERT. 2000. Effect of cellular changes and onset of humoral immunity on the replication of porcine reproductive and respiratory syndrome virus in the lungs of pigs. J. Gen. Virol. 81: 1327-1334.
MAGAR, R., R. LAROCHELLE, Y. ROBINSON, C. DUBUC. 1993. Immunohistochemical detection of porcine reproductive and respiratory syndrome virus using colloidal gold. Can. J. Vet. Res. 57: 300-304.
MOLITOR, T.W., E.M. BAUTISTA, C.S. CHOI. 1997. Immunity to PRRSV: Double-edged sword. Vet. Microbiol. 55: 265-276.
NELSON, E.A., J. CHRISTOPHER-HENNINGS, T. DREW, G. WENSVOORT, J.E. COLLINS, D.A. BENFIELD. 1993. Differentiation of US and European isolates of porcine reproductive and respiratory syndrome virus by monoclonal antibodies. J. Clin. Microbiol. 31: 3184-3189.
NEULENBERG, J.J.M., M.M. HULST, E.J. DE MEIJER, P.L., J.M. MOONEN, A. DEN BESTEN, E.P. KLUYVER, G. WENSVOORT, R.J.M. MOORMAN. 1993. Lelystad virus, the causative agent of porcine epidemic abortion and respiratory syndrome (PEARS), is related to LDV and EAV. Virology 192: 62-72.
NODELIJK, G. 2002. Porcine reproductive and respiratory syndrome (PRRS) with special reference to clinical aspects and diagnosis: a review. Vet. Q. 24: 95-100.
OTAKE, S., S.A. DEE, K.D. ROSSOW, H.S. JOO, J. DEEN, T.W. MOLITOR, C. PIJOAN. 2002. Transmission of porcine reproductive and respiratory syndrome virus by needles. Vet. Rec. 150: 114-115.
POL, J.M.A., J.E. VAN DIJK, G. WENSVOORT, C. TERPSTRA. 1991. Pathological, ultrastructural, and immunohistochemical changes caused by Lelystad virus in experimentally induced infections of mystery swine disease (synonym: porcine epidemic abortion and respiratory syndrome (PEARS). Vet. Q. 13: 137-143.
ROSSOW K.D., E.M. BAUTISTA, S.M. GOYAL, T.W. MOLITOR, M.P. MURTAUGH, R.B. MORRISON, D.A. BENFIELD, J.E. COLLINS. 1994. Experimental porcine reproductive and respiratory syndrome virus infection in one-, four-, and 10-week-old pigs. J. Vet. Diag. Invest. 6: 3-12.
ROSSOW, K.D., J.E. COLLINS, S.M. GOYAL, E.A. NELSON, J. CHRISTOPHER-HENNINGS, D.A. BENFIELD. 1995. Pathogenesis of porcine reproductive and respiratory syndrome virus infection in gnotobiotic pigs. Vet. Pathol. 32: 361-373.
ROSSOW, K.D., D.A. BENFIELD, S.M. GOYAL, E.A. NELSON, J. CHRISTOPHER-HENNINGS, J.E. COLLINS. 1996. Chronological immunohistochemical detection and localization of porcine reproductive and respiratory syndrome virus in gnotobiotic pigs. Vet. Pathol. 33: 551-556.
ROSSOW, K.D. 1998. Porcine reproductive and respiratory syndrome. Vet. Pathol. 35: 1-20.
RUIZ, A., L. CUEVAS, J. NARANJO. 2003. Chile: Program to erradicate PRRS virus. In 2003 PRRS Compendium. 2nd ed. Eds. J. Zimmerman and K. J. Yoon. National Pork Board. Iowa, U.S.A. pp. 221-222.
SHIN, J., J. TORRISON, C.S. CHOI, S.M. GONZALEZ, B.G. CRABO, T.W. MOLITOR. 1997. Monitoring of porcine reproductive and respiratory syndrome virus infection in boars. Veterinary Microbiology. 55: 337-346.
SHIN, J., T.W. MOLITOR. 2002. Localization of porcine reproductive and respiratory syndrome virus infection in boars by in situ riboprobe hybridization. J. Vet. Sci. 3: 87-96.
SUR, J.H., A.R. DOSTER, F.A. OSORIO. 1998. Apoptosis induced in vivo during acute infection by porcine reproductive and respiratory syndrome virus. Vet. Pathol. 35: 506-514.
THANAWONGNUWECH, R., E.L. TACKER, P.G. HALBUR. 1997. Effect of porcine reproductive and respiratory syndrome virus (PRRSV) (isolate ATCC VR-2385) infection on bactericidal activity on porcine intravascular macrophages (PIMs): in vitro comparisons with pulmonary alveolar macrophages (PAMs). Vet. Immunol. Immunopathol. 59: 323-335.
VAN ALSTINE, W.G., M. POPIELARCZYK, S.R. ALBREGTS. 2002. Effect of formalin fixation on the immunohistochemical detection of PRRS virus antigen in experimentally and naturally infected pigs. J. Vet. Diagn. Invest. 14: 504-507.
VOICU, I.L., A. SILIM, M. MORIN MASY ELAZHARY. 1994. Interaction of porcine reproductive and respiratory syndrome virus with swine monocytes. Vet. Rec. 134: 422-423.
WENSVOORT, G., C. TERPSTRA, J.M.A. POL, E.A. TER LAAK, M. BLOEMARAAD, E.P. DE KLUYVER, C. KRAGTEN, L. VAN BUITEN, A. DEN BESTEN, F. WAGENAAR, J.M. BRÖEKHUIJSEN, P.L.J.M. MOONEN, T. ZETSTRA, E.A. DE BOER, H.J. TIBBEN, M.F. DE JONG, P. VELD, G.J.R. GROENLAND, J.A. VAN GENNEP, M.T. VOETS, J.H.M. VERHEIJDEN, J. BRAAMSKAMP. 1991. Mystery swine disease in The Netherlands: isolation of Lelystad virus. Vet. Q. 13: 121-130.
YAEGER, M. 2002. The diagnostic sensibility of immunohistochemistry for the detection of porcine reproductive and respiratory syndrome virus in the lung of vaccinated and unvaccinated swine. J. Vet. Diagn. Invest. 14: 15-19.
ZIMMERMAN, J., K.J. YOON, G. STEVENSON, S.A. DEE. 1998. The 1998 PRRS Compendium. National Pork Producers Council. Iowa, U.S.A.
Aceptado: 06.07.2004