ARTICULO ORIGINAL
Evaluación de la resistencia antimicrobiana en ganado bovino en Chile, utilizando E. coli como bacteria indicadora#
Antimicrobial resistance monitoring in cattle in Chile using E. coli as the indicator bacteria
B San Martín1*, V Bravo2, C Borie2
1 Laboratorio de Farmacología
Veterinaria.
2 Laboratorio de Microbiología,
Facultad de Ciencias Veterinarias y Pecuarias, Universidad de Chile.
SUMMARY
Antimicrobial resistance is an important worldwide public health problem having a negative impact on the struggle against bacterial diseases. The WHO indicates that there exists evidence that livestock are a reservoir for resistant bacteria and that medical physicians and veterinarians must work together on this problem. The aim of the present study was to monitor the antimicrobial resistance in cattle, using E. coli as the indicator bacteria. Fifty E. coli strains were isolated from caecal contents of dairy cattle (Group I) and 72 from beef cattle (Group II). The Minimal Inhibitory Concentrations to eight antimicrobial drugs were determined. The highest resistance percentages (86%) were observed in group I strains; whereas in beef cattle this value was under 11%. In the Group I strains the major levels of resistance were observed against ciprofloxacin, ceftiofur, enrofloxacin and oxitetracycline and in Group II, strains resistant to sulfamethoxazol/trimethoprim were observed. High multiresistance percentages were observed in the Group I with the profile enrofloxacin/ciprofloxacin/oxitetracycline/ceftiofur being the most common (46%). This situation contrasted with that observed in Group II strains, where less than 3% of the strains were multiresistant. It was concluded that antimicrobial resistance is present in both dairy and beef cattle in the Metropolitan Region, as has been reported in other regions of the country.
Palabras clave: resistencia, bovino, E. coli, bacteria indicadora.
Key words: resistance, cattle, E. coli, indicator bacteria.
RESUMEN
La resistencia antimicrobiana es un importante problema de salud pública que afecta a la mayoría de los países, teniendo un impacto negativo en control de las enfermedades bacterianas. La Organización Mundial de la Salud (OMS) señala que existen evidencias que los animales de producción son un reservorio de bacterias resistentes y que deben hacerse esfuerzos entre médicos humanos y veterinarios para abordar este problema. El objetivo de este trabajo fue determinar la resistencia antimicrobiana, utilizando E. coli como bacteria indicadora. Se aislaron de contenido cecal 50 cepas de E. coli en ganado de leche (Grupo I) y 72 en ganado de carne (Grupo II). Se determinaron las Concentraciones Mínimas Inhibitorias frente a ocho antimicrobianos.
Los mayores porcentajes de resistencia (86%) se observaron en las cepas aisladas del Grupo I; en el grupo II no superó el 11%. Los mayores niveles de resistencia se presentaron frente a oxitetraciclina, enrofloxacino, ciprofloxacino y ceftiofur, en el Grupo I, y a sulfametoxazol/trimetoprim, en el grupo II.
Se observó un alto porcentaje de multirresistencia en las cepas del Grupo I, siendo el perfil enrofloxacino/ciprofloxacino/oxitetraciclina/ceftiofur el más observado (46%). Esta situación contrasta con el Grupo II, en donde menos del 3% de las cepas fueron multirresistentes.
De los resultados obtenidos podemos concluir que el ganado de leche como el de carne de la Región Metropolitana no está ajeno a la problemática mundial de resistencia bacteriana, situación que también ha sido reportada en otras regiones del país.
INTRODUCCION
Aun cuando los antimicrobianos son actualmente la principal herramienta terapéutica para el tratamiento de infecciones bacterianas en el hombre y los animales, en las últimas décadas el incremento del uso de estos fármacos, su mal uso y otros factores han dado lugar a la emergencia de resistencia antimicrobiana, siendo ésta un importante problema en salud pública que afecta a la mayoría de los países del mundo.
A la luz de estos antecedentes, la Organización Mundial de la Salud señala que la resistencia antimicrobiana debe ser considerada un problema grave, complejo y de dimensión internacional, y que es conveniente poner en marcha un sistema global de vigilancia, recomendando que se fijen políticas gubernamentales orientadas al uso racional de estos medicamentos en medicina humana y veterinaria (OMS 1997, OMS 2000). Por otro lado, la Comunidad Europea, considerando que no se debe incrementar el reservorio de bacterias resistentes en los animales de producción, prohíbe utilizar, como aditivos en los alimentos para animales, antimicrobianos que se utilizan en enfermedades graves en humanos y/o que generen resistencia cruzada con antimicrobianos de primera línea de elección en medicina humana. Es así que en el año 1997 prohíbe la utilización de avoparcina (Directiva 97/6/CEE)1 y en 1998 de bacitracina-Zinc, espiramicina, virginiamicina y fosfato de tilosina (Directiva 70/524/CEE)2.
Por otro lado, el Codex Alimentarius en el año 2000 proporciona una guía adicional al Código Internacional de Prácticas Recomendado para el Control de Uso de Medicamentos Veterinarios, en la cual recomienda a los países establecer líneas de trabajos orientadas a controlar y disminuir este riesgo. Dentro de estas medidas, está la utilización de estos fármacos bajo receta y responsabilidad del médico veterinario, cumplimiento de los períodos de resguardo, implementación de registros asociados al manejo de medicamentos, utilización de estos fármacos sólo frente a la presencia de enfermedades de origen bacteriano e instauración de programas permanentes de monitoreo de la resistencia; estos últimos entregan información sobre qué antimicrobianos están generando resistencia para cada especie animal, como de los cambios que ocurren a través del tiempo. Así, por ejemplo, en el año 1996 España puso en funcionamiento la Red de Vigilancia Veterinaria de Resistencia a Antimicrobianos (VAV), convirtiéndose en uno de los pioneros dentro de Europa junto al programa Danés DANMAP, iniciado en 1995; en el año 2000 se instaura el programa sueco (Moreno y col 2000).
Los programas de monitoreo de la resistencia incluyen tres grandes grupos de bacterias en aves, cerdos y bovinos: bacterias indicadoras (E. coli, Enterococcus faecium y/o E. faecalis), bacterias patógenas (Staphylococcus aureus, Pasteurella spp, etc.) y bacterias zoonóticas (Salmonella spp y/o Campylobacter spp) (Aarestrup y col 1998, Moreno y col 2000).
La importancia de las bacterias indicadoras se debe a que la microflora normal de los animales es considerada un reservorio de bacterias y determinantes genéticos de resistencia que podrían ser transmitidas a bacterias patógenas y zoonóticas. El monitoreo de este tipo de microorganismos permite dar a conocer a los médicos veterinarios cuáles antimicrobianos están generando resistencia, evitando un riesgo en salud pública, además de disminuir el riesgo de un fracaso terapéutico que genera grandes pérdidas económicas al productor (Moreno y col, 2000). La elección de E. coli como bacteria indicadora se justifica fundamentalmente por su elevada frecuencia de aislamiento e identificación en los laboratorios de sanidad; además, en las pautas que siguen diversos programas de monitoreo se considera a esta bacteria como el mejor indicador entre los microorganismos gramnegativos (Moreno y col 2000, Emborg y Heuer 2003).
Respecto a la situación en Chile, al igual que a escala mundial, los antimicrobianos son la principal herramienta de control para las enfermedades de origen bacteriano; así también, no estamos ajenos al problema mundial planteado, ya que existen antecedentes que bacterias patógenas aisladas de vacas con mastitis clínicas presentan resistencia y multirresistencia a diferentes antimicrobianos (Borie y col 2000, San Martín y col 2002-2003). Por otro lado, a nivel gubernamental, si bien es cierto que a partir del año 1996 las exigencias en el Registro de Productos Farmacéuticos han aumentado por parte del Servicio Agrícola Ganadero del Ministerio de Agricultura de Chile, implementándose, además, un Plan Nacional de Control de Residuos de Medicamentos en cerdos, aves y bovinos, no existe actualmente un programa de monitoreo de la resistencia bacteriana, como tampoco restricción en la adquisición y uso de estos fármacos, pudiendo adquirirse y emplearse en muchos casos sin la supervisión de un médico veterinario.
Considerando los antecedentes planteados y la falta de información nacional sobre los niveles de resistencia en bacterias indicadoras, en este trabajo se presentan los resultados de la resistencia bacteriana utilizando E. coli de contenido cecal en ganado bovino de la Región Metropolitana, con el fin de entregar información que permita a los profesionales involucrados utilizar adecuadamente estos fármacos.
MATERIAL Y METODOS
Obtención de las muestras: Las muestras fueron obtenidas a partir de dos grupos de animales:
Grupo I: Cien vacas lactantes de 10 planteles lecheros de la Región Metropolitana. Por cada plantel se obtuvieron como máximo 10 muestras cecales. La obtención de contenido cecal se realizó por palpación rectal utilizando mangas desechables.
Grupo II: Cien machos destinados a carne, faenados en diferentes plantas faenadoras de la Región Metropolitana; por cada predio de origen se obtuvieron como máximo 10 muestras cecales. El contenido cecal se obtuvo desde el intestino grueso en la sección de evisceración.
En ambos casos se tomaron aproximadamente 10 g de muestra en frascos de vidrio estériles que contenían 50 ml de medio de transporte Cary-Blair (BBL®). Se mantuvieron refrigeradas por un tiempo no mayor a 24 horas hasta el momento de su procesamiento.
Tamaño muestreal: Para el cálculo del número de cepas a aislar se consideraron valores estimados de 31,9% de resistencia obtenidos por San Martín y col (2002-2003). De acuerdo a este valor y considerando un nivel de confianza del 95% y un error máximo estimado en ± 0,1, y una eficiencia de aislamiento de un 80%, el número mínimo de muestras consideradas fue de 100 por grupo y el número de cepas totales a estudiar de al menos 84.
Aislamiento e identificación de E. coli: Para el aislamiento e identificación de E. coli se utilizaron las pautas recomendadas por el Manual de Bergey's de Bacteriología Sistemática (Orskov 1984). Las muestras de heces previamente diluidas en suero fisiológico estéril fueron sembradas en Agar Mc Conkey (BBL®) y Agar XLD (DIFCO) a 37°C por 24 horas hasta lograr desarrollo bacteriano. La identificación de E. coli se realizó a través de pruebas bioquímicas convencionales (fermentación de azúcares, prueba de rojo de metilo, prueba de indol, citrato de Simmond's y prueba de urea). Se seleccionó una colonia por muestra. Una vez identificadas, las cepas fueron mantenidas a 4°C en agar común (máximo un mes) hasta su análisis de sensibilidad a los antimicrobianos en estudio.
Test de sensibilidad: Para evaluar la resistencia bacteriana se determinó la Concentración Mínima Inhibitoria (MIC) de cada cepa aislada, utilizando el Método de Dilución en Placa, de acuerdo a las pautas recomendadas por el National Committee for Clinical Laboratory Standards (NCCLS, 1999). A partir de cada antimicrobiano con potencia conocida, se prepararon soluciones madres en concentraciones de 2000 µg/ml. A partir de ésta se preparó una solución de 1280 µg/ml y de allí se obtuvieron diluciones decrecientes a la mitad. Cada concentración se mezcló con agar Mueller-Hinton (Difco®) en proporción 1:10.
Cada cepa bacteriana se sembró en caldo común e incubó a 37 °C por 24 horas. La suspensión fue ajustada al 0,5 del Nefelómetro de Mc Farland y diluida en salina estéril en una proporción 1:10 e inoculadas mediante un Replicador de Steers en placas de agar mezcladas con antimicrobianos. Este proceso se inició con las placas controles (sin antimicrobianos) siguiendo el orden de menor a mayor concentración. Las placas fueron incubadas a 37 °C por 24 horas. E. coli ATCC 25922 fue utilizada como cepa control.
Los antimicrobianos analizados fueron: cefquinoma (Sigma®, 98% de pureza), cefoperazona (Sigma®, 92,7% de pureza), ceftiofur (Sigma®, 98% de pureza), ciprofloxacino (USP®, 100% de pureza), enrofloxacino (Lab. Chile®, 100% pureza), gentamicina (Sigma®, 638, oxitetraciclina (Sigma®, 96% de pureza) y sulfametoxazol / trimetoprim (Arlab, 100% de pureza).
Análisis de los resultados: Para analizar los resultados se consideró que cada cepa bacteriana se comporta individualmente frente a las diferentes concentraciones de antimicrobianos; las MIC se expresaron en valores absolutos (µg/ml). Se determinó la MIC50 (concentración a la cual se inhibe el 50% de las cepas) y MIC90 (concentración a la cual se inhibe el 90% de las cepas) para cada antimicrobiano. Las categorías sensibles o resistentes fueron asignadas basándose en los puntos de corte recomendados por el NCCLS (1999) y las cepas con sensibilidad intermedia fueron consideradas resistentes. Se realizó un análisis de la frecuencia de distribución de las cepas resistentes frente a cada antimicrobiano y de frecuencia de distribución de los perfiles de resistencia frente a dos o más antimicrobianos.
RESULTADOS
De cada grupo de animales se tomaron 100 muestras, aislando 50 y 72 cepas de E. coli desde ganado de leche (Grupo I) y ganado de carne (Grupo II) respectivamente. Los porcentajes de resistencia que presentaron las cepas aisladas a lo menos a un antimicrobiano fueron de 86% para el Grupo I y de 11% para el Grupo II.
Las respectivas MIC50 y MIC90 frente a cada antimicrobiano en estudio se señalan en los cuadros 1 y 2. De acuerdo a estos valores, los mejores antimicrobianos frente a la población analizada corresponden a cefquinoma, cefoperazona y gentamicina, debido a que los valores de MIC50.y MIC90 están a bajas concentraciones con rangos cercanos entre sí.
| Cuadro 1. Valores
de MIC de cepas de E. coli aisladas de ganado de leche (Grupo
I).
MIC values of E. coli strains isolated from dairy cattle. |
|||||
|
|
|||||
| Puntos de Corte | |||||
| Ab | n | MIC50 | MIC90 |
|
|
| Sensibles | Resistentes | ||||
|
|
|||||
| Ot | 50 | ³128 | ³128 | ³4 µg/ml | ³8 µg/ml |
| Enr | 50 | 4 | ³128 | £0.125 µg/ml | ³0,5 µg/ml |
| Cip | 50 | 8 | ³128 | £1 µg/ml | ³4 µg/ml |
| Sxt | 50 | 2 | 8 | £2/38 µg/ml | ³4/76 µg/ml |
| Xnl | 50 | ³128 | ³128 | £2 µg/ml | ³4 µg/ml |
| Cb | 50 | £0,125 | £0,125 | £8 µg/ml | ³16 µg/ml |
| Cfp | 50 | 0,25 | 0,5 | £8 µg/ml | ³16 µg/ml |
| Cn | 50 | 0,25 | 0,5 | £4 µg/ml | ³8 µg/ml |
|
|
|||||
| Abreviaturas: Ab: Antimicrobiano n: Nº de cepas; Cb: Cefquinoma; Stx: Sulfametoxazol/trimetoprim; Ot: Oxitetraciclina; Cfp: Cefoperazona; Enr: Enrofloxacino; Cip: Ciprofloxacino; Xnl: Ceftiofur; Cn: Gentamicina. | |||||
| Cuadro 2. Valores
de MIC de cepas E. coli aisladas de ganado de carne (Grupo
II).
MIC values of E. coli strains isolated from beef cattle |
|||||
|
|
|||||
| Puntos de Corte | |||||
| Ab | n | MIC50 | MIC90 |
|
|
| Sensibles | Resistentes | ||||
|
|
|||||
| Ot | 72 | ³2 | ³8 | £4 µg/ml | ³8 µg/ml |
| Enr | 72 | £0.125 | £0.125 | £0.125 µg/ml | ³0.5 µg/ml |
| Cip | 72 | £.125 | £0.125 | £1 µg/ml | ³4 µg/ml |
| Sxt | 72 | 0.5 | 0.5 | £2/38 µg/ml | ³4/76 µg/ml |
| Xnl | 72 | ³128 | ³128 | £2 µg/ml | ³4 µg/ml |
| Cb | 72 | £0.125 | £0.125 | £8 µg/ml | ³16 µg/ml |
| Cfp | 72 | 0.25 | 0.5 | £8 µg/ml | £16 µg/ml |
| Cn | 72 | 0.5 | 0.5 | £4 µg/ml | £8 µg/ml |
|
|
|||||
| Abreviaturas: Ab: Antimicrobiano n: Nº de cepas; Cb: Cefquinoma; Stx: Sulfametoxazol/trimetoprim,; Ot: Oxitetraciclina; Cfp: Cefoperazona; Enr: Enrofloxacino; Cip: Ciprofloxacino; Xnl: Ceftiofur; Cn: Gentamicina. | |||||
Los porcentajes de cepas resistentes aisladas del Grupo I frente a cada antimicrobiano se presentan en la figura 1, en la cual se puede observar que los mayores porcentajes se obtuvieron frente a oxitetraciclina con 84%, siguiéndole enrofloxacino, ciprofloxacino y ceftiofur con 54%. Más distante se ubica sulfametoxazol/trimetoprim con 16% de resistencia. Todas las cepas fueron sensibles a gentamicina, cefquinoma y cefoperazona.
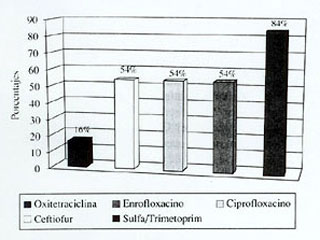 |
| Figura 1. Porcentaje de cepas
de E. coli aisladas de ganado de leche, resistentes a diferentes
antimicrobianos.
Percentages of E. coli strains isolated from dairy cattle with resistence to different antimicrobial agents. |
En la figura 2 se observan los porcentajes de cepas resistentes aisladas del Grupo II frente a cada antimicrobiano. En ella se puede observar que los porcentajes de resistencia en forma decreciente fueron de un 10% para sulfametoxazol/trimetoprim, 4% para oxitetraciclina, y un 3% para ceftiofur. Un 1% de las cepas presentó resistencia a cefquinoma, cefoperazona, ciprofloxacino y gentamicina, frente a enrofloxacino el total de las cepas fue sensible.
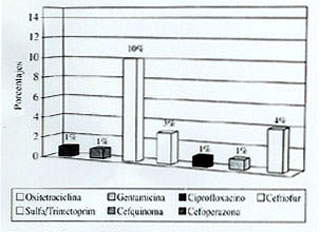 |
| Figura 2. Porcentaje de cepas
de E. coli aisladas de ganado de carne resistentes a diferentes
antimicrobianos.
Percentages of E. coli strains isolated from beef cattle with resistence to different antimicrobial agents. |
En el cuadro 3 se señalan los porcentajes de cepas resistentes frente a uno, dos o más antimicrobianos para ambos grupos de animales. El detalle de los perfiles de resistencia se describe en el cuadro 4; del total de cepas resistentes, en ganado de leche el perfil más frecuentemente observado fue oxitetraciclina/enrofloxacino/ciprofloxacino/ceftiofur con 53,48%, y en ganado de carne correspondió a sulfametoxazol/trimetoprim con 50%.
|
Cuadro 3. Porcentajes de cepas de E. coli resistentes a uno o más antimicrobianos para cada grupo de animales. Percentages of E. Coli strains from each animal group with resistence to one or more antimicrobial agents. |
|||||
|
|
|||||
| Número de Antimicrobianos | |||||
|
|
|||||
| Grupo | 1 | 2 | 3 | 4 | ³5 |
|
|
|||||
| I Ganado de Leche |
26,0% | 4,0% | 2,0% | 46,0% | 8,0% |
|
|
|||||
| II Ganado de Carne |
7,0% | 2,8% | _ | _ | 1,4% |
|
|
|||||
| Cuadro 4. Perfiles
de resistencia de E. coli aisladas de ganado de leche y ganado
de carne.
Resistance profiles of E. coli strains isolated from dairy and beef cattle. |
|||
|
|
|||
Grupo |
N° de cepas resistentes |
% de cepas resistentes |
Perfiles de multirresistencia |
|
|
|||
| Grupo I 43 cepas resistentes |
1 | 2,3% | Stx |
| 12 | 27,9% | Ot | |
| 2 | 4,6% | Stx-Ot | |
| 1 | 2,3% | Stx-Ot-Enr | |
| 23 | 53,48% | Ot-Enr-Cip-Xnl | |
| 4 | 9,3% | Ot-Enr-Cip-Xnl-Stx | |
|
|
|||
| Grupo II 8 cepas resistentes |
4 | 50% | Stx |
| 1 | 12,5% | Xnl | |
| 2 | 25% | Stx-Ot | |
| 1 | 12,5% | XnL-Cb-Cfp-Ot-Enr-Cip-Stx | |
|
|
|||
| Abreviaturas: Ab: Antimicrobiano Cb: Cefquinoma; Stx: Sulfametoxazol/trimetoprim,; Ot: Oxitetraciclina; Cfp: Cefoperazona; Enr: Enrofloxacino; Cip: Ciprofloxacino; Xln: Ceftiofur; Cn: Gentamicina. | |||
DISCUSION
De los resultados obtenidos se puede señalar, en general, que tanto el ganado bovino lechero como el destinado a carne en la Región Metropolitana no está ajeno de la problemática mundial de resistencia bacteriana, situación que también ha sido reportada en otras regiones del país (Borie y col 2000, San Martín y col 2002-2003).
El análisis de los resultados obtenidos en los dos grupos de animales estudiados nos muestra una situación diametralmente opuesta, dado que en ganado de leche existe un alto nivel de resistencia, mientras que en el ganado de carne se observa un bajo porcentaje de ésta. La diferencia entre ambos grupos puede atribuirse a diversas causas, entre las cuales se puede considerar el tipo de manejo a la que pertenecen estos grupos (intensiva-confinamiento en el caso del ganado lechero y extensiva en el caso del ganado destinado a carne) y la carga animal de ambos sistemas productivos; ambos factores pueden favorecer la diseminación de enfermedades bacterianas en el caso del ganado lechero.
La presentación de enfermedades y la edad promedio de vida son otros puntos que permiten discutir el porqué la diferencia de los niveles de resistencia de las bacterias aisladas desde ambos grupos. Las vacas de lechería presentan una mayor incidencia de enfermedades bacterianas como, por ejemplo, las mastitis clínicas, y su promedio de vida productiva y reproductiva es mayor, por lo que aumenta la posibilidad de exponerse a terapias antimicrobianas aumentando con ello la presión de selección hacia las bacterias.
Al analizar los porcentajes de resistencia para cada antimicrobiano, en particular, del total de las cepas obtenidas a partir de ganado lechero destaca la elevada resistencia frente a oxitetraciclina, situación que no se contrapone con estudios realizados a nivel internacional, destacándose países como Israel y Finlandia, en donde se han reportado altos valores de resistencia para este fármaco (Kaipainen y col 2001). Así también, a nivel nacional, se han reportado altos niveles de resistencia (superiores al 70%) en cepas de E. coli aisladas de mastitis clínica (San Martín y col 2000, Borie y col 2000). La baja sensibilidad se puede atribuir a la presión de selección resultante del intensivo uso de este fármaco en estos sistemas productivos, aun cuando en nuestro país no existen datos oficiales sobre qué cantidad se ha utilizado de esta droga, sí se sabe, que en estas últimas décadas ha sido empleada masivamente, ya que fue considerada primera línea de elección para muchas enfermedades de origen bacteriano en el ganado bovino. Actualmente oxitetraciclina es considerada como droga de segunda elección, debido a la gran capacidad que tienen las bacterias de generar resistencia a este fármaco (San Martín y col 2002).
Otro de los grupos de antimicrobianos incluidos en este estudio fueron las fluoroquinolonas; al respecto, enrofloxacino presentó un alto porcentaje de resistencia en ganado lechero, con 54%. Los resultados de este trabajo difieren con los obtenidos en el año 2000 en nuestro país, donde se observaron porcentajes de resistencia de tan sólo 4,5% en cepas de E. coli aisladas de mastitis clínica (San Martín y col 2000, Borie y col 2000). Posteriormente, otro estudio nacional, donde se aislaron cepas de E. coli en vacas lecheras con mastitis, reveló que la resistencia a enrofloxacino fue mayor en la V y Región Metropolitana con 21,9%, comparado con los porcentajes existentes en otras regiones del país (San Martín y col 2002).
A nivel internacional los niveles de resistencia a fluoroquinolonas difieren de país en país; en España, por ejemplo, los programas de monitoreo de resistencia bacteriana, que incluyen antimicrobianos, tales como ácido nalidíxico y ciprofloxacino, señalan que los niveles de resistencia detectados son bajos, siendo más elevados en aves que en cerdos. Por otro lado, en Israel y Finlandia cepas de E. coli aisladas de mastitis clínica bovina mostraron una alta sensibilidad a ciprofloxacino (Kaipainen y col 2001). Estudios realizados en otras especies animales revelaron que la prevalencia de cepas de E. coli resistentes a ciprofloxacino es significativamente alta en pavos y criaderos de cerdos (Van den Bogaard y Stobberingh 2000).
La resistencia a quinolonas es de especial interés tanto en medicina humana como en medicina veterinaria, dado que la situación se agrava aún más al demostrarse que las bacterias son capaces de generar resistencia cruzada con otros antimicrobianos de este grupo, aun cuando no hayan sido utilizados (Campbell 1992, Burns 1995). Esta situación también fue observada en este trabajo, ya que el 99% de las cepas resistentes a enrofloxacino lo fueron también a ciprofloxacino, fármaco de uso exclusivo en medicina humana. Este tipo de resultados ha causado alarma mundial, llevando a la instauración de normas estrictas sobre el uso de este tipo de drogas en producción animal. Es así como en países de la Unión Europea se ha prohibido la utilización de todos aquellos antimicrobianos que generen resistencia cruzada con aquellos que se utilizan en medicina humana (Moreno y col 2000). Al respecto, la FDA de Estados Unidos (Food and Drug Administration) con la colaboración del Centro de Control y Prevención de Enfermedades (CDC) y el Departamento de Agricultura de Estados Unidos (USDA), el año 2000, basándose en datos obtenidos de programas de monitoreo de resistencia a nivel nacional propuso el retiro de enrofloxacino en aves de corral.
En cuanto al grupo de las cefalosporinas, el único antimicrobiano al cual las cepas aisladas desde ganado lechero presentaron resistencia fue ceftiofur con 54%. Trabajos anteriores realizados en nuestro país señalan que los porcentajes de resistencia para cepas de E. coli aisladas de mastitis clínica fueron de 2,2 - 3,9 - 6,7% para cefquinoma, cefoperazona y ceftiofur respectivamente (San Martín y col 2002, Borie y col 2000). Al comparar ambos trabajos es importante considerar el aumento significativo de la resistencia a ceftiofur en tan sólo 3 a 4 años. Cuando se realizó el estudio descrito durante los años 2000 y 2001 (San Martín y col 2002) ceftiofur era una de las moléculas de reciente incorporación al mercado nacional. Esta situación fue revirtiéndose en estos últimos años, y su oferta de venta se expandió a otros laboratorios nacionales, motivo por el cual ha aumentado su uso favorablemente por parte de los médicos veterinarios; esto podría explicar el aumento de la resistencia a este fármaco.
Respecto a sulfametoxazol+trimetoprim, aun cuando los niveles de resistencia son bajos en ambos grupos, es importante tenerla presente, ya que esta situación podría cambiar si se intensifica su uso sin un criterio adecuado de selección.
En cuanto al resto de los antimicrobianos analizados, es importante destacar que todas las cepas aisladas de ambos grupos de animales fueron sensibles a gentamicina y a dos de las tres cefalosporinas estudiadas: cefquinoma y cefoperazona. Estudios internacionales han descrito frente a gentamicina resistencias menores al 10% en cepas de E. coli aisladas de mastitis clínicas (Kaipainen y col 2001). Estos resultados nos permiten sugerir que estos antimicrobianos pueden ser considerados como primera línea de elección frente a cuadros infecciosos por bacterias gramnegativas.
En cuanto a la multirresistencia se observó un alto porcentaje de ésta en las cepas aisladas de ganado lechero, siendo el perfil enrofloxacino/ciprofloxacino/oxitetraciclina/ceftiofur el más frecuentemente observado, con 53,48% de las cepas resistentes. Esta situación contrasta con lo observado en el ganado destinado a carne, en donde menos del 3% de las cepas fue resistente a dos o más antimicrobianos. La emergencia de cepas multirresistentes es un problema ampliamente distribuido a lo largo del planeta, tanto en cepas indicadoras como zoonóticas, siendo Salmonella typhimurium DT104 uno de los ejemplos más emblemáticos al respecto (Threllfall 2003).
De acuerdo a los resultados obtenidos en este trabajo, se sugiere que a nivel nacional deberían implementarse, en un corto plazo, líneas de trabajo orientadas al control y disminución de la resistencia bacteriana, controlando el uso y distribución de estos fármacos y estableciendo una red de vigilancia permanente de la resistencia antimicrobiana en medicina veterinaria. Al respecto, ya en el año 1999 Aaerestrup señaló que los mayores niveles de resistencia se observan en países donde no existen normativas de restricción en el uso de antimicrobianos, como es también el caso de Argentina (Gentilini y col 2000) y Brasil (Costa y col 2000).
NOTAS
Aceptado: 29.03.05.
# Financiamiento: Fondecyt 1030857.
* +56-2-6785613, bsmartin@uchile.cl. Casilla 2 Correo 15 La Granja, Santiago, Chile.
1 CEE/DIRECTIVA 97/6. 1997. UNION EUROPEA. http://europa.eu.int/index_es.htm2 CEE/DIRECTIVA 70/524. 1997. UNION EUROPEA. http://europa.eu.int/index_es.htm
REFERENCIAS
Aarestrup FM. 1999. Association between the consumption of antimicrobial agents in animal husbandry and the occurrence of resistant bacteria among food animals. Int J Antimicrob Agents 12, 279-285.
Aarestrup FM, F Bager, NE Jensen, M Madsen, A Meilyng, HC Wegener. 1998. Resistance to antimicrobials agents used for animal therapy in pathogenic, zoonotic and indicator bacteria isolated from different food animals in Denmark: a baseline study for the Danish Integrated Antimicrobial Resistance Monitoring Programe (DANMAP). APMIS 106 (8), 745-70.
Borie C, P Hernández, G Sierra, B San Martín. 2000. Patógenos mastitogénicos: etiología bacteriana y monitoreo de resistencia en lecherías de las regiones V y Metropolitana. En: XXII Congreso Chileno de Microbiología. Olmué, 5-7 de diciembre 2000.
Burns JL. 1995. Mecanismos de resistencia bacteriana. Actualización sobre antimicrobianos. Ped Clin North Am 5, 463-472.
BA Campbell. 1992. Penicilinas. Uso de antibióticos en obstetricia y Ginecología. Med Clin North Am 3, 427-439.
Codex Alimentarius, 2000. Programa conjunto FAO/OMS sobre las normas alimentarias. 12ª reunión del Comité del Codex sobre residuos de medicamentos veterinarios en los alimentos. Apéndice B, 1-13.
Costa EO, NR Benites, JL Guerra, PA Melville, 2000. Antimicrobial susceptibility of Staphylococcus spp. Isolated from mammary parenchymas of slaughtered dairy cows. J Vet Med B Infect Dis Vet Public Health 47, 99-103.
Emborg HD, OE Heuer. (2003). Use of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from food animals, foods and humans in Denmark. Statens Serum Institut, Danish Veterinary and Food Administration, Danish Medicines Agency, Danish Veterinary Institute, Copenhagen, Denmark, ISSN 1600-2032.
FDA. Food and Drug Administration. 2000. FDA/CVM Proposes to Withdraw Poultry Fluoroquinolones Approval. 26 octubre 2000. USA.
Gentilini E, G Denamiel, P Llorente, S Godaly, M Rebuelto, O DeGregorio. 2000. Antimicrobial susceptibility of Staphylococcus spp. Isolated from bovine mastitis in Argentina. J Dairy Sci 83, 1224-1227.
Kaipainen T, A Schwimmer, P Shpigel, T Honkanen-Buzalski, S Pyörälä. 2001. In Vitro Antimicrobial Susceptibility of Escherichia coli isolates originating from Clinical Bovine Mastitis in Finland and Israel. In: 2nd International Symposium on Mastitis and Milk Quality. Vancouver, Canada. 13-15 september 2001. National Mastitis Council - American Association of Bovine Practitioners. pp. 279-282.
Moreno MA, L Domínguez, T Teshager, IA Herrero, MC Porrero. 2000. Antibiotic resistance monitoring: The Spanish programme. The VAV Network. Int J Antimicrob Agents 14(4), 285-290.
NCCLS. National Commitee for Clinical Laboratory Standard. 1999. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Test for Bacteria Isolated from Animals; Approved Standard. Vol 19 (11). pp. 1-32.
OMS. Organización Mundial de la Salud. 1997. The medical impact of the use of antimicrobial in food animals. Berlin, Germany, 13-17 October.
OMS. Organización Mundial de la Salud. 2000. Overcoming antimicrobial resistance. World Health Organization. Report on Infectious Diseases. Geneve, Switzerland. 67 p.
Orskov F, 1984. Genus I Escherichia. In: Krieg, N.R., Holt, J. Bergey's Manual of Systematic Bacteriology. Editorial Board. Vol 1. pp 420-423.
SAG. Servicio Agrícola y Ganadero. Plan de Control de Residuos Año 2004. 25 p.
San Martín B, J Kruze, MA Morales, H Agüero, D Iragüen, S Espinoza, B León, B Borie. 2003. Antimicrobial resistance in bacteria isolated from dairy herds in Chile. J Appl Res Vet Med Vol. 1, Nº 1.
San Martín B, J Kruze, MA Morales, H Agüero, B León, S Espinoza, D Iragüen, J Puga, C Borie. 2002. Resistencia bacteriana en cepas patógenas aisladas de mastitis en vacas lecheras de la V Región, Región Metropolitana y X Región, Chile. Arch Med Vet XXXIV (2), 221-234.
San Martín B, J Kruze, B León, C Borie, H Cañón, G Sierra, P Hernández. 2000. Concentraciones mínimas inhibitorias para Escherichia coli aisladas de vacas con mastitis clínica de la Región Metropolitana. XI Congreso Nacional de Medicina Veterinaria. Santiago. Octubre 25-27.
Threlfall J. (2003). Antimicrobial drug resistance in Salmonella: problems and perspectives in food and water borne infections. FEMS Microbiol Rew 26, 141-148.
Van Der Bogaard AE, EE Stobberingh. 2000. Epidemiology of resistance to antibiotics: Links between animals and humans. Int J Antimicrob Agents 14(4), 315-319.