Cuadernos de Cirugía,
Vol. 15 N° 1, 2001, pp. 44-50
DOI: 10.4206/cuad.cir.2001.v15n1-09
CASOS CLÍNICOS
Tumores carcinoides bronquiales
Luis Jiménez V y Jean Michel Butte B. *
Servicio de Cirugía, Hospital Clínico
Regional de Valdivia.
Instituto de Cirugía, Facultad de Medicina, Universidad Austral de Chile.
* Interno de la carrera de Medicina de la Universidad Austral
de Chile.
Resumen
Los tumores carcinoides son la neoplasia neuroendocrina más frecuente. Son malignos, tienen un origen epitelial y derivan de las células de Kulchitsky. Cuando tienen un origen bronquial generalmente llevan a la muerte, dado su silencioso crecimiento. Su forma de manifestación es variada, siendo el dolor torácico su principal expresión, aunque pueden ser asintomáticos o sólo ser un hallazgo incidental en una radiografía de tórax. El principal tratamiento es la cirugía, no reportándose mejoría con quimioterapia ni radioterapia asociada. El pronóstico está dado por la histología tumoral, el grado de invasión, localización intrapulmonar y presencia de metástasis. En esta comunicación presentamos 3 casos clínicos de tumores carcinoides bronquiales, tratados en el Hospital Clínico Regional de Valdivia, cuya expresión fue variada.
Palabras claves: Carcinoides bronquiales.
key words: Bronchial carcinoids.
INTRODUCCIÓN
Los tumores carcinoides bronquiales (TCB), son neoplasias que derivan de las células de Kulchitsky, ubicadas en el epitelio bronquial, pertenecientes al sistema APUD1.
Según la clasificación de la OMS se incluyen dentro de los tumores epiteliales malignos1, representando entre un 0.6 a 5% de las neoplasias primitivas del pulmón2-4 y un 25% del total de tumores carcinoides5.
Presentan bajo grado de malignidad2, crecimiento lento1, invaden localmente, desarrollan metástasis a distancia y presentan recidiva locorregional3.
Se expresan a cualquier edad con mayor incidencia alrededor de los 50 años1-3.
Se manifiestan principalmente como infecciones respiratorias a repetición, disnea, y dolor torácico; el síndrome carcinoide es excepcional1.
El diagnóstico se realiza mediante confirmación histológica, la cual es característica, dividiéndose en típicos y atípicos. Además se puede complementar con inmunohistoquímica. Los carcinoides atípicos pueden ser difíciles de distinguir del cáncer de células pequeñas3,6.
La biopsia se puede obtener a través de fibrobroncoscopia, lo cual es controversial, dado la alta vascularización del tumor y el riesgo de sangrado2.
Además se pueden estudiar marcadores neuroendocrinos característicos que expresa el tumor, siendo una de las más importantes la enolasa neuroespecífica3. El tratamiento es quirúrgico3, presentando una sobrevida a 5 años de 77 a 96%5.
El objetivo de este trabajo es presentar 3 casos clínicos de pacientes portadores de tumores carcinoides bronquiales, tratados en el Hospital Clínico Regional de Valdivia.
CASOS CLÍNICOS
Caso 1. Mujer de 82 años, previamente sana, sin antecedentes tabáquicos, referida a nuestro hospital el 15 de Junio de 1995 por hipoglicemia sintomática refractaria y neumonía. Se trató con antibióticos por 10 días, pero persistió con hipoglicemia severa pese a infusión de glucosa hipertónica. Con tratamiento esteroidal y aportando elevados requerimientos de glucosa se logró estabilizar los valores de glicemia.
Se realizó medición de insulinemia simultánea a un episodio de hipoglicemia que reveló valores normales. Prueba de estimulación con ACTH fue concordante con insuficiencia suprarrenal.
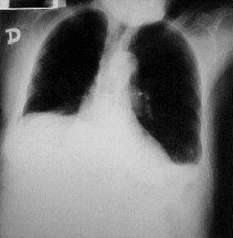
Pruebas tiroideas, función hepática y cortisol fueron normales. TAC de abdomen normal, radiografía de tórax (Figuras 1) y TAC de tórax (Figura 2) evidenciaron una masa en hemitórax derecho.
 |
FIGURA
1. Radiografía de tórax que muestra imagen densa de característica
tumoral en la base del hemitórax derecho. |
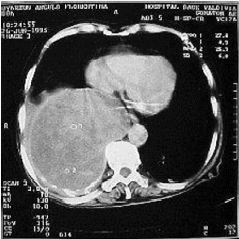 |
FIGURA
2. Tomografía axial computada en la cual se observa gran tumor sólido
en el lóbulo inferior derecho. |
Se realizó punción percutánea que informó presencia de células neoplásicas sugerentes de tumor neuroendocrino.
Fue intervenida quirúrgicamente el 28/8/ 1995, realizándose lobectomía pulmonar inferior derecha. Macroscópicamente se observó un gran tumor redondeado, bien delimitado y de crecimiento expansivo que midió 13 x 9 x 9 cm, conformado por tejido blanquecino homogéneo, de superficie lisa y brillante, que dejaba cavitaciones de tamaño variable entre 4 a 7 mm de diámetro, ocupadas por material mucoídeo. En la periferia del tumor se observaron calcificaciones espiculares sin compromiso pleural (Figura 3).
 |
FIGURA
3. Pieza quirúrgica que incluye lóbulo pulmonar derecho y tumor
carcinoide. |
Se diagnosticó tumor carcinoide típico pulmonar. El diagnóstico se certificó mediante técnicas de histoquímica, inmunohistoquímica y microscopía electrónica (Figuras 4, 5, 6 y 7).
Evolucionó satisfactoriamente con inmediata normalización de los niveles de glicemia, siendo dada de alta al séptimo día del postoperatorio, euglucida y con indicación de aporte dietético normal. Posteriormente no ha tenido controles.
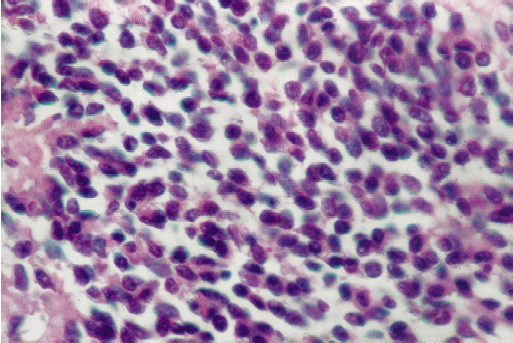 |
FIGURA
5. El mismo caso anterior que muestra con mayor detalle las características
celulares, los núcleos son de tamaño regular y con distribución
homogénea de la cromatina. (H-E 20x). |
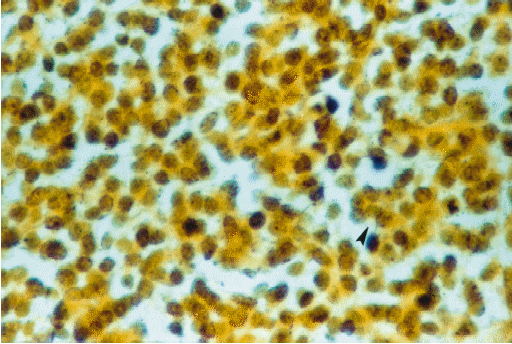 |
FIGURA
6. Histoquímica con técnica de plata que muestra positividad citoplasmática
para gránulos neurosecretorios (punta de flecha). (Grimelius 20x). |
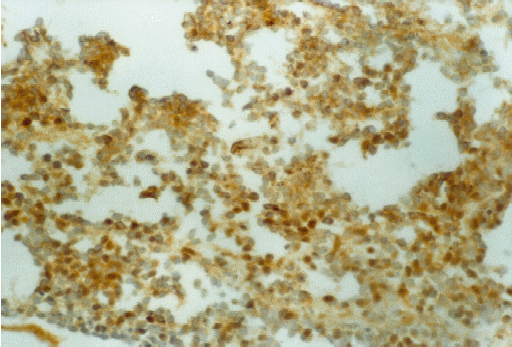 |
FIGURA
7. Inmunohistoquímica para enolasa neural específica: tinción positiva
difusa. (20x). |
Caso 2. Hombre de 34 años, domiciliado en Valdivia, sin antecedentes mórbidos, fumador de 2-3 cigarrillos al día. Consultó el 17/12/1996 en la Unidad de Emergencia del Hospital Base de Valdivia, por cuadro de tos asociado a hemoptisis ocasional, de aproximadamente 2 meses de evolución. No presentaba compromiso hemodinámico ni baja de peso objetivado. Sin alteraciones al examen físico. Dentro del estudio destacaba hemograma, VHS y perfil bioquímico normales. Radiografía de tórax mostró una imagen nodular en tercio superior de hemitórax izquierdo y TAC de tórax reveló una lesión tumoral de 4 x 4,6 x 5 cm, a nivel del segmento anterior del lóbulo superior izquierdo, que probablemente infiltra estructuras del hilio pulmonar correspondiente, sin poder descartar la presencia de adenopatías a ese nivel.
Con el estudio anterior se planificó una toracotomía exploradora, la que se realizó el 23/12/96. Se realizó lobectomía superior izquierda más resección de un linfonodo peribronquial. En el postoperatorio evolucionó en buenas condiciones generales, siendo dado de alta a los 9 días del postoperatorio.
El estudio anatomopatológico mostró 2 nódulos, uno de 5 x 4 cm y el otro de 7 x 2,1 cm en sus diámetros mayores, homogéneos, color blanco grisáceo, con algunas áreas de necrosis central y de aspecto abscedado. Se concluyó carcinoide atípico subpleural del lóbulo superior izquierdo con invasión endobronquial, necrosis focal y presencia de mitosis. El linfonodo peribronquial no se encontró comprometido. El diagnóstico se certificó mediante técnicas histoquímica, inmunohistoquímica y microscopía electrónica.
Se mantiene en controles esporádicos en el policlínico de cirugía, consultando nuevamente en Unidad de Emergencia del Hospital de Valdivia el 29/12/1997. En esa oportunidad refirió hemoptisis a repetición, que en el último episodio fue de 250 cc asociado a dorsalgia izquierda. El estudio mostró hemograma, perfil bioquímico y gases en sangre arterial normales. Radiografía de tórax que evidenció 5 nódulos en hemitórax izquierdo, en relación a mediastino y a la base pulmonar izquierda. El estudio se completó con TAC de tórax mostró múltiples imágenes nodulares parenquimatosas, subpleurales y obliteración parcial del bronquio fuente izquierdo, compatibles con recidiva tumoral. Cintigrafía ósea fue negativa para metástasis.
Dado lo anterior, se decidió presentar a comité de tumores, donde se acordó completar la neumonectomía izquierda. Esta se llevó a cabo el 19/1/1998 y, debido a dificultad del procedimiento, se resecó además un segmento de pericardio. Evolucionó satisfactoriamente en su postoperatorio.
El informe anatomopatológico mostró 3 masas tumorales, bien delimitadas del parénquima pulmonar. La de mayor tamaño midió 6 x 4 x 3,7 cm y comprometía el bronquio lobar sin alcanzar la sección quirúrgica; la segunda midió 7 x 3,5 x 3 cm y se ubicaba bajo el fragmento pericárdico; la tercera se ubicó a nivel del extremo basal anterior y midió 3 cm en su diámetro mayor. Se observó necrosis, compromiso de pleura visceral, parietal, infiltración endobronquial, permeación vascular y linfática. Por lo anterior, en comité de tumores se decidió sólo tratamiento sintomático.
Consultó el 11/5/1998 en Unidad de Emergencia del Hospital Base de Valdivia por síndrome de ocupación en hemitórax izquierdo. Se realizan 3 punciones que revelaron que la cavidad pleural estaba ocupada por una masa, planteándose nueva recidiva tumoral. Posterior a este episodio se controló en forma sintomática hasta su fallecimiento.
Caso 3. Hombre de 56 años, domiciliado en Valdivia, con antecedentes de diabetes mellitus no insulinodependiente, con dificultad para obtener normoglicemia y tabaquismo. Consultó el 28/11/1997, por cuadro de 4 días de evolución caracterizado por tos con expectoración mucopurulenta asociada a episodios hemoptoicos. No presentaba alteraciones al examen físico, por lo que se catalogó como bronquitis aguda y se indicó radiografía de tórax. Consulta nuevamente el 2/12/1997 junto a radiografía de tórax en la que se observa un nódulo pulmonar en base derecha de etiología incierta, por lo que se indicó TAC de tórax. En ésta se observan dos masas; la primera en el segmento superior del lóbulo inferior derecho y la segunda en el segmento basal posterior del mismo lóbulo. Se catalogó como neoplasia pulmonar derecha, realizándose el 19/1/1998 lobectomía inferior derecha más resección en cuña de segmento adherido del lóbulo superior derecho y ganglio peribronquial. Evolucionó en el postoperatorio en buenas condiciones, siendo dado de alta a su domicilio.
La histopatología mostró en el lóbulo inferior derecho un tumor de 6.5 x 5 x 4.5 cm, de crecimiento expansivo, coloración blanco amarillenta y con centro de coloración grisácea. Se concluye carcinoide bronquial atípico que no compromete pleura, bronquio lobar ni ganglio peribronquial.
Posteriormente se ha mantenido en buenas condiciones, asintomático, con controles de glicemias adecuados.
DISCUSIÓN
Los TCB corresponden a los tumores neuroendocrinos más frecuentes5. Fueron inicialmente descritos por Laennec en 1831. Posteriormente Kramer, en 1930, estableció su entidad clínica y patológica3. Hampel en 1937 los separó del resto de tumores benignos, denominándolos adenomas bronquiales3,5,6. En 1944, Engelbreth reconoció que algunos de ellos podían ser más agresivos6. Finalmente en 1968 Bensch demostró que sus células poseían gránulos neurosecretores y podían segregar diversas hormonas polipeptídicas7.
Tienen su origen de las células de Kulchitsky, que se originan de las células en la cresta neural8.
Se presentan a cualquier edad, con mayor frecuencia alrededor de los 50 años1-3, aunque se describen casos en ancianos y excepcionalmente en niños1,3. No presentan diferencias en relación al sexo1,3.
Poseen un estroma fibrovascular abundante, lo que favorece el sangrado2. Invaden localmente y desarrollan metástasis a distancia3, pudiendo presentar recidiva locorregional. Se asocian a otros tumores pulmonares en 11.5%5. Tienen similitud con el carcinoma pulmonar de células pequeñas que también se origina de las células de Kulchitsky. Ambos presentan gránulos neurosecretorios detectables a la microscopía electrónica, siendo más numerosos en el carcinoide4,8.
Se clasifican en típicos y atípicos, según los criterios de Paladugu3,6. El típico tiene hasta 2 mitosis por campo, ausencia de necrosis, razón núcleo/citoplasma baja, patrón celular organizado, moderada hipercromasia nuclear, bajo porcentaje de metástasis regionales y ausencia de metástasis a distancia. El atípico presenta áreas de actividad mitótica aumentada y posible existencia de necrosis, razón núcleo/ citoplasma alta, arquitectura desorganizada que puede coexistir con áreas de crecimiento organizadas, marcada hipercromasia nuclear, alto porcentaje de metástasis ganglionares, presencia de metástasis a distancia y mayor grado de invasión vascular3,4,6. Estos últimos no siempre son agresivos4. Lo más importante es el número de mitosis, que no están en todo el tumor, y el grado de necrosis6. Los atípicos presentan una tasa pequeña de muerte celular programada o apoptosis9.
Se distribuyen por igual en ambos pulmones3, localizándose el 75% en un bronquio lobar, 10% en un bronquio principal y el 15% restante en la periferia del pulmón1,2,5. El crecimiento lento hace que el intervalo entre la aparición de síntomas y el diagnóstico sea prolongado1. Un porcentaje significativo son asintomáticos, no siendo detectados durante la vida5.
Las manifestaciones clínicas dependen de la ubicación del tumor3. Los centrales presentan infecciones respiratorias a repetición, disnea, dolor torácico, fiebre y hemoptisis, lo que revela obstrucción por parte del tumor1,3,4 . Los periféricos generalmente son asintomáticos3. En 1-2% se pueden presentar como síndrome carcinoide, que es más frecuente en los atípicos. Esto obliga a descartar metástasis hepáticas1,3. Excepcionalmente puede manifestarse como síndrome de Cushing o hiponatremia como consecuencia de la producción ectópica de ACTH1,4. La patología asociada más frecuente es LCFA3. Generalmente el diagnóstico se facilita por la presencia de sustancias expresadas por el tumor, dentro de las cuales la enolasa neuroespecífica es uno de los mejores marcadores para evidenciar su origen neural, y la tinción de Grimelius y cromogranina para poner de manifiesto la presencia de gránulos neurosecretorios. Esto debe ser complementado con anticuerpos específicos para tumores neuroendocrinos y microscopía electrónica3.
El 75% se visualiza en la radiografía de tórax1. Lo más frecuente es el nódulo pulmonar solitario en 50% de los casos; además se puede observar masa hiliar, atelectasia o neumonía3. Se debe complementar con TAC, la que permite un estudio locorregional y de extensión tumoral3.
La TAC se debe complementar con fibrobroncoscopia. Esta permite una visualización directa del tumor, la que a veces es característica (masa color rojo cereza que procede de la submucosa)1,3. El aspecto endoscópico es sugerente de carcinoide en un 50% de los casos2. Además es posible obtener biopsia del tumor, lo que es discutido por el alto riesgo de sangrado que éste presenta2,4.
La biopsia permite el estudio anatomopatológico, lo que da el diagnóstico de certeza3. Tiene un rendimiento de 84.6% en manos expertas1 y permite diferenciar tumores carcinoides de carcinomas de células pequeñas. Esto tiene implicancia en el pronóstico y tratamiento2.
El tratamiento de elección es la cirugía1,3. La técnica a utilizar depende del tamaño, localización y agresividad, siendo la operación más frecuente la lobectomía3.
La neumonectomía es necesaria en casos de compromiso del bronquio principal, y cuando hay extenso compromiso parenquimatoso3.
La broncotomía permite la exéresis, de tumores pediculados, permitiendo preservar el parénquima funcionante3. La sección endobronquial por YAG láser es utilizada como medida paliativa en casos irresecables con obstrucción de la vía aérea central o en pacientes que no cumplen criterios quirúrgicos. Tiene una recidiva de 70%3.
Algunos autores asocian linfadenectomía completa, con mínima resección del parénquima pulmonar1.
No hay evidencia de la utilidad de quimioterapia o radioterapia, aunque podrían estar indicadas en carcinoide atípico asociado a metástasis a distancia6.
El pronóstico es bueno a largo plazo cuando la cirugía permite extirpar la totalidad del tumor3. En esto influye el tratamiento curativo, grado de invasión vascular, tamaño, tipo de tumor y presencia o ausencia de metástasis regionales o a distancia3,5. Son factores de mal pronóstico la tipificación histológica de carcinoide atípico, localización periférica del tumor, invasión vascular y la negatividad del marcador CD44s1.
En general presentan mejor sobrevida que otros tumores malignos pulmonares5, siendo ésta mejor en los típicos3. Esta puede ser de 77 a 96% a 5 años y de 83 a 84% a los 10 años1,3.
AGRADECIMIENTOS.
Los autores agradecen a la Dra. Rocío Sáenz por sus aportes en el estudio del Caso 1 y al Dr. Cristián Carrasco por la revisión del material histopatológico.
REFERENCIAS
1. Gómez de Terreros Caro FJ, Gómez Carrera L, Álvarez-Sala Walther R, et al: Tumor carcinoide intrabronquial. Presentación como asma bronquial de mala evolución. Rev Esp Enf Resp 2000; 3: 118-9
2. Actualizaciones SEPAR: Carcinoide bronquial: Diagnóstico por fibrobroncoscopia. Arch Bronconeumol 2001; 37: 150-2
3. Pareja E, Arnau A, Artigues E, et al: Tumores carcinoides bronquiales: Un estudio prospectivo. Arch Bronconeumol 1998; 34: 71-5
4. Hurt R, Bates M: Carcinoid tumours of the bronchus: A 33 year experience. Thorax 1984; 39: 617-23
5. Modlin I, Sandor A: An analysis of 8305 cases of carcinoid tumors. Cancer 1997; 79: 813-29
6. Paladugu R, Benfield J, Pak H, et al : Brochopulmonary Kulchitzky Cell Carcinomas. Cancer 1985; 55: 1303-11
7. Carriquiry G, Carusso E, Fernández I, et al: Tumores broncopulmonares poco frecuentes (excluido el carcinoma broncopulmonar). Cir Urug 1997; 67: 199-217
8. Anbazhagan R, Tihan T, Bornman D, et al: Classification of small cell lung cancer and pulmonary carcinoid by gene expresion profiles. Cancer Research 1999; 59: 5119-22
9. Laitinen K, Soini Y, Mattila J, et al: Atypical bronchopulmonary carcinoids show a tendency toward increased apoptotic and proliferative activity. Cancer 2000; 88: 1590-8