Cuadernos de Cirugía,
Vol. 15 N° 1, 2001, pp. 74-79
DOI: 10.4206/cuad.cir.2001.v15n1-14
ARTÍCULO DE ACTUALIZACIÓN
Marcadores de utilidad en cáncer mamario
María Teresa Poblete S.
Servicio de Anatomía Patológica,
Hospital Clínico Regional de Valdivia.
Instituto de Histología y Patología, Universidad Austral de Chile.
Resumen
Las características histopatológicas del cáncer de mama son fundamentales y permiten determinar el tipo histológico de la neoplasia, su tamaño, compromiso linfático, así como también el grado histológico y nuclear. Esta información puede ser complementada hoy en día con una variedad de proteínas, receptores y oncogenes, cuya expresión en el tumor nos permite clarificar el pronóstico de la neoplasia. Dentro de todos ellos, los factores más importantes a la fecha son el compromiso de los ganglios axilares y la expresión de receptores de estrógeno y progesterona que son determinados a través de análisis inmunohistoquímicos.
Palabras claves: Cáncer de mama; Receptor de estrógenos.
key words: Breast carcinoma; Estrogen receptor.
Los caracteres patológicos tradicionales que se estudian en forma rutinaria al momento del diagnóstico y que están relacionados con el comportamiento biológico del cáncer de mama, han demostrado ser de gran utilidad en la predicción de la sobrevida y sirven además de guía para las decisiones clínicas a tomar una vez realizado el diagnóstico. Tales factores, simples de realizar en una biopsia procesada de manera rutinaria, corresponden a parámetros histopatológicos que hoy en día están claramente establecidos y son conocidos por todos los patólogos quirúrgicos: el tamaño del tumor primario, el grado histológico, el grado nuclear y el estado de los ganglios axilares1-4.
Últimamente se ha observado un gran incremento en el estudio y el uso, como factores pronósticos, de númerosos otros antecedentes relacionados con el comportamiento biológico del tumor y que corresponden a la presencia o ausencia de receptores para hormonas esteroidales, como receptores para estrógenos y progesterona, ploidía, enzimas, factores de crecimiento, oncogenes y sus productos. El grado de expresión de estos marcadores en el tejido tumoral se analiza a través de procedimientos inmunohistoquímicos que persiguen averiguar en definitiva el grado de proliferación, malignidad y capacidad de invasión de las células neoplásicas5.
El interés clínico en estos factores pronósticos se relaciona con la posibilidad de delimitar a los pacientes en estadíos precoces de carcinoma mamario que tienen posibilidades ciertas de recidivar y aquellos que tienen posibilidades más remotas y, por lo tanto, pueden ahorrarse la terapia sistémica y su morbilidad.
Receptor de Estrógeno
Las hormonas esteroidales circulan en la sangre en forma libre o unidas a proteínas transportadoras, cruzan la membrana celular por difusión y se unen a proteínas localizadas en el núcleo o el citoplasma: los receptores esteroidales. Estos, al ser activados por las hormonas, se fosforilan y se convierten en receptores activos. Los receptores de hormonas esteroidales, principalmente el receptor de estrógeno y el receptor de progesterona, han sido utilizados y estudiados ampliamente como indicadores de pronóstico y como guías para la realización de la terapia hormonal. Entre un 50% a un 80% de los cánceres de mama expresan receptores de estrógenos. La frecuencia con la cual los tumores expresan receptores y la concentración de éstos se incrementa al aumentar la edad y alcanzan su mayor nivel en las pacientes postmenopáusicas6.
La presencia de receptores de estrógeno implica que los mecanismos celulares normales para procesar esta hormona se encuentran conservados a pesar de la transformación neoplásica, especialmente si conjuntamente se expresa el receptor de progesterona. El receptor de progesterona se expresa sólo después de la activación transcripcional de su gen por un complejo funcional receptor de estrógenoestrógeno.
La importancia clínica del receptor de estrógenos se relaciona con el hecho de que su presencia identifica tumores que son sensibles al tratamiento hormonal con el antagonista correspondiente. Cerca de un 50% a un 60% de los pacientes responden favorablemente a este tipo de terapia endocrina. Un porcentaje mayor de tumores responde si se expresan tanto el receptor de progesterona como el de estrógeno y la intensidad de tinción del receptor de estrógeno es alta. Es así como se ha observado que pacientes con tumores que expresan receptores de estrógenos tienen mayor sobrevida, un período mayor libre de enfermedad y una mayor sobrevida después de recaer cuando se les compara con pacientes que tenían tumores negativos para este receptor. Esta es una ventaja que es independiente del estado de los ganglios axilares. No obstante, la utilidad del receptor de estrógenos como valor pronóstico independiente, está disminuida por su asociación con otros indicadores de buen pronóstico. Los tumores positivos para el receptor de estrógenos generalmente tienen características histopatológicas de bajo grado, además de grado nuclear e índice de proliferación bajos. La influencia de la terapia en el pronóstico es difícil de excluir, porque los pacientes positivos para este receptor son habitualmente tratados y se benefician de la terapia hormonal, tanto en forma coadyuvante como paliativa6,7.
Al estudiar pacientes con metástasis axilares que no recibieron terapia coadyuvante, la sobrevida libre de enfermedad a cinco años fue un 20% más alta para pacientes que eran receptor de estrógeno positivos que para pacientes receptor de estrógeno negativos, sin embargo la sobrevida libre de enfermedad a cinco años en el grupo de mejor pronóstico (1 a 3 ganglios positivos) y receptor de estrógenos positivo fue no más del 60%. Entre los pacientes sin metástasis axilares se observan pequeñas diferencias, estadísticamente significativas, en sobrevida libre de enfermedad de un 8% a 12% entre casos receptor de estrógeno positivos y negativos.
Un análisis multivariado de factores pronósticos que incluyó los receptores hormonales para 3000 casos, demostró que los receptores estrogénicos son más importantes para el pronóstico que el tamaño tumoral en los casos sin metástasis ganglionares pero no en los casos con metástasis. Fisher y cols. demostraron que el estado de los receptores de estrógeno era menos importante para el pronóstico de la sobrevida libre de enfermedad o la sobrevida total que el número de ganglios positivos y el grado nuclear8.
Receptor del Factor de Crecimiento Epidérmico (EGFR)
Los factores de crecimiento inducen la proliferación celular al activar en forma específica los receptores correspondientes. Se ha encontrado sobreexpresión del receptor en una gran variedad de tumores; está presente en carcinomas mamarios y su expresión está inversamente relacionada con el estado de los receptores de estrógeno y progesterona. Aquellos tumores que son EGFR positivos tienen una respuesta disminuida a la terapia hormonal con tamoxifeno.
La frecuencia reportada de la positividad de este factor varía entre un 14% a 91% con un promedio de 45%. La importancia de este factor para el pronóstico no ha sido establecida aún, pero la mayoría de los estudios han reportado una disminución de la sobrevida libre de enfermedad en pacientes con EGFR positivos. El efecto negativo de la expresión de EGFR parece ser mayor en pacientes con metástasis axilares, pero también se conserva en forma significativa en pacientes con ganglios negativos.
Actualmente se encuentran en proceso de investigación algunas posibilidades terapéuticas relacionadas con estos factores. Se ha visto que ciertos tipos de agentes quimioterapéuticos como cisplatino y vinblastina inhiben la unión del factor de crecimiento epidérmico a su receptor in vitro. Experimentalmente se ha observado que el crecimiento de tumores epiteliales humanos puede ser inhibido mediante la administración intraperitoneal de un anticuerpo monoclonal contra EGFR5,6.
Catepsina D
Catepsina D es una proteasa lisosomal dependiente de estrógenos que se sintetiza en tejidos normales y es sobreexpresada y secretada por algunos tumores de mama. Su precursor proteico (pro-catepsina D) tiene actividad mitogénica y en un ambiente ácido ocasiona proteolisis de membranas basales, por lo que se ha postulado que esta enzima favorecería la invasión y el desarrollo de metástasis. Catepsina D está localizada en los lisosomas y fagolisosomas de las células de tumores mamarios y en macrófagos que se pueden encontrar en estos tejidos, como parte del infiltrado inflamatorio. Coincidentemente se ha observado que los niveles de catepsina D tienden a ser mayores en los casos con metástasis positivas. Niveles altos de esta enzima se encuentran en un tercio de los carcinomas mamarios. Su sobreexpresión está asociada con un alto riesgo de recurrencia y baja sobrevida, principalmente por su relación con el compromiso ganglionar. En casos de pacientes con ganglios negativos los resultados de estudios que sugerían que catepsina D podría discriminar entre grupos de pacientes sin metástasis, no pudieron ser comprobados en análisis de grandes casuísticas. Debido a estos resultados y probablemente a problemas de falta de estandarización, el rol actual de catepsina D, como un factor pronóstico independiente, es aún incierto6,7.
Indice Mitótico
El índice mitótico mide la proliferación celular directamente en cortes histológicos. La actividad mitótica se mide como el número de mitosis por un determinado número de campos ópticos (generalmente 10) de alto aumento en cortes teñidos en forma rutinaria. Una de sus mayores ventajas es que no requiere ningún tipo de tinción especial.
Protooncogenes
Hasta el momento, y en relación con el cáncer de mama, se han estudiado varios protooncogenes con el objeto de establecer su probable valor pronóstico. Los protooncogenes son genes normales comprometidos con el crecimiento y la proliferación celular, cuyas formas mutadas promueven la transformación neoplásica. Incluye c-erb-B2, c-myc, y c-ras.
El más estudiado (en relación con carcinomas) es probablemente c-erb-B2. El producto de este gen es un receptor glicoproteico de transmembrana, estructuralmente similar a EGFR. También se le ha denominado factor de crecimiento epidérmico humano-2 (HER2). Es un componente proteico de las células epidérmicas normales, está patológicamente incrementado en una variedad de cánceres y especialmente en algunas formas de cáncer de mama. Su amplificación resulta en sobreexpresión del receptor celular de membrana6,9.
Diversos estudios han demostrado que un 25-30% de todos los cánceres de mama sobreexpresan c-erb-B2. Los datos sugieren que los tumores con estos caracteres presentan también un mayor crecimiento de células tumorales y producen metástasis con mayor rapidez que los tumores que no presentan sobreexpresión. La patogenia estaría dada porque la proteína HER2 mediaría la transformación de las células normales en tumorales, transmitiendo señales de crecimiento desde la membrana celular al núcleo aumentando la división celular. No se ha encontrado sobreexpresión en los carcinomas lobulillares pero sí se encuentra, más a menudo, en el componente in situ de los carcinomas ductales que en el componente invasor.
La sobreexpresión del gen está relacionada con un mal pronóstico en grupos de pacientes con metástasis axilares, en los que ha sido también relacionado con resistencia a la quimioterapia combinada (ciclofosfamida, metotrexato y 5-fluorouracilo) y con resistencia a la terapia hormonal6,10,11.
P53
Los genes supresores de tumores difieren de los oncogenes porque normalmente funcionan frenando la proliferación celular, la pérdida de actividad de éstos, ya sea por mutación o deleción, puede conducir a un crecimiento celular sin restricciones.
El gen supresor tumoral p53, está localizado en el brazo corto del cromosoma 17, y actúa inhibiendo la progresión de las células desde la fase G1 a la fase S en el ciclo celular. Tiene una función reguladora negativa de la proliferación celular y se cree que funciona bloqueando las células en G1 o induciendo apoptosis. La proteína nuclear que normalmente codifica, tiene un período vital corto demasiado breve para ser detectado en las células, pero la proteína que produce la P53 mutante dura más tiempo y puede ser detectada por métodos inmunohistoquímicos. La expresión del p53 mutante es el defecto más común encontrado en las neoplasias humanas. Está fuertemente relacionado con otros marcadores de alta proliferación (alto grado nuclear, sobreexpresión de c-erb-B2, aneuploidía y receptores estrogénicos negativos), pero es independiente de la edad, estado ganglionar y tamaño tumoral11.
Con relación al tipo histológico de cáncer se ha descrito una frecuencia significativamente mayor en los carcinomas ductales mal diferenciados y en aquellos tumores de alto grado nuclear. Baja frecuencia de inmunoreactividad se ha encontrado en el carcinoma tubular, papilar, lobulillar puro y en tumores mixtos, lobulillar y ductal. Por el contrario, en el carcinoma medular existe alta frecuencia de reactividad. En síntesis, la expresión de p53 mutante tiene una influencia negativa en la sobrevida total y la sobrevida libre de enfermedad en el caso del cáncer de mama12-14.
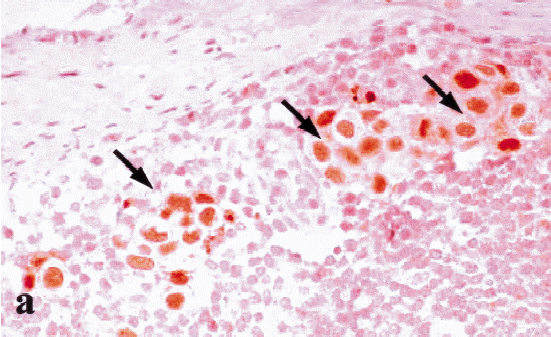
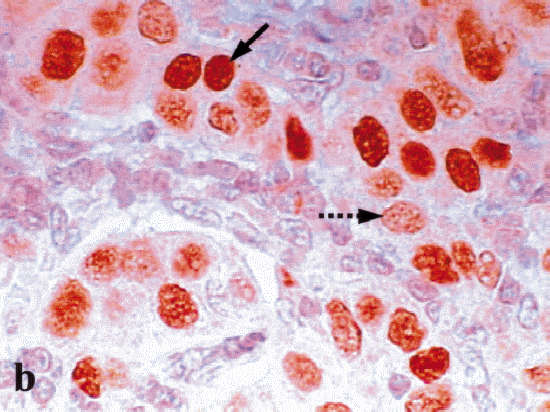
Ki-67 es un anticuerpo monoclonal que identifica un antígeno nuclear que se encuentra en células en las fases proliferativas del ciclo celular (G1, S, G2 y M). No identifica células en la etapa de descanso (G0). Su expresión también es frecuentemente evidenciada por métodos inmunohistoquímicos. Los nuevos anticuerpos que se han desarrollado actualmente permiten su identificación en tejidos fijados y en biopsias procesadas en forma rutinaria. Altos índices de Ki-67 están asociados con una baja diferenciación histológica y con la ocurrencia de metástasis ganglionares. Un estudio de Veronese y cols., quienes usaron el 20% de las células con tinción nuclear como límite entre índices de proliferación alta y baja, encontró que este marcador predijo la sobrevida a cuatro años independientemente del estado ganglionar y del estado de los receptores de estrógeno. Al estudiar un grupo de pacientes con metástasis axilares se encontró una diferencia significativa en la sobrevida libre de enfermedad en los pacientes que tenían Ki-67 positivo y receptores estrogénicos negativos al compararlos con el grupo de Ki-67 negativo y receptores estrogénicos positivos6,15.
Antígeno Celular de Proliferación Nuclear PCNA/ciclina es un antígeno nuclear asociado con la proliferación celular que también puede ser usado como marcador pronóstico. Los niveles de PCNA/ciclina se correlacionan con Ki-67, con el antígeno asociado a estrógeno, y su expresión tiene similares implicancias.
Marcadores de Angiogénesis
El interés en la vascularización del tumor como factor pronóstico se inició como consecuencia del trabajo de Weidner y cols.16 en angiogénesis tumoral y por la posibilidad que esto planteaba de elaborar tratamientos con agentes que frenaran la multiplicación de los vasos sanguíneos que irrigan al tejido neoplásico. La capacidad angiogénica de los tejidos mamarios neoplásicos y preneoplásicos está bien documentada. Esta propiedad del tejido tumoral probablemente está relacionada con la producción de factores angiogénicos como el factor de crecimiento vascular endotelial (VEGF), y el factor de crecimiento básico fibroblástico. El crecimiento tumoral aumenta no sólo por la mayor perfusión asociada a revascularización, sino que además por los efectos de los factores de crecimiento producidos por las células endoteliales. La importancia pronóstica de la angiogénesis tumoral fue publicada por Weidner y cols.16, quienes contaron vasos sanguíneos (venas y arterias) en 49 carcinomas invasores, restringiéndose a las áreas más vascularizadas y encontraron un incremento significativo en el número y densidad en aquellos casos que presentaron metástasis ganglionares y a distancia. La frecuencia de metástasis a distancia se incrementaba al aumentar el conteo vascular. En algunos estudios la alta densidad vascular se ha relacionado con una pobre diferenciación histológica en carcinomas ductales invasores y con mayor posibilidad de metástasis axilares.
Otros autores han relacionado la alta densidad vascular con un mayor tamaño del tumor primario y con expresión de catepsina D por el tumor17,18. Otros investigadores han tenido resultados variables, sin poder establecer una relación significativa con el pronóstico, lo que ha llevado a considerar que en el estado actual la cuantificación de la microcirculación no es una contribución importante para el manejo de los pacientes.
Finalmente en la Tabla 1 se resume la significancia pronóstica de algunos factores relevantes en el cáncer de mama.
Factor
pronóstico |
Favorable |
Desfavorable |
| Metástasis axilares Ganglios positivos Ganglios mamaria interna Tamaño tumoral Grado histológico Grado nuclear Receptor estrogénico Receptor progesterona Células en fase S Ploidía Indice mitótico HER-2/neu (c-erb-b2) P53 Ki-67 PCNA/ciclina Catepsina D |
(-) 1-3 (-) 1 cm o menos Bien diferenciado 1 Positivo Positivo Baja Diploide Bajo Ausente Ausente Bajo Bajo Bajo |
(+) 4 o más (+) Más de 1 cm Mal diferenciado 3 Negativo Negativo Alta Aneuploide Alto Presente Presente Alto Alto Alto |
REFERENCIAS
1. Contesso G, Mouriesse H, Friedman S, et al: The importance of histologic grade in long-term prognosis of breast cancer: A study of 1,010 patients, uniformly treated at the Institut Gustave–Roussy. J Clin Oncol 1987; 5: 1378-86
2. Fisher ER, Constantino J, Fisher B, Redmond C: Pathologic findings from the National Surgical Adjuvant Breast Project (Protocol 4). Cancer 1993; 71: 2141-50
3. Gardner B, Feldman J: Are positive axillary nodes in breast cancer markers for incurable disease?. Ann Surg 1993; 218: 270-8
4. Poblete MT: Factores pronóstico en cáncer de mama. Cuad Cir 1994; 8: 60-6
5. Rosen PP, Lesser ML, Arroyo CD, Cranor M, Borgen P, Norton L: P53 in node negative breast carcinoma: An immunohistochemical study of epidemiological risk factors, histological features and prognosis. J Clin Oncol 1995;13: 821-30
6. Rosen PP. Breast pathology. Biological markers of prognosis. Lippincott-Raven,1997: 308.
7. Donegan WL: Prognostic factors: Stage and receptor status in breast cancer. Cancer 1992; 70: 1755-64
8. Alfred DC, Bustamante MA, Daniel CO: Immunocytochemical analysis of estrogen receptors in human breast carcinomas: Evaluation of 130 cases and review of the literature regarding concordance with biochemical assay and clinical relevance. Arch Surg 1990; 125: 107-13
9. Di Giuseppe J, Yeo Ch, Hruban R: Molecular biology and the diagnosis and treatment of adenocarcinoma of pancreas. Advances in Anatomic Pathology 1996; 3: 139-55
10. Tetu B, Brisson J: Prognostic significance of HER-2/neu oncoprotein expression in nodepositive breast cancer: The influence of the pattern of immunostaining and adjuvant therapy. Cancer 1994; 73: 2359-65
11. Muss HB, Thor AD, Berry DA: C-erbB-2 expression and response to adjuvant theraphy in women with node positive early breast cancer. N Engl J Med 1994; 330: 1260-6
12. Harris CC, Hollstein M: Clinical implications of the p53 tumor suppresor gene. N Engl J Med 1993; 329: 1318-27
13. Marks JR, Humphrey PA, Wu K: Overexpression of p53 and HER-2/neu proteins as prognostic markers in early stage breast cancer. Ann Surg 1994; 219: 332-41
14. Davidoff AM, Herndon JE, 2nd, Glover NS. Relation between p53 overexpression and estableshed prognostic factors in breast cancer. Surgery 1991; 110: 259-64
15. Veronese SM, Gambacorta M, Gottardi O: Proliferation index as a prognostic marker in breast cancer. Cancer 1993; 71: 3926-31
16. Weidner N, Semple JP, Welch WR, Folkman J: Tumor angiogenesis and metastasis correlation in invasive breast carcinoma. N Engl J Med 1991; 324: 1-8
17. Hurwitz M, Sawicki M, Samara G, Passaro Ejr: Diagnostic and prognostic molecular markers in cancer. Am J Surg 1992; 164: 299-306
18. Mansour EG, Ravdin PM, Dressler: Prognostic factors in early breast carcinoma. Cancer 1994; 74: 381-400