Cuadernos de Cirugía,
Vol. 16 N° 1, 2002, pp. 77-86
DOI: 10.4206/cuad.cir.2002.v16n1-13
ARTÍCULO DE ACTUALIZACIÓN
Cicatrices hipertróficas y queloides
Christian Salem Z, Alejandra Vidal V, Pablo Mariangel P *, Miguel Concha M.
Institutos de Cirugía e Histología
y Patología, Facultad de Medicina, Universidad Austral de Chile.
Servicio de Cirugía, Hospital Clínico Regional de Valdivia.
* Interno de la carrera de medicina, Universidad Austral de
Chile.
Resumen
La cicatrización hipertrófica y queloídea han sido un problema para los cirujanos desde épocas muy antiguas; muchos factores han sido involucrados como etiológicos y se han propuesto múltiples tratamientos. Sin embargo, el tema no está resuelto, ningún tratamiento es completamente seguro y la investigación continúa día a día. El objetivo del presente trabajo es hacer una revisión conceptual e histórica de esta alteración cicatricial, haciendo hincapié en los factores predisponentes, métodos de prevención, opciones terapéuticas existentes actualmente y perspectiva futuras.
Palabras claves: Hypertrofic Scar; Queloide; Etiología de la cicatrización hipertrófica; Prevención de cicatrización hipertrófica; Tratamiento del queloide.
Key words: Cicatriz hipertrófica; Keloid; Etiology of hipertrophic scar; Prevention of hypertrophic scar formation; Treatment of keloid.
INTRODUCCIÓN
Una cicatrización exagerada ya fue descrita en el Papiro de Smith alrededor del año 1700 antes de Cristo1 , pero no fue hasta los años 1770 en que Retz y 1802 en que Alibert2 , describieron este cuadro. Mancini en 1962 y Peacock en 1970, definieron cicatriz hipertrófica, como una cicatriz excesiva que sobresale encima del nivel cutáneo y cuyos límites se mantienen confinados dentro de la lesión original, mientras que en el queloide, estos límites sobrepasan la lesión original.
La incidencia de cicatrización queloídea es difícil de determinar. Cosman et al3 , en una revisión de tres grandes series, encontraron una incidencia basada en impresión clínica, de entre 4.5 y 16% en una población predominantemente negra e hispana. Oluwasanmi encontró una incidencia de 6.2% en una población de 4877 personas, en una comunidad rural africana. La incidencia de cicatrización hipertrófica seguramente es más elevada que la de queloides, pero no se encuentran cifras en la literatura.
CONCEPTOS Y CLÍNICA
La cicatriz hipertrófica y el queloide son patologías o desórdenes fibroproliferativos de la dermis, que se presenta sólo en humanos y que ocurren después de una cirugía, quemadura, inflamación o cualquier tipo de trauma.
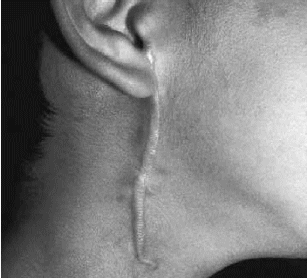
La cicatriz hipertrófica es una lesión fibrosa, eritematosa, levantada y pruriginosa que se forma dentro de los bordes iniciales de una herida, habitualmente en un área de tensión. Suelen tener un patrón de regresión espontánea, aunque sea parcial y tiene poca tendencia a la recidiva pos extirpación quirúrgica (Figura 1).
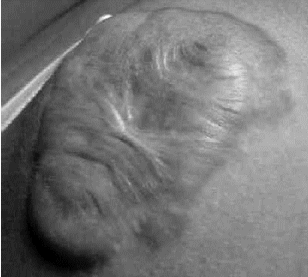
La cicatriz queloídea es una lesión con aspecto tumoral, color rojo rosado o púrpura y a veces hiperpigmentada. Los contornos están bien demarcados, pero son irregulares, sobrepasando los márgenes iniciales de la herida. El epitelio sobre la lesión es delgado y puede presentar áreas focales de ulceración. Puede presentar prurito y dolor. Raramente regresa en forma espontánea y la recidiva es muy frecuente pos extirpación quirúrgica (Figura 2).
 |
| FIGURA
1. Cicatriz hipertrófica. |
 |
FIGURA
2. Cicatriz queloídea. |
Existen varios factores predisponentes de cicatrización queloídea, entre los cuales tenemos; predisposición genética, edad joven, razas negras, grupo sanguíneo A, ubicación de la herida en hombros, dorso, región preesternal o áreas de tensión cicatricial. Contrariamente existen áreas no queloídeas, como por ejemplo párpados, genitales, palmas de las manos y plantas de los pies.
Como se puede apreciar en la Tabla 1 y Figura 3, existen muchas diferencias entre cicatriz hipertrófica y queloídea: diferencias histopatológicas4, fisiopatológicas, clínicas y evolutivas5 .
 |
HISTOPATOLOGÍA
En una cicatriz normal reciente se puede observar una proliferación de fibroblastos en una matriz extracelular laxa, en forma paralela a la superficie cutánea. Los vasos sanguíneos son prominentes. En la medida que la cicatriz madura, el colágeno es más eosinofílico y los fibroblastos disminuyen en número6.
Cicatriz
hipertrófica |
Cicatriz
queloídea |
| 1 Más frecuentes en superficie de flexión (articulaciones, abdomen) | Más frecuente en orejas, hombros, región preesternal, etc. |
| 2 Casi siempre en zonas de tensión | No se relaciona directamente con tensión cutánea |
| 3 Aparece precozmente después de la cirugía | Puede aparecer meses después de la cirugía |
| 4 Tamaño se relaciona con la injuria
|
Tamaño es desproporcionado respecto a la injuria |
| 5 Límites dentro de la cicatriz inicial | Límites sobrepasan la cicatriz inicial
|
| 6 Tendencia a mejorar espontáneamente con el tiempo | No mejora con tiempo de evolución |
| 7 Desaparece con terapia compresiva | No desaparece con terapia compresiva |
| 8 Recidiva rara después de cirugía | Recidiva frecuente pos cirugía |
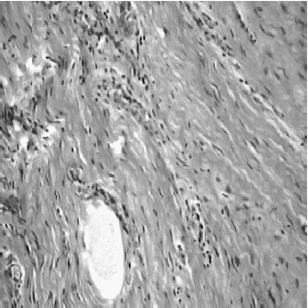
En una cicatriz hipertrófica se pueden observar espirales de tejido fibroso inmaduro de la dermis. Se observan áreas focales de colágeno maduro mezcladas con zonas de estroma mixoídeo6 (Figura 4).
 |
FIGURA
4. Cicatriz hipertrófica. Se aprecian bandas de colágeno más delgadas
y con infiltrado inflamatorio. H-E 200X. |
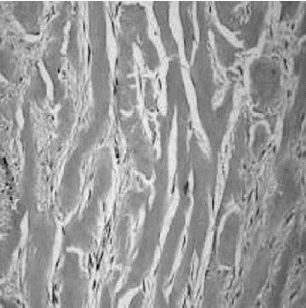
En los queloides se observa una epidermis sin mayores cambios. Los queratinocitos se observan en una disposición normal, con núcleos bien teñidos. La dermis papilar muestra signos de atrofia y el límite con la dermis reticular está poco definido. Se observan amplios paquetes de fibras colágenas de diferente grosor y orientación irregular, que tienden a formar nódulos que son rodeados por tejido conectivo dando un aspecto de cápsula septada (Figura 5). En la porción central de los nódulos puede haber hialinización. Se pueden observar muchas células en la dermis reticular, especialmente fibroblastos activados, mastocitos y capilares pequeños. No existen folículos pilosos ni tejido elástico y los conductos sudoríparos se encuentran más profundos en la dermis.
 |
FIGURA
5. Queloide. Se observan bandas gruesas de colágeno hialinizado.
H-E 200X. |
A la microscopía electrónica, las formaciones nodulares están compuestas de colágeno compacto intersticial reducido. Entre éstos se pueden observar procesos citoplasmáticos con abundantes filamentos intracelulares y cisternas del retículo endoplasmático rugoso. Los vasos sanguíneos presentan su lumen parcial o totalmente ocluido. La lámina basal se encuentra engrosada. Los fibroblastos tienen una forma estrellada con grandes procesos citoplasmáticos (filipodias) y un núcleo lobulado en el centro de la célula. En los procesos citoplasmáticos se puede observar con frecuencia la presencia de colágeno intracelular. Existen numerosas células plasmáticas perivasculares con gránulos intracelulares.
Con técnicas histoquímicas es posible distinguir algunas características de los queloides. Con anticuerpos monoclonales contra el antígeno nuclear de proliferación celular (PCNA) se puede observar que los queloides expresan una alta densidad de éste y que es mantenida en el tiempo, lo que indica una actividad proliferativa continua7 . Se ha observado también que existe una relación inversa entre la presencia de células fusadas dérmicas CD 34+ y la síntesis de colágeno tipo I en los queloides, cuyo significado no está aún aclarado. Otro marcador de actividad y proliferación es la tinción de plata de las regiones nucleolares, que es mayor en los fibroblastos de los queloides comparados con los fibroblastos de piel normal.
En queloides que presentan prurito se ha estudiado la presencia de miofibroblastos y mastocitos, observando que ambos tipos celulares se encuentran aumentados en número y estrechamente relacionados. Los mastocitos presentan signos de degranulación y existe edema en la matriz extracelular vecina. Estos datos sugieren un rol de estas células en la patogénesis y sintomatología de los queloides8.
FISIOPATOLOGÍA
La formación de cicatrices hipertróficas y queloides está siempre precedida de una prolongación y/o exageración en la fase inflamatoria de la cicatrización. Esto lleva a un incremento en la síntesis de citoquinas fibrogénicas, lo que a su vez se traduce en un aumento en la presencia de matriz extracelular, lo cual es la base en la fisiopatología de estos desórdenes. Este aumento en la matriz extracelular puede deberse a un incremento en la síntesis de colágeno, fibronectina y otros proteoglicanos o a una disminución en la degradación de estas proteínas de matriz con una alteración en la remodelación de las mismas. En realidad, parece que los dos mecanismos están involucrados en la presencia de estas alteraciones. Tanto la cicatriz hipertrófica como los queloides se caracterizan por tener un aumento importante en las fibras de colágeno que además están organizadas de una manera aleatoria, lo que implica el defecto en la remodelación. Asimismo, las cicatrices hipertróficas poseen un número muchísimo mayor de mastocitos que las cicatrices normales, los cuales con su liberación de histamina, son responsables del prurito, el eritema y el edema de estas lesiones.
El mecanismo por medio del cual se ve aumentada la cantidad de colágeno no es por un aumento en el volumen total de fibroblastos, sino por un aumento en su producción de proteínas de matriz (colágeno), lo cual se ha documentado mediante estudios experimentales que muestran un incremento en el RNAm encargado en parte de la producción de dichas sustancias. Asimismo, se ha podido documentar el hecho de que la degradación en estas proteínas de matriz está disminuida. El RNAm encargado de parte de la síntesis de colagenasas está disminuido en estos tejidos, lo que se manifiesta con una disminución en la síntesis de colagenasas. Esto se va a traducir en que el colágeno viejo y aumentado quede reparado de manera aleatoria, sin una degradación ni organización adecuadas (remodelación). La alteración en la remodelación de la cicatriz también se ve alterada por una diferencia en la composición de los proteoglicanos de la herida. Estas heridas suelen tener una mayor concentración de versicán, un proteoglicano que aumenta el contenido de agua en la cicatriz, alterando el proceso de reorganización de las fibras de colágeno, traduciéndose en la presencia de un tejido más rígido. Asimismo la disminución en la concentración del proteoglicano decorin afecta la remodelación, pues no va a permitir la formación de fibras más finas de colágeno.
Los factores de crecimiento son sustancias indispensables en la modulación de los procesos durante la cicatrización. Específicamente se ha encontrado que el FCDP, el FCT BETA y el factor de crecimiento parecido a la insulina (FCPI) de una parte estimulan la proliferación y migración fibroblástica y la síntesis de colágeno, y de otra disminuyen la acción de las colagenasas reduciendo su producción. Estos factores de crecimiento, bajo circunstancias normales, estimulan la granulación de heridas; sin embargo cuando la fase inflamatoria está prolongada, su presencia no sólo aumenta en concentración sino que además persiste por un tiempo más prolongado, casos en los cuales tiene un efecto deletéreo sobre dichos procesos9-11.
Como factores autorregulatorios antifibróticos, se ha encontrado la acción del Interferón I y II (IFN I-II), del cual existen receptores universales en prácticamente todas las células. Al fijarse a los receptores de los fibroblastos, inhiben las tasas de transcripción de algunos genes que, específicamente en los fibroblastos, se traduce en una disminución en la tasa de proliferación fibroblástica y una disminución en la síntesis de colágeno y fibronectina. Esta es una de las herramientas que podrían utilizarse en la prevención de estos desórdenes12-14.
ALTERNATIVAS TERAPÉUTICAS
I Tratamiento preventivo
Si bien algunos queloides se desarrollan sobre sitios de trauma o infección y llegan a nosotros una vez establecidos, nuestro deber es prevenir aquellos en que el cirujano interviene, o sea nuestras cirugías diarias.
Primero que todo debemos estar atentos a pacientes o heridas con alto riesgo de desarrollar una cicatrización queloídea. Se trata de pacientes de raza negra, antecedentes personales o familiares de alteraciones cicatriciales, cierres cutáneos a tensión, cicatrices ubicadas en región preesternal, lóbulo de oreja u hombros y heridas que presentaron una cicatrización retardada.
En todas las cirugías y especialmente en aquellas con algunos factores de riesgo para desarrollar cicatriz hipertrófica o queloídea, debemos tomar las siguientes precauciones5 :
1. Evitar intervenciones
quirúrgicas en área de mayor incidencia de cicatrización queloídea, como
por ejemplo hombros, dorso, región pectoral.
2. Especiales cuidados en paciente morenos o de raza negra.
3. Orientar las incisiones cutáneas según las líneas de fuerza de la piel.
4. Manipular la piel en forma atraumática.
5. Evitar o disminuir el número de electrocoagulaciones.
6. Suturar las incisiones con el mínimo de tensión posible.
7. Evitar todos aquellos elementos que favorezcan la inflamación: cuerpos
extraños, material de sutura inadecuado, etc.
8. Tomar todas las medidas posibles para prevenir la infección quirúrgica.
9. Tratamiento compresivo de cicatrices de riesgo (presoterapia):
- Ropa compresiva.
- Geles de silicona.
- Clips auriculares.
10. Corticoides intralesionales,
en casos seleccionados, de tendencia a hipertrofia clínica de la cicatriz.
11. Control y observación periódica de evolución cicatricial.
II Curativo
Múltiples son las alternativas de tratamiento que se han utilizado para los queloides, todas con distintos grados de éxito y recurrencias. La principal dificultad para su análisis es la falta, en la mayoría de los estudios, de métodos estandarizados de tratamiento y de medición de los resultados. A continuación se revisarán algunas de las alternativas terapéuticas utilizadas en la actualidad y otras recientemente propuestas.
A) Tratamientos quirúrgicos
La excisión quirúrgica simple de los queloides se asocia a tasas de recurrencia de 50 a 100%15, por lo que es una alternativa actualmente en desuso. Esta tasa de recurrencia se puede disminuir en parte al utilizar técnicas de colgajos de rotación que disminuyan la tensión en la zona afectada.
Por definición propia del queloide, la cirugía puede únicamente concebirse asociada a otros tratamientos, dado que ésta ocasionará una reactivación del proceso inflamatorio. Permite esencialmente reducir el volumen del queloide, lo que permite disminuir las dosis de los tratamientos complementarios. Son posibles diferentes métodos quirúrgicos5.
Exéresis-sutura extraqueloídea
Se trata de una exéresis de todo el tejido queloídeo, que debe realizarse en tejido sano a ras del tejido queloideo, salvo en profundidad donde hay que quitar ampliamente los anexos pilosebáceos que pueden ser causa de una reactivación posterior del queloide.
Exéresis-sutura intraqueloídea
La exéresis debe ser estrictamente intraqueloídea, no sólo en la periferia, tal y como generalmente se efectúa, sino también en las capas profundas. Esto quiere decir que se deja dermis patológica en la periferia y en las capas profundas. Así, la posibilidad de reactivar el proceso inflamatorio sería mínima, a costa de obtener un resultado estético de menor calidad. Una exéresissutura estrictamente intraqueloídea se puede plantear teóricamente de manera aislada. En la práctica, se asocia generalmente a un tratamiento complementario.
Exéresis-injerto del queloide
En caso de un queloide de gran tamaño, principalmente de placa queloídea, la exéresis del queloide deja una pérdida de sustancia cutánea que debe ser recubierta por un injerto de piel. Este injerto puede ser extraído del queloide resecado, lo que resulta difícil cuando el queloide no es plano, y conduce a un resultado estético generalmente mediocre. El injerto de piel puede ser extraído de manera clásica de la parte interna del muslo. Debe entonces imperativamente ser lo más fino posible con el fin de evitar el desarrollo de un queloide sobre la zona donante.
Nótese que los otros métodos plásticos (colgajos locales, expansión cutánea y plastia en Z múltiples) se desaconsejan pues todos pueden ocasionar nuevos queloides.
B) Corticoides intralesionales
Es una de las terapias más utilizadas en la actualidad, en especial con acetónido de Triamcinolona. Los reportes respecto a su efectividad son muy variables, estimándose en un 50% de acuerdo a diversos estudios. El efecto de esta terapia sería la inhibición de la transcripción de ciertos genes de proteínas de la matriz extracelular (procolágeno α1 (I) y α1 (III), fibronectina, TGF - β y otras citoquinas), además de reducir la síntesis de α- macroglobulina, un inhibidor de la síntesis de colagenasa. También se ha observado que produce una disminución en la viscosidad de la matriz extracelular. Entre los efectos adversos del tratamiento con inyección intralesional de corticoides se pueden mencionar: dolor en el sitio de la inyección, el que puede ser disminuido por la infiltración simultánea de un anestésico local y con velocidad de inyección muy lenta, atrofia cutánea, telangectasias, necrosis, ulceración y Síndrome de Cushing.
La Triamcinolona intralesional también se ha utilizado en combinación con otros métodos como cirugía convencional16, criocirugía e Isotretinoína, mejorando los rendimientos publicados para cada técnica por separado.
La Triamcinolona inyectable que se comercializa en Chile bajo los nombres de Kenacort A® y Lederspan®, si bien cumple los objetivos básicos, no es 100% ideal por ser de baja concentración, siendo mejor para el
tratamiento concentraciones de 40 mg/ml. La dosis de Triamcinolona inyectable localmente va a depender de la edad y de la superficie queloídea, la cual se resume en Tabla 2 y su aplicación debe ser repetida en varias oportunidades, con intervalos de 1 a 3 semanas, según la evolución clínica de la lesión.tratamiento concentraciones de 40 mg/ml. La dosis de Triamcinolona inyectable localmente va a depender de la edad y de la superficie queloídea, la cual se resume en Tabla 2 y su aplicación debe ser repetida en varias oportunidades, con intervalos de 1 a 3 semanas, según la evolución clínica de la lesión.
Edad del
paciente y tamaño de la lesión |
Dosis
(mensual) |
| Niños 1 a 5 años 6 a 10 años |
40 mg - dosis máxima
80 mg - dosis máxima g |
| Adultos Lesión de 1 a 2 cm2 Lesión de 2 a 6 cm2 Lesión mayor de 6 cm2 |
20 a 40 mg 40 a 80 mg 80 a 120 m |
C) Presoterapia
Sólo es eficaz en los queloides jóvenes y para prevenir las recidivas después de exéresis quirúrgicas. Posee una acción antiinflamatoria, principalmente antiedematosa. La presión ejercida debe ser superior a los 25 mmHg, permanente y prolongada de 6 meses a 1 año. Si la presoterapia es preventiva, se observa mejoría en tres de cada cuatro casos17. Algunas zonas se prestan fácilmente a este procedimiento, como por ejemplo la región frontal, preesternal, hombros y extremidades; mientras que en otras es más difícil de practicar, como por ejemplo la región cervical o la región inguinal.
Se utilizan diferentes medios5:
Ropa compresiva
Debe adaptarse perfectamente a la región del cuerpo por tratar.
Geles de Silicona
Deben aplicarse como mínimo durante 12 de las 24 horas y ser diariamente lavados con el fin de que no irriten. Cada placa puede utilizarse durante unas dos semanas. Debe recordarse el tamaño de la cicatriz rebasándola de 1 ó 2 cm.
Su efectividad se ha estimado en aproximadamente un 60%, en especial cuando son utilizados en cicatrices recientes. También se ha utilizado en forma de gel líquido o crema, con iguales o mejores resultados.
 |
FIGURA
6. Gel de Silicona. |
 |
FIGURA
7. Lámina de Silicona. |
No existe una explicación clara respecto al mecanismo de acción de estos geles en la cicatrización, pero dada la similar efectividad de las cremas o gel líquido, descartaría su acción solamente de presión mecánica. Algunos autores sostienen que el efecto terapéutico estaría dado por la generación de corriente estática por parte de los parches oclusivos, hecho que se ha reproducido en modelos experimentales, con resultados promisorios18.
Clips auriculares
Son muy útiles después de cualquier cirugía de exéresis del lóbulo de la oreja. La presión ejercida también debe ser superior a 25 mm de Mercurio
D) Radioterapia
A pesar de que algunos equipos la utilizan de manera aislada19,20, la radioterapia se aplica por lo general inmediatamente después de la cirugía21. La respuesta a la radiación sola va desde un 10% a un 24%, con un promedio de éxito de un 56%. La cirugía seguida de radiación tiene un índice de éxito mayor que la radiación sola22 con un rango entre 25% a 100% de éxito y un promedio de 76%. Tras haber examinado todos los casos en los casi 30 años de experiencia de los autores, el riesgo cancerígeno parece extremadamente bajo, pero existe23.
En la actualidad se utilizan dos métodos5 :
Radioterapia superficial. La dosis utilizada varía entre 12 y 16 Gy. Se fracciona en tres a cinco sesiones repartidas en 1 a 2 semanas28. Se inicia pocos días después de la exéresis quirúrgica. Como con la corticoterapia, las recidivas aparecen generalmente en el primer año que sigue al tratamiento. Sus contraindicaciones son el uso durante la niñez, el embarazo y la proximidad de órganos radiosensibles.
Curie terapia. Se practica con hilo o línea de Iridio 192. La sutura debe ser lo más lineal posible, con el fin de poder introducir el tubo guía en la dermis de la cicatriz. Para cualquier riesgo de migración del hilo en el tejido subcutáneo, debe efectuarse un plano dérmico profundo en caso de exéresis extra queloídea. Se pasan a continuación en la piel algunos puntos separados.
El hilo de Iridio se introduce entonces en el interior del tubo guía pocas horas después de la intervención quirúrgica, administrando dosis de 12 a 20 Gy en un radio de 2,5 mm. Se retira el hilo después de la irradiación, que dura entre 1 a 2 días. Los resultados estéticos de este procedimiento no son siempre óptimos, produciendo a veces cicatrices anchas, discrómicas o con telangectasias locales.
Esta forma de radioterapia con Iridio intralesional, ha sido la más utilizada en la actualidad, demostrando ser efectiva en la prevención de recurrencias post-extirpación quirúrgica de queloides, con un éxito aproximado a 63% con dosis de 12 a 15 Gy.
Se presume el mecanismo de acción de la radioterapia es la estenosis vascular, lo que impediría la acción del sistema monocitomacrófago y la activación de la cascada de citoquinas involucradas. Hay controversia acerca del riesgo de este tratamiento, al publicarse casos aislados de carcinoma de mama en zonas subyacentes a radioterapia de queloides pectorales24.
E) Crioterapia
La crioterapia con nitrógeno liquido ha sido utilizada como monoterapia y como complemento a la terapia con corticoides intralesionales, con resultados variables, con porcentajes de éxito entre 51% a 80% de efectividad, siendo mejores en cicatrices de menos de 2 años de evolución25.
La combinación de crioterapia más corticoides intralesionales, mostró éxito en 84% de los pacientes26.
F) Tranilast
El ácido N-(3,4-dimetoxicinamoil) antranílico, Tranilast, es un inhibidor de la síntesis de colágeno dosis dependiente, afectando por igual al octágeno tipo I como tipo III, interfiriendo el efecto del TGF-b a nivel Pre traducción del mRNA del procolágeno-a27. Administrado originalmente por vía oral en dosis de 300 mg/día para el tratamiento del broncoespasmo alérgico, ha sido utilizado en forma tópica por iontoforesis y a través de vehículos mejorados, obteniéndose promisorios resultados.
G) Bleomicina
Existen publicadas experiencias con el uso de Bleomicina, Interferón-α 2b e Hidrocoloides con resultados contradictorios.
La Bleomicina es una mezcla de antibióticos glucopéptidos producidos por el Streptomyces verticilius utilizado como agente citotóxico en quimioterapias de ciertos tumores, tales como linfomas y carcinomas escamosos, y como agente sellante en derrames pleurales de origen maligno.
Existen trabajos nacionales que mostraron una reducción de un 36% del volumen de los queloides después de 3 dosis y de 66% después de 5 a 8 dosis de Bleomicina local28.
Algunos autores internacionales tienen reducción del volumen queloideo y aplanamiento de éste con porcentajes de éxito que van desde el 75% al 100%29.
J) Láser
Se ha utilizado el láser de colorantes pulsado de 585 nm, que daña selectivamente la microvasculatura de las lesiones sin producir nuevas cicatrices, reduciendo en forma importante el eritema, prurito y el volumen de las lesiones tratadas, sin recurrencias a 6 meses de observación30,31.
K) Otras terapias
Existen trabajos aislados con buenos resultados en tratamiento de cicatrices hipertróficas y queloides, con diferentes productos, tales como 5-Fluoracilo32, Putrescina tópica (Fibrostat®)33, Acido Retinoico34, Oxido de Zinc35, Tetrahydroquinona, Centella Asiática36 y Verapamilo37.
Todos estos productos requieren un mayor número de investigaciones para certificar científicamente su utilidad38.
I) Campo futuro
Al igual que en las demás alteraciones de la cicatrización, se requiere de un conocimiento más profundo sobre todos los mecanismos celulares y moleculares que se llevan a cabo, para así conseguir desarrollar terapias más efectivas. Pueden utilizarse sustancias que antagonicen el efecto fibroblástico de los factores de crecimiento (anticuerpos antimonoclonales, antagonistas de receptores, etc.). También son beneficiosos los bloqueadores de producción de colágeno y otros proteoglicanos. Sin embargo, es importante entender que se debe trabajar sobre la regeneración de la piel por ingeniería genética pues es la única terapia que nos va a permitir alcanzar resultados perfectos en todos los aspectos de la cicatrización.
En relación a los factores de crecimiento, los autores se encuentran en una investigación prospectiva acerca del uso de factores de crecimiento epidérmicos en la inhibición de la multiplicación de fibroblastos, mecanismo fisiopatológico etiológico de cicatriz queloídea, esto basado en observaciones clínicas en que la extirpación de un queloide, seguida de cobertura del área cruenta con injertos de piel muy fina, irían asociados a una tasa muy baja de recidiva.
REFERENCIAS
1. Berman B, Bieley HC: Keloids. J Am Acad Dermatol 1995; 3: 117-23
2. Alibert JLM: Description des maladies de la peau observees a l’Hospital Saint-Lauest et exposition des meilleures. Methods suives pour leur traitment. Paris: Barrios l’ Aine et Fils, 1806; 113
3. Cosman B, Crikelair GF, Ju DM, Gaulin JC, Lattes R: The surgical treatment of keloids. Plast Reconstr Surg 1961; 27: 335
4. Blackburn WR, Cosman B: Histologic basis of keloid and hypertrophic scar differentiation. Arch Pathol 1966; 82: 65
5. Gerbault O: Encyclopédie Médico-Chirurgicale, Cirugía plástica, reparadora y estética. Paris, Ediciones Elsevier, 2000; 14
6. From L, Assaad D: Neoplasm, pseudoneoplasm and hyperplasia of supporting tissue origin. In: Dermatology in General Medicine. Philadephia, Mc Graw-Hill, 1993; 1198-9
7. Nakaoka H, Miyauchi S, Miki Y: Proliferating activity of dermal fibroblast in keloids and hypertrophic scars. Acta Derm Venereol 1995; 75: 102-4
8. Lee YS, Vijayasingam S: Mast cells and myofibroblasts in keloid: a light microscopic, inmunohistochemical and ultrastructural study. Ann Acad Med Singapore 1995; 24: 902-5
9. Curso Avanzado para Cirujanos. Santa Fé de Bogotá, Ediciones FELAC: Herida e Infección Quirúrgica. 1999; 60-3
10. Brody GS, Peng STJ, Landel RF: The etiology of hypertrophic scar contracture: another view. Plast Reconstr Surg 1981; 67: 673-84
11. Linares HA, Larson DL: Early differential diagnosis between hypertrophic and nonhypertrophic healing. J Invest Dermatol 1974; 62: 514-6
12. Calderón M, Lawrence WT, Banes AJ: Increased proliferation in keloid fibroblasts wounded in vitro. J Surg Res 1996; 61: 343-7
13. Niesen FB, Andriessen MP, Schalkwijk J, Visser L, Timens W: Keratinocyte-derived growth factors play a role in the formation of hypertrophic scars. J Pathol 2001; 194: 207-16
14. Lawrence WT: In search of the optimal treatment of keloids: Reports of a series and a review of the literature. Ann Plast Surg 1991; 27: 164-78
15. Sherris DA, Larrabee WF, Murakami CS: Management of scar contractures, hypertrofic scars, and keloids. Otolaryngol Clin North Am 1995; 28: 1057-68
16. Sclafani AP, Gordon L, Chadha M, Romo T: Prevention of earlobe keloid recurrence with postoperative corticosteroid inyections versus radiation theraphy: A randomized, prospective study and review of the literature. Dermatol Surg 1996; 22: 569-74
17. Igarashi A, Nashiro K, Kikuchi K, Ssto S, Ihn H, Fujimoto M, et al: Connective tissue growth factor gene expresión in tissue sections from localized scleroderma, keloid, and other fibrotic skin disorders. J Invest Dermatol 1996; 106: 729-33
18. Hirshowitz B, Lindenbaum E, Har-Shai Y, Feitelberg L, Tendler M, Katz D: Static-electric field induction by a silicone cushion for the treatment of hypertrophic and keloid scars. Plast Reconstr Surg 1998; 101: 1173-83
19. Norris JE: Superficial x-ray theraphy in keloid management: A retrospective study of 24 cases and literature review. Plast Reconstr Surg 1995; 95: 1051-5
20. Doornbos JF, Stoffel TJ, Hass AC, Garner L, Lucente FE: The role of kilovoltage irradiation in the treatment of keloids. Int J Radiat Oncol Biol Phys 1990; 18: 833-9
21. Chaudhry MR, Akhtar S, Duvalsaint F, Garner L, Lucente FE: Ear lobe keloids, surgical excision followed by radiation theraphy: A 10- year experience. Ear Nose Throat J 1994; 73: 779-81
22. Darzi MA, Chowdri NA, Kaul SK, Khan M: Evaluation of various methods of treating keloids and hypertrofic scars: a 10-year follow-up study. Br J Plast Surg 1992; 45: 374-9
23. Borok TL, Bray M, Sinclair I, Plafker J, LABIRTH L, Rollins C: Role of ionizing irradiation for 393 keloids. Int J Radiat Oncol Biol Phys 1988; 15: 865-70
24. Escarmant P, Zimmermann S, Amar A, Ratoanina JL, Moris A, Azaloux H, et al: The treatment of 783 keloid scars by iridium 192 interstitial irradiation after surgical excision. Int J Radiat Oncol Biol Phys 1993; 26: 245-51
25. Zouboulis CC, Blume U, Buttner P, Orfanos CE: Outcomes of cryosurgery in keloids and hypertrophic scars. A prospective consecutive trial of case series. Arch Dermatol 1993; 129: 1146-51
26. Layton AM, Yip J, Cunliffe WJ: A comparison of intralesional triamconolone and cryosurgery in the treatment of acne keloids. Br J Dermatol 1994; 130: 498-501
27. Yamada H, Tajima S, Nishikawa T, Murad S, Pinnell SR: Tranilast, a selective inhibitor of collagen sintesis in human keloid fibroblasts. J Biochem (Tokyo) 1994; 116: 892-7
28. Hono JP, Hasson A: Uso de bleomicina en inyección intralesional en el tratamiento de los queloides. Trabajo de Investigación. Santiago, Pontificia Universidad Católica de Chile, Facultad de Medicina, Hospital Clínico, Unidad de Dermatología, 2000; 1-30
29. España A, Solano T, Quintanilla E: Bleomycin in the treatment of keloids and hypertrophic scars by multiple needle punctures. Dermatol Surg 2001; 27: 23-7
30. Alster TS, Handrick C: Laser treatment of hypertrofic scar, keloid and striae. Semin Cutan Med Surg 2000; 19: 287-92
31. Dierickx C, Goldman MP, Fitzpatrick RE: Laser treatment of erythematous / Hypertrofic and pigmented scars in 26 patients. Plast Reconstr Surg 1995; 95: 84-90
32. Uppal RS, Khan U, Kakar S, Talas G, Chapman P, McGrouther AD: The effects of a single dose of 5- fluorouracil on keloid scars: a clinical trial of timed wound irrigation after extralesional excision. Plast Reconstr Surg 2001; 108: 1218-24
33. Dolynchuck KN, Ziesmann M, and Serletti JM: Topical putrescine (fibrostat) in treatment of hypertrophic scars: phase II study. Plast Reconstr Surg 1996; 98: 752
34. Panabiere-Castaings MH: Retinoic acid in the treatment of keloids. J Dermatol Surg Oncol 1988; 14: 1275-6
35. Sodeberg T, Hallmans G, and Bartholdson L: Treatment of keloids and hypertrofic scars with adhesive zinc tape. Scand J Plast Reconstr Surg 1982; 16: 261-6
36. El-Hefnawi H: Treatment of keloids with asiaticoside. Dermatologica 1962; 125: 387
37. D’Andrea F, Brongo S, Ferraro G, Baroni A: Prevention and treatment of keloids with intralesional verapamil. Dermatology 2002; 204: 60-2
38. Murray JC: Scars and keloids. Dermatol Clin 1993; 11: 697-708