Cuadernos de
Cirugía, Vol. 19 N° 1, 2005, pp. 47-53
DOI: 10.4206/cuad.cir.2005.v19n1-08
CASOS CLÍNICOS
Cáncer de mama y embarazo. A propósito de un caso
Juan Antonio Pérez P, John Bohle O, Ximena Neira M.
Instituto de Cirugía,
Facultad de Medicina, Universidad Austral de Chile.
Unidad de Patología Mamaria, Hospital Clínico Regional de Valdivia.
RESUMEN
El cáncer de mama durante el embarazo es una circunstancia clínica infrecuente. Esta asociación plantea interrogantes en lo referente al manejo de la madre en su condición fisiológica especial y la seguridad del feto. Presentamos el caso de una mujer de 42 años en la cual durante el primer trimestre de su primer embarazo se pesquisó un carcinoma mamario izquierdo multifocal. No tenía antecedentes de cáncer mamario familiar ni hereditario. La biopsia percutánea reveló carcinoma ductal invasor que fue estadificado como T2 N0 M0 Estadio IIa. A las 15+4 semanas de embarazo se realizó una mastectomía simple extendida con disección axilar del primer nivel de Berg y posteriormente inició a las 23+3 semanas 4 ciclos de quimioterapia con Doxorrubicina 60 mg /m2 día 1 y Ciclofosfamida 600 mg/m2 día 1 cada 21 días, 3 ciclos durante el embarazo y 1 posparto cesárea que tuvo lugar a las 35+6 semanas de gestación. Luego de finalizado el esquema de quimioterapia, el tratamiento se completó con teleterapia. La paciente y el feto evolucionaron satisfactoriamente. A los 7 meses posparto la madre se encuentra en buenas condiciones y el hijo está eutrófico y su desarrollo psicomotor es normal para su edad. Se revisa la literatura sobre el tema, abordando aspectos relevantes de este evento con especial énfasis en los procedimientos diagnósticos y en las opciones de tratamiento.
Palabras claves: Cáncer mama; Embarazo; Cirugía; Quimioterapia; Radioterapia.
Key words: Breast cancer; Pregnancy; Surgery; Chemotherapy; Radiation therapy.
INTRODUCCIÓN
El cáncer de mama y embarazo es definido como aquel carcinoma de la glándula mamaria que se diagnostica durante la gestación o durante el primer año del posparto. Se trata de una situación infrecuente, que es diagnosticada en aproximadamente 1 de cada 3.000 partos1,2. Su incidencia varía entre el 0.76% a 3.8% de todos los casos nuevos de cáncer de mama3. Corresponde a la neoplasia maligna más común asociada con la gestación4 y aunque el número es relativamente bajo, se espera que a futuro aumente debido a que cada vez es mayor el número de mujeres que postergan su primer parto hasta la cuarta o quinta década de su vida, período en el cual se incrementa la incidencia de cáncer de mama5 .
Las pacientes embarazadas afectadas por el cáncer típicamente manifiestan un tumor mamario indoloro y con menor frecuencia descarga por el pezón5,6.
La pesquisa de un cáncer de mama durante el embarazo (CMDE) es compleja transcurriendo, en algunas oportunidades, varios meses antes de su confirmación diagnóstica7,8. Este retraso diagnóstico se atribuye a varias razones en las que destacan los cambios fisiológicos que ocurren en las mamas durante embarazo por la influencia hormonal9 y la presunción de enfermedad benigna por parte del médico y/o de la paciente. Por otra parte, la mamografía no se realiza rutinariamente porque estas mujeres generalmente se encuentran bajo la edad en que este examen se recomienda como screening, aparte de que su rendimiento es limitado por la gran densidad de la glándula y además el procedimiento podría ser riesgoso para el feto 10.
Una vez que se ha confirmado el diagnóstico, el manejo del CMDE debe ser multidisciplinario. Se deben evaluar las modalidades terapéuticas actualmente disponibles, los beneficios y riesgos tanto de la cirugía radical y conservadora, de la quimioterapia neoadyuvante y coadyuvante y de la radioterapia para posteriormente informar a la paciente y a su familia11. La radioterapia está contraindicada durante el embarazo por riesgo de irradiación al feto. El aborto no mejora el pronóstico del CMDA y no está recomendado excepto en situaciones muy especiales12.
Una vez que se ha establecido el estadio del cáncer, la edad de gestación y discutido el plan terapéutico escogido, su aplicación no debe aplazarse por la coexistencia con el embarazo.
El objetivo de esta comunicación es dar a conocer el caso clínico de una paciente portadora de un embarazo asociado a un cáncer de mama que fue manejado en nuestro hospital y discutir algunos aspectos de esta interesante entidad clínica.
CASO CLÍNICO
Mujer de 42 años, portadora de displasia de cadera derecha secundaria a poliomielitis que a mediados de enero del 2004 se palpó en forma accidental un nódulo mamario izquierdo asintomático. Acudió a un Consultorio Externo desde donde fue derivada a la Unidad de Patología Mamaria. Donde fue evaluada el 16 de marzo de 2004. Entre sus antecedentes ginecoobstétricos destacó menarquia a los 14 años, un parto de término a los 35 años, lactancia de 24 meses sin complicaciones, FUR el 1 de febrero de 2004. No refirió antecedentes de cáncer de mama familiar ni hereditario. En el examen físico mamario se encontró un nódulo en cuadrante superointerno de la mama izquierda, de 2 cm de diámetro, de consistencia elástica, móvil e indoloro. No se encontraron adenopatías axilares ni cervicales sospechosas de malignidad.
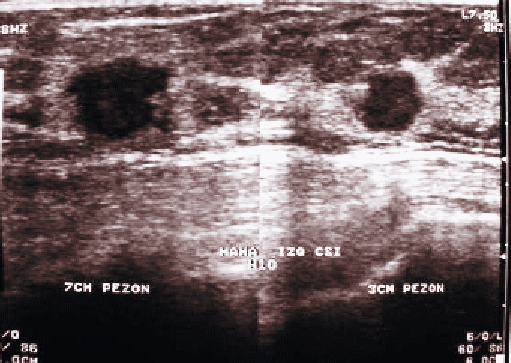
Por antecedente de atraso menstrual se solicitó una ecotomografía mamaria y prueba de embarazo cuyo resultado de esta última fue positivo. El 5 de mayo de 2004 se realizó ecotomografía que mostró 2 imágenes nodulares hipoecogénicas, de contornos irregulares, con tamaño de 2,1 x 1,7 cm y de 1,2 por 0,8 cm ambas ubicadas en el cuadrante superointerno izquierdo, a 7 y 3 cm del pezón respectivamente, resto del examen sin alteraciones (Figura 1). Se realizó biopsia percutánea del tumor clínico que concluyó carcinoma mamario ductal invasor, grado II de Elston, grado nuclear intermedio. Los receptores de estrógeno mostraron positividad débil en el 20% de las células neoplásicas y de progesterona positividad nuclear moderada a intensa en el 80% de las células neoplásicas.
 |
FIGURA
1. Ecotomografía mamaria que muestra en cuadrante superointerno
de la mama izquierda dos imágenes nodulares hipoecogénicas con bordes
irregulares. |
El 18 de mayo 2004 se presentó al Comité de Tumores con los diagnósticos de carcinoma ductal invasor multifocal mama izquierda T2 N0 M0 Estadio IIa, embarazo de 15+2 semanas y displasia de cadera derecha. Como conducta terapéutica se sugirió practicar una mastectomía simple extendida, quimioterapia postoperatoria y radioterapia luego del parto.
La paciente aceptó el plan de tratamiento sugerido y previa evaluación anestesiológica y ginecológica, el 20 de mayo 2004 se realizó una mastectomía simple extendida con disección axilar del primer nivel de Berg. En el postoperatorio evolucionó satisfactoriamente.
La evaluación ginecológica del 4 de junio 2004 confirmó un embarazo de 15+4 semanas, concordante con la FUR y la ecotomografía obstétrica. En esa fecha se conoció el informe de la biopsia lenta que reveló cáncer de mama multifocal en cuadrante superinterno mama izquierda, tumor 1: cáncer mamario con células osteoclásticas, tamaño 2,6 por 2 por 1,3 cm, grado de diferenciación 2 de Elston, grado nuclear alto; tumor 2: cáncer mamario ductal invasor e intraductal, tamaño: 1,7 x 1,2 x 1cm; contenido axilar 13 linfoganglios negativos.
Previa evaluación clínica y de laboratorio que incluyó hemograma, perfil bioquímico, ecotomografía obstétrica y ecocardiografía que resultaron normales, el 5 de agosto de 2004 (23+3 semanas) se inició el primero de 3 ciclos de quimioterapia con esquema de Doxorrubicina 60 mg /m2 día 1 y Ciclofosfamida 600 mg/m2 día 1 cada 21 días.
A las 35+6 semanas de embarazo (6 de octubre de 2004) se interrumpió la gestación por vía alta, obteniéndose un recién nacido de sexo masculino, de 2500 g de peso, talla 46 cm, es decir con edad y peso acorde a la edad gestacional. Simultáneamente con la cesárea se realizó esterilización tubaria. Madre e hijo evolucionaron sin complicaciones. No hubo lactancia.
El 5 de noviembre de 2004 se administró su 4º ciclo de quimioterapia y posteriormente entre el 15 de diciembre de 2004 y el 26 de enero de 2005 recibió teleterapia con acelerador lineal 6 MV a la pared torácica izquierda con 2 campos tangenciales. Dosis día 180 cGy. Total 5.040 cGy más radioterapia supraclavicular homolateral. Dosis día de 180 cGy, dosis total 4500 cGy, más sobreimpresión a cicatriz operatoria hasta completar 5.500 cGy, con buena tolerancia y sin suspensión. Al alta se indicó tamoxifeno 20 mg/ día.
En controles posteriores la paciente se encuentra asintomática sin evidencias de recidiva local, regional ni sistémica y su hijo a los 9 meses de edad se encuentra eutrófico y con un desarrollo psicomotor adecuado para su edad.
COMENTARIO
Los cambios fisiológicos que ocurren en la mama durante el embarazo y la lactancia pueden motivar que la detección e interpretación de eventuales anormalidades mamarias presente dificultades desde el punto de vista clínico e imagenológico. La mayoría de las anomalías mamarias que se presentan en este período son de etiología benigna, sin embargo la aparición de cualquier alteración requiere una pronta evaluación conducente a confirmar o descartar la presencia de un cáncer de mama asociado al embarazo.
El examen físico exhaustivo de mama previo al embarazo y la realización de una mamografía dependiendo de la edad de la paciente y de los factores de riesgo de cáncer mamario, son medidas esenciales para diagnosticar alguna anormalidad de esta glándula. Si el examen no se lleva a cabo durante la consulta inicial, una buena ocasión para detectar anomalías mamarias es el primer trimestre del embarazo, puesto que aún ocurren pocos cambios que puedan dificultar la valoración de las mamas. Posteriormente la mastalgia natural e hiperemia propias de las mamas grávidas y puerperales pueden entorpecer la palpación de un tumor y por consiguiente alejar la oportunidad de un diagnóstico temprano de cáncer de mama comprometiéndose de esta forma el pronóstico de la paciente12,13. Se ha descrito que el retraso entre los primeros síntomas hasta que se confirma el diagnóstico en el CMDE varía entre 2 a 15 meses8.
La detección de un tumor de mama en la embarazada plantea el desafío de determinar su naturaleza biológica tomando en cuenta el binomio madre hijo. Una aproximación diagnóstica inicial puede lograrse mediante la imagenología. El uso de la mamografía en la embarazada ha suscitado debates en cuanto al riesgo de irradiación a que se expone el feto y al rendimiento que tiene examen. Si bien es cierto que en el pasado no se indicaba por el temor de irradiación fetal, estudios recientes no avalan esta creencia, puesto que con las 2 proyecciones estándar del examen se somete al feto a sólo 0.4 mcCy (0.004 Gy) estableciéndose que dosis menores de 5 cGy no provocaría aumento del riesgo de malformaciones congénitas, aborto o restricción del crecimiento fetal por radiación ionizante14. Respecto al rendimiento de la mamografía en la embarazada, las tasas de falsos negativos varían entre el 22% y el 75%, a raíz del aumento en el tamaño, vascularización y de la densidad glandular10,15. En beneficio de la seguridad, se aconseja que la mamografía deba usarse en forma selectiva y con protección adecuada, cuando resulta necesario establecer la presencia de cáncer de mama bilateral y planificar la extensión de la cirugía.
La ecotomografía mamaria puede tener más ventajas que la mamografía como examen inicial, por tratarse de una técnica rápida, exacta e inocua para el feto, siendo capaz de diferenciar los quistes de los tumores sólidos en un 97% de los casos3,7. Realizada inmediatamente una vez palpada la masa mamaria puede demostrar claramente que ésta corresponda a un quiste simple o galactocele, en los cuales no son necesarios exámenes adicionales que se utilizan cuando la masa es sólida. El ultrasonido es también una buena guía para realizar citologías por punción aspirativa con aguja fina o biopsias percutáneas con aguja gruesa de tumores sospechosos.
El valor de la resonancia nuclear magnética en el diagnóstico de cáncer de mama durante el embarazo y período de lactancia aún no ha sido suficientemente evaluado, pero no existiría una contraindicación formal para su uso14.
La citología por punción aspirativa con aguja fina, aunque está recomendada, a menudo, es de muy difícil interpretación durante el embarazo15. Este procedimiento sólo es útil cuando el resultado es positivo para células neoplásicas; los resultados negativos no descartan el diagnóstico de cáncer y requieren mayor investigación.
Si una vez realizada la evaluación del tumor mediante imagenología y eventualmente con citología por punción aspirativa, persiste la duda sobre la benignidad o malignidad debe procederse a su estudio histológico para establecer un diagnóstico definitivo, utilizando el método menos invasivo y de mayor rendimiento. Con tal objetivo se pueden realizar biopsias percutáneas o quirúrgicas idealmente bajo anestesia local. La biopsia percutánea tiene buen rendimiento y permite el diagnóstico de invasión. El riesgo de una fístula láctea secundaria al procedimiento probablemente ha sido sobrestimado16.
El tipo histológico del CMDE no difiere substancialmente al de una mujer no embarazada, siendo el carcinoma ductal invasor el más frecuente seguido por el carcinoma lobular invasor. Diferentes comunicaciones han mostrado que la mayoría de los cánceres son de alto grado y que es común la invasión del linfática y vascular17-19. En el estudio del Anderson Cancer Center17, el 79% de los pacientes presentaron linfonodos axilares positivos. Las metástasis nodales a la axila ipsilateral pueden ser una consecuencia de un diagnóstico tardío o de la conducta agresiva del tumor, no obstante hay que tener en cuenta que las mujeres jóvenes comparativamente con las mujeres de mayor edad, tienden a tener más metástasis nodales en el momento del primer diagnóstico19. Usualmente los tumores presentan receptores de estrógeno y/o progesterona negativos y HER2/neu positivo20,21. En la serie de Middleton sólo 28% de los tumores fueron receptor estrogénico positivo y 24% receptor de progesterona positivo mediante immunohistoquímica17.
Para estatificar el CMDE se utiliza el sistema TNM. Como las mujeres con CMDE a menudo presentan, al momento del diagnóstico, un tumor primario de gran tamaño y con frecuencia existe compromiso axilar lo que conlleva un estadio avanzado, puede ser necesario descartar metástasis sistémicas.
Para la estadificación se requiere tomar medidas especiales para no exponer al feto a la radiación. La radiografía de tórax no tiene contraindicación puesto se expone al feto a menos de 0,01 cGy pero aun así se recomienda protección abdominal22 . La ecotomografía abdominal para evaluar metástasis hepáticas es segura y no tiene inconvenientes en el embarazo. La cintigrafía ósea no esta recomendada porqué utiliza isótopos radiactivos (Tc 99) al igual que tomografía computada por el riesgo de exposición fetal a la radiación y si se precisa de ella debe ser diferidas hasta el puerperio. La resonancia nuclear magnética puede ser utilizada durante la gestación en caso de requerir mayor evaluación de las vísceras abdominales y de la columna torácica y lumbosacra. Este examen debe usarse sólo si los potenciales beneficios justifican los potenciales riesgos al feto, puesto que el Gadolinio cruza la placenta y se ha asociado con anormalidades fetales en ratas23.
Establecido el diagnóstico de CMDE cada paciente necesita una decisión terapéutica individual, asumida por un equipo muldisciplinario y con la anuencia de la embarazada, tomando como referente principal el estadio de la enfermedad y la edad gestacional del feto.
La cirugía puede realizarse en forma segura durante el embarazo. La conducta convencional es esperar que se hayan completado 12 semanas de gestación con el objeto de minimizar el riesgo de aborto espontáneo. La cirugía de elección para el CMDE es la mastectomía con disección axilar23. La cirugía conservadora que implica mastectomía parcial más disección axilar no es recomendada en la primera mitad del embarazo puesto que la radioterapia requerida para completar el tratamiento local está contraindicada durante el embarazo, por el riesgo que implica para el feto la exposición a la radiación, sin embargo puede plantearse como una opción en el tercer trimestre del embarazo24 advirtiendo que los resultados cosméticos podrían ser pobres debido a los cambios anatómicos que ocurren en la mama durante el embarazo.
La radioterapia no se preconiza durante el embarazo debido a los riesgos de teratogenecidad e inducción de desórdenes malignos en el feto5,10, 25. Una dosis terapéutica habitual de 50 Gy se asocia con una dosis fetal de 3.9–15 cGy en el primer el trimestre del embarazo llegando hasta 200 cGy hacia el fin de éste, cuando el útero asciende hasta la vecindad del diafragma26. El umbral de la dosis fetal de radiación sobre la cual puede verse abortos, teratogénesis o crecimiento anormal es de 10 a 15 cGy a las 20 semanas de edad gestacional y entre 25–50 cGy después de este período. Después del parto la radioterapia no tiene contraindicación.
Cuando una mujer sobrelleva un CMDE, los agentes quimioterápicos son capaces de cruzar la placenta. Si son administrados antes de las 15 semanas de gestación, período en que se produce la organogénesis inicial del feto, pueden interferir la diferenciación celular27. El primer trimestre del embarazo es el período más crítico en el cual pueden ocurrir daños severos en el feto que pueden provocar aborto espontáneo o daños subletales que inducen malformaciones, teratogénesis, mutaciones, carcinogénesis, toxicidad de órganos o retraso mental. En efecto en este periodo, las malformaciones fetales asociadas a quimioterapia son 2.7-17% en contraste con la proporción usual de malformaciones en la población general que oscila entre 1–3%. Durante el segundo y tercer trimestres del embarazo la quimioterapia puede ser administrada con mínimas complicaciones para el feto y la madre28,29.
Cuando es necesario usar quimioterapia en CMDE, se recomienda iniciar los ciclos a partir las 18 semanas de gestación. Se sugiere el uso de Ciclofosfamida, Doxorrubicina y Fluorouracilo. No se recomienda Metotrexato por tratarse de un antagonista del ácido fólico, elemento indispensable en el desarrollo del sistema nervioso fetal28,30. El último ciclo debe ser administrado alrededor de la 34 semana de gestación y evitar que se produzca el parto entre día 1 y 14 del ciclo de la quimioterapia.
La mayoría de las drogas usadas en el tratamiento del CMDE pueden ser detectadas en la leche de las puérperas31, por lo cual la lactancia materna sólo se considera segura una vez transcurridas 2 a 4 semanas de completado el último ciclo de quimioterapia.
La manipulación hormonal, si está indicada, se inicia posterior al parto y después de la realización de la quimioterapia. Aunque existen reportes de uso de tamoxifeno durante el embarazo se considera que la droga puede producir malformaciones fetales, por lo cual generalmente se contraindica durante la gestación32.
En las II Jornadas Chilenas de Consenso en Cáncer de Mama las recomendaciones sugeridas para el tratamiento de CMDE toman en consideración el estadio de la enfermedad y la edad gestacional y proponen que los estadios I y II del cáncer diagnosticados durante la primera mitad del embarazo sean tratados mediante mastectomía radical modificada sin radioterapia postoperatoria y luego quimioterapia a partir de las 18 semanas de gestación. En la segunda mitad del embarazo se incorpora la opción de la cirugía conservadora seguida de quimioterapia adyuvante y la radioterapia se realiza después del parto. En los estadios III se recomienda combinar la cirugía más quimioterapia y aplicar radioterapia posparto, pudiéndose considerar la quimioterapia en la segunda mitad de la gestación. Los estadios IV se someten a manejo paliativo de acuerdo a la ubicación de las metástasis y a su sintomatología, privilegiando la salud fetal30.
El pronóstico de las mujeres con CMDE es similar pronóstico que las mujeres no embarazadas con la misma enfermedad33. Petrek34 reporta que comparando estadio por estadio, no hay ninguna diferencia en la sobrevida entre las mujeres con CMDE y aquellas que desarrollan el cáncer sin estar embarazadas y que en el cáncer en estadio temprano ambos grupos tienen porcentajes de sobrevida de aproximadamente 80%. Sin embargo, como el CMDE se diagnóstica con mayor frecuencia en estadios avanzados globalmente su pronóstico impresiona como muy adverso. No existe evidencia suficiente para afirmar que la interrupción del embarazo cambie el pronóstico del CMDE35.
En una sobreviviente de CMDE el pronóstico del cáncer no es influenciado negativamente por un nuevo embarazo, de hecho algunos autores concluyen que no habría una disminución de la supervida a largo plazo y postulan que existiría un potencial efecto protector en lo que respecta al riesgo de recidiva36. El intervalo ideal entre el tratamiento del cáncer de mama y el siguiente embarazo es desconocido.
REFERENCIAS
1. Smith LH, Danielsen B, Allen ME, Cress R. Cancer associated with obstetric delivery: results of linkage with the California cancer registry. Am J Obstet Gynecol 2003; 189: 1128–35.
2. Antonelli NM, Dotters DJ, Katz VL, Kuller JA. Cancer in pregnancy – a review of the literature: parts 1 and 2. Obstet Gynecol Surv 1996; 51: 125–42.
3. Pavlidis N, Pentheroudakis G. The pregnant mother with breast cancer: Diagnostic and therapeutic management. Cancer Treat Rew 2005 en prensa.
4. Pavlidis NA. Coexistence of pregnancy and malignancy. Oncologist 2002; 7: 279-87.
5. Woo JC, Yu T, Hurd TC. Breast cancer in pregnancy: a literature review. Arch Surg 2003; 138: 91–8
6. Sorosky JI, Scott-Conner CEH. Breast disease complicating pregnancy. Obst Gynecol Clin North Amer 1998; 25: 353–63
7. Hogge JP, De Paredes ES, Magnant CM, Lage J. Imaging and management of breast masses during pregnancy and lactation. Breast J 1999; 5: 272-83
8. Puckridge PJ, Saunders CM, Ives AD, Semmens JB. Breast cancer and pregnancy: a diagnostic and management dilemma. ANZ J Surg 2003; 73: 500-3.
9. Isaacs JH. Cancer of the breast in pregnancy. Surg Clin North Am 1995; 75: 47-51.
10. Liberman L, Giess CS, Dershaw DD, Deutch BM, Petrek JA. Imaging of pregnancy-associated breast cancer. Radiology 1994; 191: 245-8.
11. Keleher AJ, Theriault RL, Gwyn KM, Hunt KK, Stelling CB, Singletary SE, Ames FC, Buchholz TA, Sahin AA, Kuerer HM. Multidisciplinary management of breast cancer concurrent with pregnancy. J Am Coll Surg 2002; 194: 54-64.
12. Psyrri A, Burtness B. Pregnancy-associated breast cancer. Cancer J 2005; 11: 83-95
13. Damrich D, Glasser G, Dolan M. The characteristics and evaluation of women presenting with a breast mass during pregnancy. Prim Care Update Ob/Gyns 1998; 5: 21-3
14. Nicklas A, Baker M. Imaging strategies in pregnant cancer patients. Semin Oncol 2000; 27: 623–32.
15. Gupta R. The diagnostic impact of aspiration cytodiagnosis of breast masses in association with pregnancy and lactation with an emphasis on clinical decision making. Breast J 1997; 3: 131-4.
16. Schackmuth E., Harlow C, Norton L. Milk fistula: A complication after core breast biopsy. Am J Roentgenol 1993; 161: 961-962
17. Middleton LP, Amin M, Gwyn K, Theriault R, Sahin A. Breast carcinoma in pregnant women: assessment of clinicopathologic and immunohistochemical features. Cancer 2003; 98: 1055-60
18. Tobon H, Hozowitz LF. Breast cancer during pregnancy. Breast Dis 1993; 6: 127–34.
19. Jacobs IA, Chang CK, Salti GI. Coexistence of pregnancy and cancer. Am Surg 2004; 70: 1025-9
20. Reed W, Hannisdal E, Skovlund E, Thoresen S, Lilleng P, Nesland JM. Pregnancy and breast cancer: A population based study. Virchows Arch 2003; 443: 44-50
21. Elledge RM, Ciocca DR, Langone G, McGuire WL. Estrogen receptor, progesterone receptor, and HER-2/neu protein in breast cancers from pregnant patients. Cancer 1993; 71: 2499-2506.
22. Brent R. The effect of embryonic and fetal exposure to x-ray, microwaves and ultrasound: Counseling the pregnant and no pregnant about these risks. Semin Oncol 1989; 16: 347-68.
23. Kuerer HM, Gwyn K, Ames FC, Theriault RL. Conservative surgery and chemotherapy for breast carcinoma during pregnancy. Surgery 2002; 131: 108-110
24. Partridge A, Schapira L. Pregnancy and breast cancer. Epidemiology, treatment, and safety issues. Oncology 2005: 19: 693-700
25. Gwyn KM, Theriault RL. Breast cancer during pregnancy. Curr Treat Options Oncol 2000; 1: 239-43.
26. Antypas C, Sandilos P, Kouvaris J, Balafouta E, Karinou E, Kollaros N, Vlahos L. Fetal dose evaluation during breast cancer radiotherapy. Int J Radiat Oncol Biol Phys 1998; 40: 995–9
27. Barthelmes L, Davidson LA, Gaffney C, Gateley CA. Pregnancy and breast cancer. BMJ 2005; 330: 1375-8
28. Berry DL, Theriault RL, Holmes FA, Parisi VM, Booser DJ, Singletary SE, Buzdar AU, Hortobagyi GN: Management of breast cancer during pregnancy using a standarized protocol. J Clin Oncol 1999; 17: 855-61
29. Alistair E. Ring, Ian E. Smith, Alison Jones, Catherine Shannon, Eleni Galani, Paul A. Ellis Chemotherapy for breast cancer during pregnancy: An 18-year experience from five London Teaching Hospitals. J Clin Oncol 2005; 23: 4192-7
30. Peralta 0, Rivas O, Uribe A, Celis MA, Schneider En: Cáncer de mama y embarazo. En: II Jornada Chilena de Consenso en Cáncer de Mama, Viña del Mar, 2003 pp 61-70
31. Wiebe VJ, Sipila PEH. Pharmacology of antineoplastic agents in pregnancy. Crit Rev Oncol Hematol 1994; 16: 75–112
32. Halakivi-Clarke L, Cho E, Onojafe I, Liao DJ, Clarke R. Maternal exposure to tamoxifen during pregnancy increases carcinogen-induced mammary tumorigenesis among female rat offspring. Clin Cancer Res 2000; 6: 305–8.
33. Barthelmes L, Davidson LA, Gaffney C, Gateley CA. Pregnancy and breast cancer. BMJ 2005; 330: 1375-8
34. Petrek JA, Dukoff R, Ragtko A. Prognosis of pregnancy-associated breast cancer. Cancer 1991; 67: 869-72.
35. Bush H, McCredie JA: Carcinoma of the breast during pregnancy and lactation. In: Allen HH, Nisker JA (eds): Cancer in Pregnancy: Pregnancy: Therapeutic Guidelines. Mount Kisco, NY, Futura, 1986, pp 91-101
36. Gelber S, Coates AS, Goldhirsch A, Castiglione-Gertsch M, Marini G, Lindtner J, Edelmann DZ, Gudgeon A, Harvey V, Gelber RD; International Breast Cancer Study Group. Effect of pregnancy on overall survival after the diagnosis of early-stage breast cancer. J Clin Oncol 2001: 19: 1671-5