Cuad. Cir. 2006; 20: 52-58
DOI: 10.4206/cuad.cir.2006.v20n1-09
CASOS CLÍNICOS
Acalasia de esófago. Informe de un caso y revisión de la literatura
Orlando Felmer E 1, Carlos Cárcamo I. 2
1 Residente
de Cirugía.
2 Profesor auxiliar de Cirugía. Instituto de Cirugía.
Facultad de Medicina. Universidad Austral de Chile. Servicio de Cirugía. Hospital
Clínico Regional Valdivia. Correspondencia a: Dr. Carlos Carcamo I. E-mail:
ccarcamo@uach.cl.
RESUMEN
La acalasia de esófago corresponde a un trastorno primario de la motilidad de dicho órgano. Sus características son la falta de relajación del esfínter esofágico inferior durante la deglución y la aperistalsis del esófago. Se presenta el caso de una mujer de 75 años que consulta por cuadro de disfagia a sólidos, regurgitación y baja de peso. Se realiza Rx de esófago, estómago y duodeno, que evidencia dilatación patológica del esófago e imagen típica en pico de flauta distal, diagnosticándose acalasia. Tras completar evaluación se decide cirugía, realizándose una cardiomiotomía de Zaaijer con hemivalva anterior de Dor por Videolaparoscopía evolucionando satisfactoriamente.
Palabras claves: Acalasia de esófago; Enfermedades esofágicas; Trastornos de la motilidad esofágica.
Key words: Esophageal Achalasia; Esophageal diseases; Esophageal motility disorders.
INTRODUCCIÓN
La acalasia de esófago corresponde al trastorno primario más común de la motilidad esofágica1-7. Se caracteriza por la falta de relajación del esfínter esofágico inferior (EEI) y la aperistalsis del cuerpo esofágico durante la deglución3-6,8, causada por la degeneración de los plexos nerviosos mientérico8 y autónomo. Su etiología aún es desconocida4,5,8, postulándose diversas teorías. Su presentación es relativamente rara5,8. El diagnóstico se realiza mediante los signos y síntomas clínicos característicos, apoyados fundamentalmente en la manometría esofágica, además de la radiología, endoscopía y cintigrafía.
Consideramos de interés comunicar el caso de una paciente que consulta por cuadro de disfagia a sólidos, regurgitación y baja de peso. Se realiza radiografía de esófago, estómago y duodeno (EED), que evidencia dilatación patológica del esófago e imagen típica en pico de flauta distal, diagnosticándose acalasia. Tras completar evaluación se decide cirugía, realizándose una cardiomiotomía de Zaaijer con hemivalva anterior de Dor por Videolaparoscopía.
CASO CLÍNICO
Paciente de 75 años, obesa mórbida (IMC 40), secuelada de accidente cerebrovascular e hipertensa. Consulta el 31 de diciembre de 2003 en policlínico de gastroenterología del Hospital Clínico Regional Valdivia (HCRV) por cuadro de disfagia a sólidos, regurgitación y baja de peso de un mes y medio de evolución. Se realiza endoscopía digestiva alta (EDA) que concluye esofagitis grado III y sospecha de várices esofágicas. Se diagnostica reflujo gastroesofágico y se indica tratamiento con inhibidor de la bomba de protones (esomeprazol) por dos meses.
Asiste a control programado el día 18 de marzo de 2004 en gastroenterología, en donde se describe una mejoría clínica de su reflujo pero por cuadro respiratorio intercurrente no se realiza control endoscópico planificado. Queda en tratamiento con Ranitidina y se cita a control en seis meses.
Por cuadro de disfagia severa consulta en Unidad de emergencia adultos del HCRV el día 3 de febrero de 2005, llevando consigo una Rx de EED que evidencia dilatación patológica del esófago e imagen típica en pico de flauta distal, diagnosticándose acalasia. Se indica régimen licuado y control en policlínico de cirugía digestiva.
El día 21 de febrero de 2005 es derivada de urgencia desde Futrono a Valdivia por cuadro de afagia. En Unidad de emergencia adultos, se realiza EDA, comprobando cuerpo extraño alimentario impactado a nivel cardial que se extrae y se logra avanzar endoscopio y luego dilatador de 42 F sin dificultad a estómago. Se mantienen las indicaciones antes descritas y se indica control en policlínico de cirugía digestiva.
Es evaluada por cirujano digestivo el día 3 de marzo de 2005, en donde se indica hospitalizar el 7 de abril de 2005 para discutir alternativa terapéutica.
Ingresa al Servicio de Cirugía del HCRV el día planificado, realizándose nueva EDA que evidencia mucosa esofágica normal y restos de alimento en la zona precardial que se extraen. Existe un buen paso a distal del endoscopio.
Tras completar evaluación con exámenes de rigor se decide cirugía, realizándose el día 22 de abril de 2005 una cardiomiotomía de Zaaijer con hemivalva anterior de Dor por Videolaparoscopía, sin incidentes. Es dada de alta al tercer día postoperatorio con régimen licuado bien tolerado.
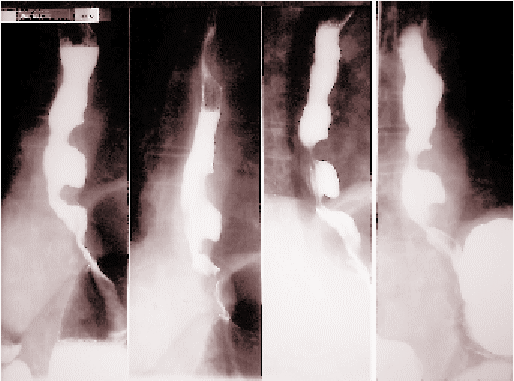
Asiste regularmente a controles ambulatorios mensuales constatando buena tolerancia alimentaria, sin síntomas de reflujo. Tránsito baritado de control confirma la adecuada evolución postoperatoria, mostrando un buen paso del contraste a estómago sin presencia de reflujo. (Figuras 1).
COMENTARIO
La acalasia de esófago corresponde al trastorno primario más común de la motilidad del esófago1-6. El término deriva del vocablo griego “a jálasis” que significa “sin relajación”5,9. Precisamente la falta de relajación del esfínter esofágico inferior (EEI), junto al aumento de resistencia (hipertensión) al flujo de salida y la aperistálsis del esófago durante la deglución2,4,5,6,8 (contracción espástica), son los elementos que definen a esta patología, resultando en un severo deterioro en el transporte del bolo secundario a una propulsión inefectiva del cuerpo esofágico6, cuya causa es producto de la degeneración de los plexos nerviosos mientérico (Auerbach)2,4,7 y autónomo, este último ubicado en los 2/3 inferiores del esófago. La etiología aún es desconocida8, postulándose diversos orígenes como el hereditario, degenerativo, autoinmune y/ o infecciosos (probablemente viral), siendo las dos últimas las causas más aceptadas3.
 |
| FIGURA 1. Esófagograma baritado postoperatorio. |
Aunque corresponda al desorden funcional más común del cuerpo del esófago y del EEI, su presentación es relativamente rara5,8, reportándose el primer caso hace unos 300 años por Thomas Willis3. Actualmente se describe una incidencia que oscila entre 0,5-1/100.0000 y una prevalencia de 0,03-8/100.000, presentando una distribución bimodal, con un peak entre los 20– 40 años y un segundo peak mayor a los 60 años5,8. No se ha descrito ninguna predilección epidemiológica en cuanto a raza o género5.
Existe evidencia que en estos pacientes hay una menor concentración esofágica de neurotransmisores, como el polipéptido intestinal vasoactivo y el neuropeptido Y, además de una disminución o ausencia de óxido nítrico sintetasa (NOS) contenida en las fibras nerviosas del plexo mientérico5,7. Esta abolición neuronal es gradual, lo que coincide con la clínica de la enfermedad, desafortunadamente la etiología de estos cambios neuronales aún es desconocida5. Todo esto conlleva a un estímulo colinérgico sin oposición. La ausencia de relajación del músculo liso del esófago da por resultado la relajación incompleta de EEI y la ausencia de peristalsis esofágica distal3,5. Por otro lado, la degeneración del sistema nervioso autónomo y entérico podría afectar la sensibilidad visceral2. Se ha demostrado una disminución significativa en la quimio y mecanosensibilidad2, aumentando los umbrales para estos estímulos2, lo que permite una pobre percepción de la distensión esofágica y del reflujo ácido antes y después del tratamiento2, motivo que produce un retraso en la consulta.
Histopatológicamente se ha visto una infiltración inflamatoria del plexo mientérico2,3, conduciendo a la degeneración de neuronas y fibrosis2. Además existe evidencia de cambios degenerativos de las fibras vagales y pérdida de neuronas del núcleo motor dorsal del nervio vago y del plexo de Auerbach2,5.
Por otro lado, el riesgo del cáncer aumenta entre 14 y 140 veces en comparación a la población general, describiéndose en la literatura que luego de 30 años de comenzar la terapia el 19% de las muertes corresponden a cáncer esofágico, lo que sería producto de la exposición crónica de la mucosa a noxas debido a la estasia esofágica2,5. Histopatológicamente se ha evidenciado hiperplasia escamosa, lo que puede desencadenar con el tiempo un carcinoma de células escamosas5. Sin embargo, el pronóstico de la neoplasia no experimenta diferencias al ser producto de una acalasia.
El diagnóstico se realiza luego de la sospecha clínica, mediante manometría complementado con estudios radiológico, e histológico5, y en algunas ocasiones asociados a la endoscopía y cintigrafía. Los síntomas son insidiosos y se deben a la obstrucción funcional del EEI, lo que desencadena una disfagia ilógica progresiva, asociado a pseudoregurgitación, vómitos, reflujo, pérdida peso y dolor retroesternal, y con menor frecuencia tos, pirosis, carraspera, odinofagia, aspiración y halitosis2,3,5,7,8.
Por otro lado, cabe destacar la existencia de un cuadro distinto pero con una clínica, radiología y manometría similar a la acalasia primaria, tema de esta discusión5. Nos referimos a la acalasia secundaria o pseudoacalasia, cuadro en el que existe disfunción de la motilidad esofágica con una causa identificable, frecuentemente consecuencia de la enfermedad de Chagas, infección producida por el parasito protozoario Trypanosoma cruzi, cuadro que afecta a unos 20 millones de personas en Centro y Sudamérica5. En este cuadro se puede apreciar una disminución de células ganglionares en los plexos de Meissner y Auerbach5.
Dentro del estudio imagenológico de la acalasia primaria, es de primordial importancia la realización de un esofagograma baritado (85% especificidad), el que muestra una estenosis del esófago distal con una imagen típica en pico de pájaro o flauta (Figura 2), un grado variable de dilatación proximal y ausencia de burbuja gástrica3,4,5. La manometría, considerada el gold standard para los desórdenes motores del esófago, evidenciará una atenuada peristálsis de cuerpo esofágico y un aumento de la presión del EEI en 50% de los casos3,4,5. Un 70-80% de los pacientes presentará relajación ausente o incompleta durante la deglución y el 20-30% restante, relajaciones de corta duración y funcionalmente inadecuadas3,4. Cuando la presión de EEI supera los 10 mm Hg durante la deglución, el diagnóstico tiene una sensibilidad y una especificidad cercana al 100%5. La endoscopía con biopsia permite sospechar el diagnóstico y descartar otras patologías, al igual que la ultrasonografía y la tomografía axial computada3,4,5.
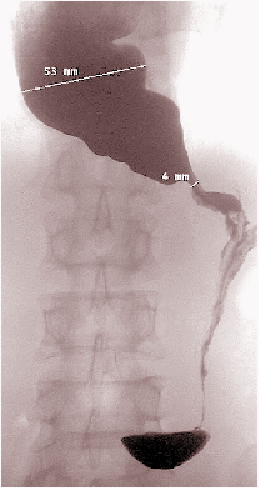 |
FIGURA
2. Imagen típica en pico de pájaro o flauta. |
Este cuadro se clasifica según el grado de alteración anatómico-radiológica10 .
• Tipo I Precoz:
trastorno motor, sintomático, sin dilatación esofágica
• Tipo II No avanzado: con dilatación < 10
cm, (8 cm para otros autores)
• Tipo III Avanzado: con dilatación > 10
cm
• Tipo IV Avanzado: con dilatación más de 10
cm y de tipo megaesófago sigmoideo
Respecto al tratamiento se sabe que ninguna terapia resuelve la pérdida y daño neuronal, por lo que todas se consideran de carácter paliativo3,10. Su objetivo es corregir la obstrucción funcional del EEI y disminuir la presión del EEI para facilitar el vaciamiento esofágico, mejorar los síntomas y prevenir complicaciones relacionadas a la estasia y dilatación esofágica en etapas más avanzadas (megaesófago)3,6,10,11 . Dentro de las opciones terapéuticas aceptadas en la actualidad están el tratamiento farmacológico, endoscópico o quirúrgico1,5,10,12.
Entre los agentes farmacológicos se encuentran los de uso oral (bloqueadores de los canales de calcio, nitratos, agonistas de los receptores ß2 adrenérgicos, anticolinérgicos e inhibidores de la fosfodiesterasa) y los inyectados endoscópicamente como la toxina botulínica3,5,6. En el primer grupo destacan los nitratos como el Isosorbide dinitrato (dosis de 5 a 10 mg) y la nitroglicerina (dosis de 0,3 mg por vez)10, y los bloqueadores de los canales de calcio, como el nifedipino y el diltiazem (dosis de 10 a 30 mg por vez)3,10. Estos pueden disminuir la presión del EEI relajando la musculatura lisa, pero son poco eficaces dado que disminuyen muy poco la presión de reposo del EEI3,10. Como efecto secundario pueden producir: cefalea, hipotensión y desarrollo de tolerancia al medicamento10. Su efecto es transitorio con alta recurrencia, por lo que no debe ser realizado como tratamiento primario excepto en pacientes añosos y/o de alto riesgo quirúrgico, en estadios muy iniciales de la enfermedad en que no hay dilatación esofágica, en caso de rechazo a la dilatación o cirugía, patología mental concomitante que contraindique otros procedimientos o como medida transitoria en espera de un tratamiento definitivo5,10.
En el segundo grupo de fármacos se encuentran los inyectados por vía endoscópica, como la neurotoxina del Clostridium botulinum3,5,8 La toxina botulínica (Botox®) es un péptido bloqueador neuromuscular que inhibe la liberación de acetilcolina neural3,5,10, produciendo una parálisis medicamentosa reversible del EEI5. Se inyecta a 1 cm sobre la línea Z en los 4 cuadrantes, requiriendo de aproximadamente 20- 25 unidades en cada uno10. Su efecto se ve luego de 24 horas10. Este fármaco además se puede utilizar como medida diagnóstica inicial cuando éste es dudoso, visualizando la respuesta a la inyección como prueba terapéutica10. Tiene un buen resultado sintomático a corto plazo (70-90% con una dosis), el que disminuye a un 66% a los 6 meses y a un 30% transcurrido un año, obteniéndose un promedio de respuesta de 0,7- 1,6 años5,10. Requiere de nuevas dosis cada 6 meses y su efecto va disminuyendo en el tiempo, tanto en potencia como en duración, probablemente por regeneración de los receptores afectados3,10,13. Se consideran factores de éxito terapéutico la edad mayor a 50 años (con una respuesta superior a 3 meses de un 82% v/s un 43%), acalasia vigorosa (100% v/s un 52%) y el uso de 100 U, repartida en 2 dosis10. Dentro de las complicaciones se describen el dolor transitorio (25%) y el reflujo gastroesofágico (RGE)5,10,13. Las bajas dosis utilizadas minimizan el riesgo de causar botulismo10. Su mayor utilidad está en las etapas iniciales, acalasia vigorosa y en pacientes con contraindicación quirúrgica10.
La dilatación neumática o hidrostática del EEI se considera como la opción no quirúrgica más eficaz3,5. Esta consiste en debilitar el EEI desgarrando sus fibras musculares, lo que se puede realizar por medio de múltiples tipos de balones neumáticos o hidrostáticos7,10. Actualmente el de mayor uso en E.E.U.U es el balón de polietileno Rigiflex®, que se instala con guía y se ubica radiológicamente en el EEI3,4,10. Existen balones de tres diámetros 3,0-3,5 y 4,0 cm, utilizándose en forma secuencial según la respuesta clínica3,10. En este caso la indicación quirúrgica está dada si luego de tres dilataciones no se produce mejoría sintomática10. Aún no hay consenso en la literatura respecto al método óptimo de dilatación, tipo de balón, diámetro máximo utilizado, presión de insuflación del balón (100-1000 mmHg), tiempo de insuflación (seg a 5 min) y número de insuflaciones por sesión (1-5)10. Con esta técnica se obtiene una buena remisión de los síntomas (50-93%)3, siendo esto mejor a corto plazo (60-85%)1,10. A largo plazo la eficacia es insatisfactoria, aproximadamente un 50% de los pacientes requerirá de una nueva dilatación a los 5 años y con menor éxito aún1,10; se ha demostrado que un 59% de los pacientes presenta remisión a un año, la que disminuye a 26% a 5 años. Se consideran predictores de éxito la disminución de la presión del EEI a menos de 10 mm Hg y la edad mayor a 40 años (Efectividad en 67% v/s 29%)8,10. Se cree que los más jóvenes tienen mayor componente gástrico hipertónico del EEI o simplemente mayor resistencia en el EEI8,10, lo disminuiría el efecto del tratamiento, tanto con inyección de Botox® como de la dilatación10. Esto debido a que ambas técnicas tendrían una mayor acción sobre las fibras esofágicas del esfínter, pero no sobre las fibras de la curvatura menor gástrica que contribuyen anatómicamente al EEI10.
La aplicación de dilataciones repetidas mejoraría el resultado, con 89% de respuesta al año1,10. Los pacientes que responden bien a la dilatación inicial y recurren tardíamente, responden mucho mejor a otra dilatación que quienes persisten sintomáticos a los pocos meses10. En estudios comparativos la dilatación neumática ha tenido mejores resultados que la inyección de toxina botulínica, (remisión en 70% de los pacientes al año v/s 32% con toxina)5,10. No obstante, se describe una incidencia de complicaciones más alta, dentro de las cuales destacan la perforación esofágica (2-15%), hematoma intramural, divertículo cardial, desgarro de mucosa esofágica y el RGE (2%)1,3,10.
La miotomía quirúrgica desarrollada por Heller desde 1913 (cardiomiotomía anterior y posterior)5,12, buscaba el debilitamiento del EEI, cortando sus fibras musculares5,10. No obstante no estaba libre de complicaciones produciendo un RGE severo en un 10-40% de los casos3,11,12. Por este motivo Zaaijer en 1923 propuso una nueva técnica aún vigente12. Nos referimos a la cardiomiotomía anterior de Zaaijer, que en asociación a una fundoplicatura anterior de Dor, constituye actualmente la técnica más utilizada en el mundo10. La cardiomiotomía anterior de Zaaijer consiste en la disección de la unión gastroesofágica, seccionando los primeros vasos cortos (2 ó 3) para la movilización del fondo gástrico. La esofagomiotomía se realiza seccionando 5 cm de la capa muscular del esófago distal y 1 cm del estómago hacia la curvatura menor. Se debe considerar que se seccionan las estructuras de apoyo que sostienen al mecanismo antirreflujo como son el ligamento frenoesofágico y el esfínter gastroesofágico, por lo que se debe realizar un procedimiento antirreflujo12. Una vez visualizada la mucosa esofágica libre de fibras musculares se realiza el parche de Dor, que debe ser una hemivalva anterior de Dor y no un Nissen completo de 360°, ya que este último puede ser muy continente y provocar disfagia12. Algunos grupos complementan la cirugía con el apoyo endoscópico intraoperatorio.
Este tratamiento tiene buenos resultados sintomáticos (84%)10. Con un resultado inmediato en 80-90% y a largo plazo, de 85% a los 10 años y de 65% a los 20 años10. Además se ha visualizado una disminución del diámetro esofágico en un 50% según criterios radiológicos postoperatorios, con una significativa mejoría de la presión de reposo del EEI10.
Csendes y cols. realizaron un estudio prospectivo aleatorio que comparó los resultados entre tratamiento quirúrgico v/s dilatación neumática, con un n de 78 pacientes y un seguimiento a 5 años. Concluye un mejor resultado después de la cirugía (95% v/s 65%), obteniendo con ésta un mejor efecto para el alivio de la disfagia, una tasa de mortalidad similar (0,3%) y una menor incidencia de perforación10.
Por otro lado, la cirugía mínimamente invasiva (cardiomiotomía laparoscópica) en desarrollo desde 1991 y descrita en 1992 por Cuschieri5,6,12, ha demostrado gran éxito sobre la disfagia, regurgitación y otras molestias imponiéndose como la terapia de elección8. Al comparar los abordajes laparoscópico v/s toracoscópico, los resultados clínicos abogan sobre el primero dado a ventajas inherentes tales como: la mejor visualización de la unión gastroesofágica y del cardias, manejo anestésico más simple, intubación endotraqueal con tubo de un lumen, mayores facilidades técnicas extiendiendo mejor y más fácil la miotomía hacia el estómago, la posibilidad de agregar un procedimiento antirreflujo y el hecho de no dejar tubo de pleurostomía en el postoperatorio.5,8,12.
Se ha demostrado que la miotomía con procedimiento antirreflujo asociado, tipo fundoplicatura parcial (técnica de Dor), es significativamente mejor al agregar un procedimiento que controle el RGE postoperatorio. Otro estudio realizado por Csendes y cols, con un n de 67 pacientes y un seguimiento de 190 meses, concluye un 73% de excelentes resultados, con un 4,5% de desarrolllo de carcinoma esofágico de células escamosas y un 21% de pobres resultados debido a reflujo severo, con aparición progresiva de esofagitis y esófago de Barrett con metaplasma intestinal14.
Se debe considerar que la dilatación o la inyección de Botox® previa puede dificultar o disminuir la efectividad de la miotomía, debido a que puede producir mayor fibrosis de la submucosa de la pared esofágica, lo que puede dificultar la identificación de los planos durante la cirugía y además asociarse a una mayor incidencia de perforación de la mucosa que puede asociarse a mayor porcentaje de conversión a cirugía abierta 3,5,6,10,12.
Existen casos con esófagos muy dilatados con pérdida total y absoluta de su función motora (Etapa IV), en los cuales los resultados de la miotomía son malos y ante el riesgo de moniliasis esofágica, esofagitis retencional permanente y por el riesgo, aunque bajo, de cáncer esofágico, se debe indicar la esofagectomía total con reemplazo esofágico de preferencia con interposición de colon10. Existen otras alternativas a realizar en pacientes con acalasia avanzada, falla de cardiomiotomía previa, estenosis fibrosa post cardiomiotomía y/o paciente de alto riesgo quirúrgico para una esfogectomía total, una ellas es la realización de una Esófagocardioplastía en Y invertida + VT + antrectomía + gastroyeyunoanastomosis en Y de Roux10. (Figura 3).
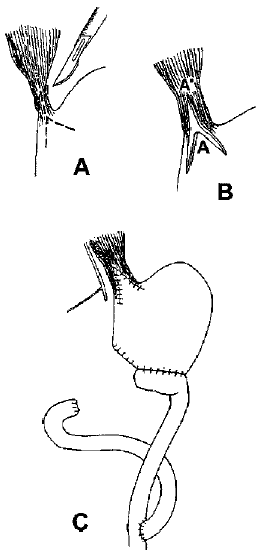 |
FIGURA
3. Esófago-cardioplastía en Y invertida VT + antrectomía + gastroyeyunoanastomosis
en Y de Roux. |
Se concluye que, en el pasado las medidas más conservadoras fueron usadas como terapia de primera línea. Los mejores resultados de tratamiento en la actualidad son los obtenidos mediante la dilatación y la cirugía, siendo la miotomía quirúrgica la que produce los resultados más durables en el tiempo. No obstante, la elección dependerá del paciente y de la experiencia quirúrgica del equipo tratante, además se ha demostrado una morbilidad y mortalidad similares para ambas técnicas. Dentro de las técnicas quirúrgicas la esofagomiotomía por vía laparoscópica ha demostrado mayor efectividad, menos complicaciones y menor reflujo postoperatorio, siendo ampliamente aceptada como la terapia de elección para el tratamiento de la acalasia. Aunque en el pasado el abordaje toracoscópico fue ampliamente aceptado, en la actualidad está siendo abandonado. Por otro lado, la dilatación neumática tiene buen efecto terapéutico a corto plazo por lo que habitualmente debe repetirse. La farmacoterapia, ya sea medicamentosa por vía oral o la inyección de toxina botulínica, son tratamientos transitorios de uso preferencial en pacientes mayores y/o de alto riesgo quirúrgico.
REFERENCIAS
1. Ying-Sheng Cheng, Ming-Hua Li, Wei-Xiong Chen, Ni-Wei Chen, Qi-Xin Zhuang, Ke- Zhong Shang. Selection and evaluation of three interventional procedures for achalasia based on long-term follow-up . World J Gastroenterol 2003; 9(10): 2370-3.
2. Stephen Brackbill, Guoxiang Shi, Ikuo Hirano. Diminished mechanosensitivity and chemosensitivity in patients with achalasia. Am J Physiol Gastrointest Liver Physiol 2003; 285: 1198-203.
3. Joel E Richter. Oesophageal motility disorders. The Lancet 2001; 358: 823–8.
4. Vakil N, Kadakia S, Eckardt V F. Pneumatic dilatación in acalasia. Endoscopy 2003; 35: 526-30.
5. St Peter S, Swain J. Achalasia. A comprehensive review. Surgical Laparoscopy, Endoscopy and Percutaneous Techniques 2003; 13: 227-40.
6. Nagammapudur S, Jeffrey H. Minimally invasive surgery for esophageal motility disorders. Surgical Clinics of North America 2002; 82: 763-82.
7. Lind C. Dysphagia: evaluation and treatment. Gastroenteroly Clinics of North America 2003; 32: 553-75.
8. Steven R, Mark B, Desirre V, Donald T, Brian B, Alexander R. Age Affects Presenting of Symptoms of Achalasia and Outcomes after Myotomy. The American Surgeon 2005; 71: 424-9.
9. Günther S. Etimología y fonética neohelénica del vocabulario médico: autoaprendizaje mediante la práctica diccionariogriego-español según la ortografía monotónica de 1982. Rev. méd. Chile 2003; 131:12.
10. Braghetto I, Csendes A, Burdiles P, Korn O, Valera J. Manejo actual de la acalasia del esófago: revisión crítica y experiencia clínica. Rev. Méd. Chile 2002; 130: 9: 1055-66.
11. Ponce M, Ortiz V, Juan M, Garrigues V, Castellanos C, Ponce J. Gastroesophageal reflux, quality of life, and satisfaction in patientes with achalasia treated with open cardiomyotomy and partial fundoplication. The American Journal of Surgery. 2003; 185: 560-4.
12. Csendes A, Burdiles P, Korrn O, Braghetto I, Díaz J, Henríquez A. Resultados preliminares de la esofagotomía por video laparoscopia en pacientes con acalasia esofágica. Rev. Méd. Chile 2001; 129: 10: 1142-6.
13. Pasricha PJ, Rai R, Ravich WJ, Hendrix TR, Kalloo AN. Botulinum toxin for achalasia: Longterm outcome and predictors of response. Gastroenterology 1996; 110: 1410-5.
14. Csendes A, Braghetto I, Burdiles P, Korn O, Csendes P, Henríquez A. Very late results of Esophagomyotomy for patients with Achalsia. Annals of Surgery 2006; 253: 2: 196-203.