Cuad. Cir. 2007; 21: 11-16
DOI: 10.4206/cuad.cir.2007.v21n1-02
TRABAJO DE INVESTIGACIÓN
Diagnóstico precoz de metástasis de melanoma mediante biopsia de linfonodo centinela. Informe preliminar
Osvaldo Iribarren B 1-5, Juan Andrés Madariaga G 2-6, Sergio González B 3, Carolina Aqueveque A 4, Marco Rojas G 5, Fernando Saavedra P 5, Enrique De Amesti B. 5
1
Profesor Asociado Escuela de Medicina Universidad Católica del Norte, Coquimbo.
2 Profesor
Asistente Escuela de Medicina Universidad Católica del Norte, Coquimbo.
3 Profesor
Titular Escuela de Medicina Pontificia Universidad Católica de Chile, Santiago.
4 Médico
Residente Medicina Nuclear, Hospital J.J. Aguirre, Universidad de Chile.
5 Cirujano
Servicio de Cirugía Hospital Clínico San Pablo, Coquimbo.
6 Jefe
de Servicio Anatomía Patológica, Hospital Clínico San Pablo, Coquimbo.
Servicio de Cirugía Hospital Clínico
San Pablo, Coquimbo.
Departamento de Ciencias Biomédicas,
Facultad de Medicina, Universidad Católica del Norte, Coquimbo.
Dirección de autor: Gabriela Mistral
2381, fono 51 – 292405, La Serena, Chile.
Correspondencia a: oiribarren@123.cl.
Apoyo financiero: Proyecto DGIP
10301165 / 2004, Universidad Católica del Norte.
RESUMEN
Se presenta un estudio de linfonodo centinela y la experiencia inicial en el diagnóstico de micro metástasis linfática en melanoma maligno de piel, en un período de dos años. Se identificó en el pre operatorio el sitio del linfonodo centinela mediante albúmina marcada con Tc99 y, en el intra operatorio, con tinción vital con azul de isosulfán para seleccionar a los pacientes con micro metástasis que se pueden beneficiar con tratamiento quirúrgico linfático, descartar la cirugía ganglionar en los pacientes con linfonodo centinela negativo y reducir la morbilidad asociada al tratamiento quirúrgico. El criterio de inclusión incluyó pacientes con tumores Clark III o superior. Se incluyeron 6 pacientes; 2 Clark III, 3 Clark IV y un paciente Clark V. El diagnóstico de micro metástasis se realizó mediante tinción hematoxilina-eosina y estudio histoquímico de antígenos Melan A, S 100 y HMB 45. En dos pacientes Clark III y uno Clark IV, el estudio con H-E e inmunohistoquímica no identificó micro metástasis. Un paciente Clark IV no evidenció metástasis en el primer estudio con H-E; sin embargo, la inmunohistoquímica mostró micro metástasis con los tres marcadores tumorales. La revisión de las placas H-E confirmó el hallazgo. Un paciente con micro etapa IV y uno con micro etapa V mostraron metástasis a la tinción H_E y se confirmó la presencia de anticuerpos para los marcadores Melan A, S 100 y HMB 45. En este estudio el uso de Melan A, S 100 y HMB 45 mejoró la sensibilidad del diagnóstico histológico de metástasis linfáticas en un 20% y redujo a la mitad la indicación de disección ganglionar regional.
Palabras claves: Melanoma; Linfonodo centinela; Linfocintigrafía.
Key words: Melanoma; Sentinel lymph node; Lymphography.
INTRODUCCIÓN
El melanoma se origina en melanocitos transformados en células malignas y en consecuencia puede surgir en cualquier órgano a las que hayan migrado estas células (piel, mucosa digestiva, respiratoria, genital o retina). El 90% de los melanomas se encuentra en la piel y 4% se descubre por metástasis sin sitio primario identificable1. Desde su descripción hace dos siglos, el melanoma ha sido una enfermedad de difícil tratamiento, por su velocidad de desarrollo, su agresividad y por su alta mortalidad. La incidencia de melanoma cutáneo va en aumento y su tasa de crecimiento es una de las más altas entre todas las formas de cáncer2. En 1930 la incidencia de melanoma en USA era de 1/ 1500 personas y la incidencia para las personas nacidas en el año 2002 será de 1/ 57 personas3. La tasa cruda de incidencia para el año 2000, en raza blanca, fue de 40 x 100.000 a los 55 años y de 60 x 100.000 a los 70 años de edad4.
El compromiso de los linfonodos regionales es el factor pronóstico individual más importante para seleccionar el tratamiento del melanoma maligno, el factor más significativo de pronóstico para la recurrencia y, para la sobrevivencia luego del tratamiento5-10. El linfonodo más próximo al tumor es la primera barrera a la de diseminación y se denomina linfonodo centinela (LNC). En consecuencia, LNC es un procedimiento de identificación precoz de pacientes que clínicamente se presentan sin linfonodos pero que presentan infiltración histológica no detectable. Esta etapificación permite eliminar la linfadenectomía regional y sus complicaciones en pacientes sin compromiso linfático regional (edema postoperatorio de difícil manejo de la extremidad operada, infecciones recurrentes en la misma extremidad) y, por otra parte, permite identificar pacientes con metástasis ocultas en que se recomienda realizar la disección nodal regional para retardar la aparición de metástasis11.
El propósito de esta investigación es efectuar el estudio histológico del LNC en portadores de melanoma, para seleccionar los pacientes que se pueden beneficiar con tratamiento quirúrgico, descartar la cirugía ganglionar en los pacientes con LNC negativo y reducir la morbilidad global asociada al tratamiento quirúrgico.
MATERIAL Y METODO
OBJETIVOS
1. Identificar la ubicación anatómica del LNC mediante albúmina marcada con Tc 99 y con tinción vital con azul de isosulfán (azul patente) en portadores de melanoma de piel.
2. Identificar a los pacientes con y sin micro metástasis en el LNC; en los primeros se realiza tratamiento local más disección nodal radical regional y, en los segundos se realiza sólo tratamiento local del tumor.
3. Medir la tasa de identificación del linfonodo centinela.
4. Medir la incidencia de linfonodo centinela positivo y negativo.
5. Definir el desenlace del tratamiento en las dos ramas de tratamiento: pacientes con metástasis y sin metástasis ganglionares de melanoma.
TIPO DE ESTUDIO.
Ensayo clínico prospectivo.
PERÍODO DEL ESTUDIO.
Enero 2005 – Diciembre 2006
CRITERIOS DE INCLUSIÓN.
Pacientes portadores de melanoma
de espesor mayor de 1 mm (Breslow), Clark III, Clark IV y Clark V y, linfonodos
regionales clínicamente negativos. No se incluyen melanomas de menos de 1 mm
de espesor (Clark II) ya que no se encuentran muestras positivas en el estudio
de los linfonodos12.
MÉTODO DE ESTUDIO
a. Identificación de la ubicación del linfonodo centinela luego de inyectar albúmina humana marcada con coloide Tc99, intradérmico perilesional, el día antes de operar. Mediante gamma cámara se identifica y registra el sitio de alto conteo radiactivo. Al inicio de la cirugía, se inyecta azul de isosulfán intradérmico, 05 a 1 ml en el sitio del tumor primario. El colorante vital tiñe verde los vasos linfáticos y el LNC.
b. Resección del tumor (1-2 cm de margen de seguridad) y extirpación del LNC.
c. Estudio histológico de 4 cortes de linfonodos con hematoxilina-eosina (H-E)13, 14.
d. Detección inmunohistoquímica de células de melanoma en 3 cortes en el LNC con antígeno S-100, HMB-45 y Melan A13, 14.
e. Los pacientes con LNC positivo son sometidos a una disección nodal regional en un segundo tiempo quirúrgico.
f. Los pacientes tratados ingresan a seguimiento, con control trimestral con examen físico, radiografía de tórax, ecotomografía abdominal. En caso de dudas sobre la aparición de recurrencia, se solicita tomografía computada del territorio anatómico en evaluación.
RESULTADOS
En el período de estudio entre 2005 y 2006, se identificaron 11 pacientes portadores de melanoma. Tres pacientes eran portadores de linfonodos clínicamente palpables y 2 pacientes correspondían a tumores in situ. En consecuencia 6 pacientes (3 varones y 3 mujeres) cumplieron los criterios de inclusión para el estudio de LNC. La media de de edad fue 53 años con rango entre 35 y 75 años.
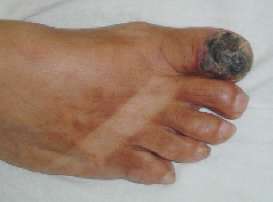
Dos tumores se localizaron en el pie, tres en dedos de la mano y uno en antebrazo. La profundidad según el criterio de Clark mostró 2 micro etapas III, 3 micro etapas IV y 1 paciente con micro etapa V. La profundidad (Breslow) tuvo un rango entre 1 y 5 mm.
En todos los pacientes se identificó un sitio de alta captación de Tecnecio 99 en el área de drenaje ganglionar. A su vez, la inyección de azul de isosulfán intraoperatoria confirmó en el sitio previamente marcado con la radiación, la presencia de LNC: dos linfonodos en 4 pacientes y un linfonodo en dos pacientes (Figuras 1 a 3). Se identificó el 100% de LNC con el uso combinado de linfocintigrafía y colorante vital (Objetivos 1 y 3).
Dos pacientes con micro etapa III y uno con micro etapa IV no mostraron infiltración tumoral con tinción de H-E y los marcadores tumorales resultaron negativos (Objetivo 2).
En un paciente con micro etapa IV (3 mm de profundidad de Breslow) y un paciente con micro etapa V (5 mm de profundidad de Breslow) se identificó metástasis histológicas con tinción de hematoxilina-eosina en LNC (Figura 4). Todos tenían marcadores positivos para anticuerpos Melan A, S 100 y HMB 45 (Figura 5). En un paciente con micro etapa IV no se identificó metástasis con tinción hematoxilina-eosina. Sin embargo, los 3 marcadores de inmunohistoquímica resultaron positivos para melanoma. La revisión de las biopsias teñidas con H-E identificó el compromiso tumoral en el LNC (Tabla 1) (Objetivo 4).
 |
FIGURA 1.
Melanoma acral de dedo del pie. |
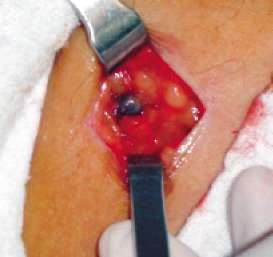 |
FIGURA 3.
Incisión crural de 3 cm. Linfonodo centinela teñido verde- azul en medio
del tejido celular subcutáneo. |
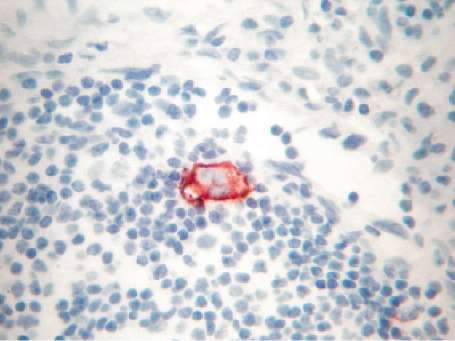 |
FIGURA 5.
Tinción con HMB 45 y magnificación 40X. Linfonodo con abundantes linfocitos
teñidos celestes y al centro un melanocito teñido marrón, correspondiente
a micro metástasis ganglionar. |
|
PROFUNDIDAD |
HEMATOXILINA- |
S 100 |
MELAN A |
HMB 45 |
HEMATOXILINA-EOSINA |
| III |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
| III |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
| IV |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
NEGATIVO |
| IV |
POSITIVO |
POSITIVO |
POSITIVO |
POSITIVO |
POSITIVO |
| IV |
NEGATIVO |
POSITIVO |
POSITIVO |
POSITIVO |
POSITIVO |
| V |
POSITIVO |
POSITIVO |
POSITIVO |
POSITIVO |
POSITIVO |
De acuerdo al protocolo de estudio, dos pacientes con micro metástasis fueron sometidos a disección ganglionar radical regional entre 4 y 8 meses luego del diagnóstico. Uno ya presentaba metástasis clínicas al momento de la resección ganglionar. A 6 meses de seguimiento se encuentran en intervalo libre de enfermedad. Un paciente se perdió de seguimiento antes de operar los linfonodos (Objetivo 5).
DISCUSIÓN
El concepto del LNC ha generado cambios en el tratamiento quirúrgico del cáncer. Hasta hace 10 años la disección profiláctica de los linfonodos regionales era la única opción para controlar la diseminación de muchos canceres invasores. Actualmente, hay evidencia que el primer linfonodo que recibe el drenaje del tumor puede predecir con seguridad el estado tumoral de todo el grupo, ya que la ausencia de enfermedad tumoral metastásica en el LNC es el factor pronóstico más importante para la sobrevivencia de los pacientes, por lo tanto la extirpación selectiva del LNC se considera una alternativa válida frente a la linfadenectomía regional completa, con el beneficio de eliminar las complicaciones asociadas a la disección ganglionar13, 15.
El tratamiento de micro metástasis de melanoma es controvertido. Algunos recomiendan realizar vaciamiento ganglionar regional, para definir el pronóstico y retardar la aparición de metástasis11,16; otros,17,18 señalan que no hay un beneficio en la sobrevida de los pacientes cuando aquellos linfonodos se extirpan. Finalmente, otros, señalan que no hay suficiente información para afirmar que la biopsia
del LNC represente beneficio terapéutico para los portadores de melanoma18,19. Basados en la primera opción hemos desarrollado este estudio preliminar y, más adelante, luego de reunir un número importante de pacientes, evaluaremos el beneficio terapéutico.
La identificación por radioisótopos permite ubicar más rápida y confiablemente el LNC. La localización del LNC marcado con Tc99 se obtiene a través de la relación de conteo radiactivo del paciente y del sitio en que se ubica el linfonodo, definiendo como sitio blanco aquel que tenga un conteo a lo menos 10% mayor que el conteo del huésped20. En este pequeño grupo de pacientes identificamos todos los LNC y la ubicación y biopsia correspondiente fue confirmada con la inyección de azul de isosulfán en todos (valor predictivo positivo 100%).
El estudio de LNC con tinción convencional hematoxilina eosina, en mas de 1000 pacientes analizados entre 1992 y 1999 ha permitido identificar 11% de portadores de micro metástasis13, con un 12% de falsos negativos21. El estudio complementario con inmuno-histoquímica (S100, HMB45 y Melan A), ha elevado la identificación de micro metástasis hasta 17%, lo que ha mejorado la seguridad en el diagnóstico de la enfermedad metastásica en valores que fluctúan entre 40 y 70%22. La proteína S100 es el marcador más sensible para melanoma con una expresión cercana al 100% de los casos. Por su parte, HMB 45 es el marcador más específico para melanoma23. Melan A posee una sensibilidad y especificidad intermedia a los anteriores. Por lo tanto, el uso de estas tres técnicas de inmunohistoquímica aseguran una pesquisa de verdaderos positivos de 100% de micro metástasis de melanoma. En nuestra experiencia, la incorporación de la técnica mejoró la sensibilidad del diagnóstico (verdaderos positivos dividido por verdaderos positivos más falsos negativos) de metástasis desde 40%, con H-E exclusiva (2 casos), a 60% (3 casos) con el uso de inmunohistoquímica.
En resumen, en esta serie de 6 casos la pesquisa del LNC con Tc99 y azul patente (azul de isosulfán) mejoró en 20% la capacidad de identificar a los pacientes con metástasis linfonodales que se presentan clínicamente con linfonodos normales. De acuerdo a nuestro protocolo, son sometidos a resección de los linfonodos, para retardar la aparición de metástasis. Además, evitó la cirugía de disección ganglionar regional en tres pacientes, con mejor calidad de vida para los enfermos y una liberación de horas operatorias para otros propósitos.
REFERENCIAS
1. Young D, Mathes S. Piel y tejido subcutáneo. En: Principios de Cirugía, Schwartz, Shires, Spencer; 2006, 8ª Ed Interamericana: 533-49
2. Bevona C, Sober A J. Melanoma incidence trends. Dermatol Clin 2002; 20: 589-95.
3. Jemal A, Thomas A, Murray T, Thun M. Cancer Statistics, 2002. CA Cancer J Clin 2002; 52: 23-47.
4. SEER. National Cancer Institute, USA, 2004; www.nih.gob
5. Morton DL, Wen DR, Wong JH, Economous JS, Cagle LA, Storm FK et al. Technical details of intraoperative lymphatic mapping for early state melanoma. Arch Surg 1992; 127: 392-9.
6. Liszkay G, Peley G, Sinkovics I, Peter I, Orosz Z, Fejos Z et al. Clinical significance of sentinel lymph node involvement in malignant melanoma. Pathol Oncol Res 2003; 9: 184-7.
7. Lowe JB, Hurst E, Moley JF, Cornelius LA. Sentinel lymph node biopsy in patients with thin melanoma. Arch Dermatol 2003; 139: 617-21.
8. Schmalbach C, Nussembaum B, Rees R, Schwartz J, Johnson TM, Bradford CR. Reliability of sentinel lymph node mapping with biopsy for head and neck cutaneous melanoma. Arch Otolaryngol Head Neck Surg 2003; 129: 61-5.
9. McMasters K, Chao C, Wong S, Wrightson WR, Ross MI, Reintgen DS et al. Interval sentinel lymph node in melanoma. Arch Surg 2002; 137: 543-9.
10. Iribarren O, Sepúlveda M, Hidalgo J, Madariaga J. Estudio epidemiológico de melanoma en la IV Región. Cuad Cir 2005: 19: 33-8.
11. Mc Masters K. Sentinel lymph node biopsy and adjuvant therapy for melanoma. Arch Dermatol 2003; 139: 99.
12. Statius Muller M, Leeuwen PA, Van Diest PJ, Vuylsteke RJ, Pijpers R, Meijer S. No indication for performing sentinel node biopsy in melanoma patients with a Breslow thickness of less than 0.9 mm. Melanoma Res 2001; 11: 303-7.
13. Treseler P, Tauchi P. Pathologic Analysis of the sentinel lymph node. Surg Clin North Am 2000; 80: 1695-716.
14. Cochran AJ. Melanoma metastases through the lymphatic system. Surg Clin North Am 2000; 80: 1683-93.
15. Carling T, Pan D, Ariyan S, Narayan D, Truini C. Diagnosis and treatment of interval sentinel lymph nodes in patients with cutaneous melanoma. Plast Reconst Surg 2007; 119: 907-13.
16. Cserni G. Pathological evaluation of sentinel lymph nodes. Surg Oncol Clin North Am 2007; 16: 17-34.
17. Medalie N, Ackerman B. Sentinel lymph node biopsy has no benefit for patients with primary cutaneous melanoma metástasis to a lymph node: an assertion based on comprehensive, critical analysis. Am J Dermatopathol 2003; 25: 473-84.
18. Wagner JD, Corbett L, Park H. Sentinel lymph node biopsy for melanoma: experience with 234 consecutive procedures. Plast Reconst Surg 2000; 105: 1956-66.
19. Clary BM, Brady MS, Lewis JJ, Coit DG. Sentinel lymph node biopsy in the management of patients with cutaneous melanoma: review of a large single institutional experience with emphasis on recurrence. Ann Surg D2001; 233: 250-8.
20. Jacobs I, Chang C, Das Guptas T K, Salti G. High isotope counts and sentinel node positivity in patients with melanoma. Arch Surg 2003; 138: 63-7.
21. González S. Estudio de linfonodo centinela en melanoma cutáneo. Bol Soc Chil Anat Patol 2005; 20: 5-7.
22. Duprat J, Silva D, Coimbra F, Lima IA, Lima EN, Almeida OM et al: Sentinel lymph node biopsy in cutaneous melanoma: Analysis of 240 consecutive cases. Plast Reconst Surg 2005; 115: 1944-51.
23. Blessing K, Sanders DS, Grant JJ. Comparison of inmunohistochemical staining of the novel antibody melan A with S100 protein and HMB45 in malignant melanoma. Histopathology 1998; 32: 139-46.