Cuad. Cir. 2009; 23: 19-23
DOI: 10.4206/cuad.cir.2009.v23n1-04
TRABAJO DE INVESTIGACIÓN
Evaluación de la morbimortalidad precoz de la quimiorradioterapia adyuvante en una serie de pacientes tratados por cáncer gástrico
Francisco Venturelli M 1, Claudia Pison D 2,5, Carlos Cárcamo I 1,3, Marcela Cárcamo I 4, Orlando Felmer E 1, Yaniro Guillen C 5, Diana Sosa F 5, Claudio Missarelli P 5, Bernardita Cardemil J 5, Aliro Venturelli L 1,3, Pablo Bórquez M 6
1
Instituto de Cirugía. Facultad de Medicina. Universidad Austral de Chile.
2 Servicio de Medicina Interna. Hospital Clínico
Regional Valdivia.
3 Servicio de Cirugía. Hospital Clínico Regional
Valdivia.
4 Magíster en Epidemiología Clínica.
5 Servicio de Oncología. Hospital Clínico Regional
Valdivia.
6 Servicio de Cirugía. Hospital Base de Osorno.
Correspondencia a: Dr. Francisco Venturelli M. icoventurelli@gmail.com.
RESUMEN
Desde el año 2005, en el Hospital Clínico Regional Valdivia (HCRV), la terapia adyuvante para el cáncer gástrico es la quimiorradioterapia (QtRt). El objetivo del trabajo es describir las reacciones adversas de los pacientes con diagnóstico de Cáncer Gástrico sometidos a QtRt adyuvante en el HCRV. Se trata de un estudio descriptivo, de pacientes sometidos a QtRt (con 5FU+leucovorina+radioterapia con acelerador lineal al lecho gástrico) que fueron a gastrectomía en el HCRV, entre enero 2005 y diciembre 2006. No se incluyeron pacientes con cáncer gástrico incipiente, ni los con invasión a estructuras vecinas ni metástasis a distancia. La información se recopiló a partir de 2 registros prospectivos de pacientes de nuestro hospital y de la revisión de fichas clínicas. Algunas de las variables registradas fueron: edad, sexo, clasificación según TNM, toxicidad hematológica, gastrointestinales y mortalidad. El análisis de las variables se realizó mediante el Software STATA 9.0. La serie se compone de 37 pacientes, con edad promedio de 59 años y predominantemente de sexo masculino con un 70,3%. A 28 (75,68%) se les practicó una gastrectomía total; 30 pacientes (81,08%) fueron clasificados como T3 y 8 (21,62%) como N3. El promedio de linfonodos resecados fue 34. Treinta pacientes (80%) presentaron toxicidad gastrointestinal y 23 (62,61%) hematológica. Sólo un paciente (2,7%) no presentó algún grado de toxicidad. Todos los pacientes etapificados como T3N3 presentaron toxicidad. No hubo mortalidad. En esta serie, la QtRt adyuvante para el tratamiento del cáncer gástrico en el HCRV es una terapia que conlleva un alto porcentaje de reacciones adversas de diversa magnitud.
Palabras claves: cáncer gástrico; terapia adyuvante; quimioterapia.
Key words: gastric cancer; adjuvant therapy; chemotherapy.
INTRODUCCIÓN
En el año 2002 el cáncer gástrico representó casi un millón de casos nuevos. A nivel mundial Chile junto a Japón, Costa Rica y Singapur son los países con una alta frecuencia de esta enfermedad1,2,3. Evidentemente esta situación constituye un problema de salud pública, especialmente en Chile.
Existen estudios que demuestran que el lograr una resección oncológica R0 se comporta como un factor pronóstico protector independiente4,5,6,7. Esto no es posible siempre, por lo que entre un 40 a un 70% de los pacientes recaen tanto localmente como a distancia tras ser operados3,8,9. Por este motivo, se plantea la necesidad de un tratamiento adyuvante que permita disminuir estas tasas de recurrencia y así lograr una mayor sobrevida10,11.
Uno de los protocolos más empleados en la adyuvancia de pacientes operados por cáncer gástrico es el protocolo de McDonald y cols.11 Aunque éste es aceptado en muchos hospitales, ha generado críticas debido a razones metodológicas que no obstante no impiden su aplicación en nuestro medio12. Desde el año 2005, en nuestro centro los pacientes que cumplen con los criterios de inclusión van a quimiorradioterapia (QtRt), sin embargo, no hemos evaluado ni su sobrevida ni la morbimortalidad asociada a la terapia. Analizando la literatura sobre las reacciones adversas de la QtRt en cáncer gástrico y en gran parte de los trabajos, no la incluyen dentro de sus resultados3,11, por lo que la morbilidad asociada al esquema pudiera estar subestimada.
El objetivo principal de este estudio es describir la morbimortalidad precoz de los pacientes con cáncer gástrico operados en el Hospital Clínico Regional de Valdivia (HCRV) que fueron sometidos a QtRt adyuvante entre los años 2005-2006.
MATERIAL Y MÉTODOS
Se trata de una serie de casos con seguimiento de 18 semanas desde el inicio de la adyuvancia, y reclutados entre Enero de 2005 y Diciembre de 2006. Los criterios de inclusión corresponden a pacientes portadores de Cáncer Gástrico (T3 N(+)M0) sometidos a cirugía resectiva con intención “curativa” operados en el Servicio de Cirugía del HCRV y que recibieron QtRt adyuvante. Se excluyeron pacientes con Cáncer Gástrico incipiente e intermedios (T1-2N(-)) y aquellos con compromiso de órganos vecinos y/o metástasis a distancia(T4 M0).
La QtRt consistió en 5FU 425 mg/m2 + leucovorina 20 mg/m2 en semanas 1 y 5 concomitante con Radioterapia 45 Gy/1.8 Gy por día en 25 sesiones, a continuación se realizó una quimioterapia de consolidación con 5FU 425 mg/m2 + leucovorina 20 mg/m2 en días 1 y 28.
Los criterios de toxicidad se clasificaron según criterios de la OMS.
En una base de datos se registraron variables como edad, sexo, tipo de gastrectomía, número de linfonodos resecados, tipo histológico y grado de diferenciación y estadio de la enfermedad (TNM). La morbilidad se midió evaluando la toxicidad hematológica, gastrointestinal y los tiempos de protracción debido a QtRt. Se consideró como mortalidad asociada a la terapia adyuvante a todo paciente fallecido por causa atribuible a ella, durante la realización del esquema o antes de los 30 días posterior al término del tratamiento. Para el análisis del cálculo de frecuencias y porcentajes se utilizó el programa estadístico Stata 9.0
RESULTADOS
La serie se compone de 37 pacientes. Su edad promedio fue de 59 años (DS: ± 10,18), 26 de los cuales eran de sexo masculino (70,27%). Se realizó gastrectomía total en 28 casos (75,67%) y una gastrectomía subtotal en 8 (24,32%). La mediana de linfonodos resecados fue 27 (15-112) por paciente.
Respecto de la histología, el 100% de los casos correspondió a adenocarcinoma, en 22 (59,45%) se clasificaron como tubular, en 6 se clasificó como tubulopapilar (16,21%), en 5 (13,51%) no se describió el subtipo y en 4 casos (10,81%) se consideró como de células en anillo de sello. Más de la mitad de los casos se describen como mal diferenciado (20 casos, 54,05%), lo siguió el moderadamente diferenciado con 13 (35,13%) y el bien y mal diferenciado con 2 (5,40%) casos cada uno. Según la clasificación TNM 8 (21,62%) pacientes fueron estadio II, 11 (29,72%) IIIA, 10 (27,02%) IIIB y 8 (21,62%) estadio IV.
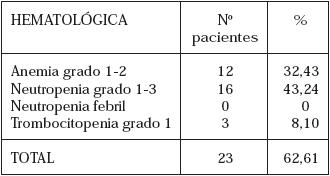
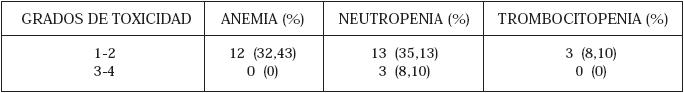
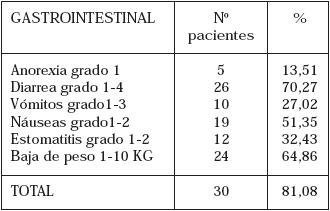
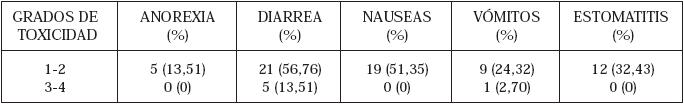
La toxicidad hematológica se presentó en 23 casos (62,61%) (Tabla 1 y 2). Dos pacientes requirieron Factor Estimulante de Colonias para continuar tratamiento. Cuatro pacientes presentaron protracción del tratamiento adyuvante (10,81%) debido a toxicidad hematológica en 2 casos (anemia y neutropenia) y gastrointestinales también en 2 casos (diarrea). La morbilidad gastrointestinal se presentó en 30 pacientes (81,08%) (Tabla 3 y 4). Sólo un paciente (2,70%) estuvo exento de algún tipo de toxicidad. No se presentó mortalidad durante el seguimiento.
 |
 |
 |
 |
Finalmente, siete pacientes (18,9%) no completaron la etapa de consolidación, en 2 casos (28,57%) fue por progresión de la enfermedad, en 3 (42,85%) casos por decisión del paciente y en 2 (28,57%) casos por disfunción miocárdica uno y por compromiso del estado general otro).
DISCUSIÓN
No cabe duda que existe una base racional, que explica la necesidad del tratamiento adyuvante en el cáncer gástrico9, dada por la alta posibilidad de recurrencia y la mortalidad a 5 años. En el año 2006, Cunningham13 publicó un estudio donde demostró claramente que el cáncer gástrico es quimiosensible. Sin embargo, hay al menos tres meta-análisis que evalúan terapias coadyuvantes en cáncer gástrico que demuestran que la efectividad de esta terapia es sumamente baja o nula14,15,16.
El respaldo para el tratamiento adyuvante con quimioterapia y radioterapia en el cáncer gástrico, procede de los resultados del trabajo publicado por McDonald et al11. En su estudio, los pacientes fueron randomizados a recibir tratamiento único con cirugía frente a la administración posterior de tratamiento adyuvante, basado en quimioterapia con 5-fluoracilo y radioterapia. En este estudio el 36% de los pacientes del grupo que fue tratado con quimiorradioterapia adyuvante no completó el esquema previsto, porcentaje que es más alto que el nuestro. Más del 40% de los pacientes presentaron toxicidad grado 3 ó 4 y 3 (1%) pacientes fallecieron11. Hay varios trabajos con respecto a este tema11,17,18,19, pero no señalan la totalidad de la morbimortalidad que esta terapia conlleva, concentrando sus resultados más en el aumento de la sobrevida, que en la calidad de vida de los enfermos, que con el tiempo se ha transformado también en un end point relevante para los estudios de terapia.
En este estudio se observó lo ya descrito por Kollmannsberger C20; que al incluir toxicidad grado 1 y 2, más del 90% de los pacientes presentan algún grado de toxicidad, lo cual es más del doble de lo publicado por Mc Donald11 (41%) y Park SH17 que sólo incluyeron los grados 3 y 4. Por este motivo creemos que nuestros resultados reflejan bastante la realidad acontecida.
Nos llama la atención la alta toxicidad que poseen los pacientes T3N3 (100%), lo cual nos lleva a replantearnos el real beneficio que se les está ofreciendo a este grupo de pacientes de mal pronóstico que verán muy deteriorada su calidad de vida. Si bien está demostrado que el cáncer gástrico responde a QtRt7,11,19,21, creemos que hay que poner en la balanza los reales costos que representa esta terapia para la calidad de vida de los enfermos y que pudieran haber estadios tumorales que tal vez no se beneficien del esquema. Queda pendiente también evaluar los resultados oncológicos de esta serie. Por último, por medio de este estudio, podríamos plantear que, la QtRt adyuvante del cáncer gástrico en el HCRV es una terapia que tiene una elevada morbilidad.
REFERENCIAS
1. Parkin D, Bray F, Ferlay J, Pisani P. Global Cancer Statistics 2002. CA Cancer J Clin 2005; 55: 74-108.
2. Parkin D, Bray F, Devesa S. Cancer burden in the year 2000. The global picture. Eur J Cancer 2001; 37 Suppl 8: S4-S66
3. Orditura M, Martinelli E, Galizia G, Vitiello F, Fasano M, Muto P, et al. Chemoradiotherapy as adjuvant treatment of gastric cancer. Ann Oncol 2007; 18 Suppl 6: 133-5.
4. Nazli o, Derici H, Tansug T, Yaman I, Bozdag A, Isgüder A, et al. Survival analysis after surgical treatment of gastric cancer: review of 121 cases. Hepatogastroenterology 2007; 54: 625-9.
5. Martin R, Jaques D, Brennan M, Karpeh M. Extended local resection for advanced gastric cancer: increased survival vs increased morbidity. Ann Surg 2002; 236: 159-65.
6. Martin R, Jaques D, Brennan M, Karpeh M. Achieving RO resection for locally advanced gastric cancer: is it worth the risk of multiorgan resection J Am Coll Surg 2002; 194: 568-77.
7. Carboni F, Lepiane P, Santoro R, Lorusso R, Mancini P, Sperduti I, et al. Extended multiorgan resection for T4 gastric carcinoma: 25-year experience. J Surg Oncol 2005; 90: 95-100.
8. Dahan l, Atlan D, Bouché O, Mitry E, Ries, P Artru P, et al. Postoperative chemoradiotherapy after surgical resection of gastric adenocarcinoma: can LV5FU2 reduce the toxic effects of the MacDonald regimen? A report on 23 patients. Gastroenterol Clin Biol 2005; 29: 11-5.
9. Foukakis t, Lundell L, Gubanski M, Lind P. Advances in the treatment of patients with gastric adenocarcinoma. Acta Oncol 2007; 46: 277-85.
10. Moertel C, Childs D, O’Fallon J, Holbrook M, Schutt A, Reitemeier R. Combined 5- fluoracil and radiation therapy as a surgical adjuvant for poor prognosis gastric carcinoma. J Clin Oncol 1984; 2: 1249-54.
11. McDonald J, Smalley S, Benedetti F, Hundahl S, Estes N, Stemmermann G, et al. Chemotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-30.
12. Manterola C, Torres R, Burgos I, Vial M, Pineda V. Calidad metodológica de un artículo de tratamiento de cáncer gástrico adoptado como protocolo por algunos hospitales chilenos. Rev Méd Chile 2006; 134: 920-6.
13. Cunningham D, Allum W, Stenning S, Thompson J, Van de Velde C, Nicolson M, et al. MAGIC Trial Participants Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20.
14. Hermans J, Bonenkamp J, Boon M, Bunt A, Ohyama S, Sasako M, et al. Adjuvant therapy after curative resection for gastric cancer: meta-analysis for randomized trial. J Clin Oncol 1993; 11: 1441-7.
15. Earle C, Maroun J. Adjuvant chemotherapy after curative resection for gastric cancer: revisiting a metaanalysis of randomized trials. Proc Am Soc Clin Oncol 1998; 17: 263a.
16. Hu J, Chen Z, Zhou Z, Zhang B, Tian J, Chen J, et al. Intravenous chemotherapy for resected gastric cancer: meta-analysis of randomized controlled trials. World J Gastroenterol 2002; 8:1023-8.
17. Park S, Kim D, Heo J, Lim D, Park C, Lee K, et al. Postoperative chemoradiotherapy for gastric cancer. Ann Oncol 2003; 14: 1373-7.
18. Ajani J, Mansfield P, Crane C, Wu T, Lunagomez S, Lynch P, et al. Paclitaxel-based chemoradiotherapy in localized gastric carcinoma: degree of pathologic response and not clinical parameters dictated patient outcome. J Clin Oncol 2005; 23: 1237-44.
19. Baeza M, Giannini T, Rivera S, González P, González J, Vergara E, et al. Adjuvant radiochemotherapy in the treatment of completely resected, locally advanced gastric cancer. Int J Radiat Oncol Biol Phys. 2001; 50: 645-50.
20. Kollmannsberger C, Budach W, Stahl M, Schleucher N, Hehr T, Wilke H, et al. Adjuvant chemoradiation using 5-fluorouracil/folinic acid/cisplatin with or without paclitaxel and radiation in patients with completely resected high-risk gastric cancer: two cooperative phase II studies of the AIO/ARO/ACO. Ann Oncol 2005; 16: 1326-33.
21. Ajani J, Winter K, Okawara G, Donohue J, Pisters P, Crane C, et al. Phase II trial of preoperative chemoradiation in patients with localized gastric adenocarcinoma (RTOG 9904): quality of combined modality therapy and pathologic response. J Clin Oncol 2006 20; 24: 3953-8.