Cuad. Cir. 2009; 23: 24-27
DOI: 10.4206/cuad.cir.2009.v23n1-05
TRABAJO DE INVESTIGACIÓN
Segundos cánceres primarios
Katherine Burgos N 1, Paula Peña R 1, Manuel Valenzuela C 1, Pablo Bórquez M 2
1
Alumno de 5º Año de Medicina. Facultad de Medicina. Universidad Austral de Chile.
Campo Clínico Osorno.
2 Cirujano Oncólogo, Servicio de Cirugía, Hospital
Base de Osorno. Profesor Adjunto de Cirugía. Encargado Unidad de Investigación.
Facultad de Medicina. Universidad Austral de Chile. Campo Clínico Osorno.
Correspondencia a: Dr. Pablo Bórquez M. cir.oncologo@yahoo.es.
RESUMEN
Los Segundos Cánceres Primarios (SCP) pueden ocurrir con frecuencia. Según datos de la SEER (Surveillance, Epidemiology and End Results) pueden constituir hasta un 16% de la incidencia total de cáncer. Se reporta una serie de casos conformada por 11 pacientes (2 hombres y 9 mujeres) con edad promedio de 61 años. En esta serie se presentaron 3 casos de cánceres sincrónicos y 8 metacrónicos, con un intervalo entre ambos de 2 a 72 meses. Se analizan diversos aspectos del tema como la quimioprevención y los aspectos relacionados con los SCP asociados a terapias (quimioterapia y radioterapia). Se describen aspectos particulares de los pacientes fumadores que constituyen un grupo especial de riesgo, debido al tipo de carcinógeno al que se ven expuestos. Finalmente se revisa el concepto de cancerización de campo que los afecta mayoritariamente.
Palabras claves: segundo cáncer primario.
Key words: second primary cancers.
INTRODUCCIÓN
Warren y Gates definieron en 1932 que un Segundo Cáncer Primario (SCP) es aquel producido al menos con 2 cm de distancia al tumor primario, con al menos 5 años de diferencia en el tiempo entre uno y otro, que no debe ser una metástasis del primero y ambos deben tener confirmación histológica. Aunque la idea original se relacionaba con cánceres primarios de la cavidad oral y orofarínge, el concepto de los SCP se ha modificado y expandido a todo tipo de histologías, ubicaciones y relaciones temporales entre el primer y segundo cáncer primario, siendo hoy en día un concepto muy amplio.1 En la actualidad el término se emplea para hacer referencia a los cánceres ocurridos en sobrevivientes de cáncer, asociados a las propias terapias oncológicas o debido a la persistente exposición a factores de riesgo o carcinógenos como tabaco, alcohol, carcinógenos ambientales o a la presencia de alteraciones génicas o de la función inmune que se relacionan con la aparición de SCP, llegando a ser muy frecuentes, hasta un 16% de la incidencia total de cáncer según datos de la SEER (Surveillance, Epidemiology and End Results).2 Debido a la detección precoz del cáncer y a la mejora en las terapias oncológicas se ha producido una mayor sobrevida, por tanto, el riesgo de SCP se ha elevado,3 este hecho, sumado al envejecimiento de la población4, incrementa el número de pacientes sobrevivientes de cáncer, así la sobrevida a 5 años esperada para adultos tratados por cáncer es superior a un 62% y mejora año a año.5 Por todas estas razones los SCP constituyen un área creciente de interés en investigación, y nos pareció relevante presentar una serie de casos con pacientes portadores de SCP con la finalidad de realizar una revisión de este tema.
MATERIAL Y MÉTODO
Se presenta una serie de casos compuesta por 11 pacientes portadores de SCP tratados en el Hospital Base de Osorno. Para obtener la serie se revisaron 656 informes de biopsia de anatomía patológica realizados entre Enero de 2006 y Abril de 2009 informados por especialistas de la Unidad de Anatomía Patológica del Hospital Base de Osorno, además de los pacientes pesquisados en el Comité Oncológico del mismo centro entre Abril y Julio de 2009.
Se incluyen pacientes adultos portadores de 2 o más cánceres primarios, sin restricciones de edad ni sexo. En una planilla excel ad hoc se registran las principales variables biodemográficas y las relacionadas con la histología y ubicación topográfica del tumor.
RESULTADOS
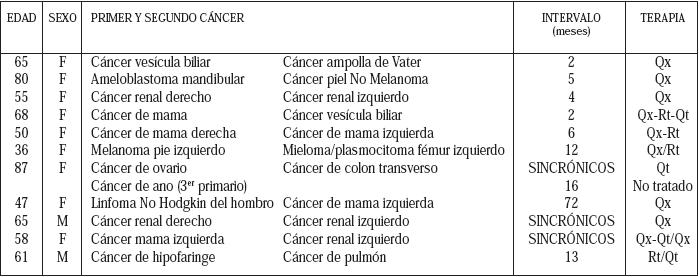
La serie se compone principalmente de pacientes de sexo femenino, con edad promedio de 61 años. En la tabla 1 se presenta un resumen de las principales características de la serie de casos.
 |
| Qx: Cirugía, Rt: Radioterapia, Qt: Quimioterapia |
DISCUSIÓN
Pese a las mejoras en el tratamiento y en el diagnóstico precoz, padecer de cáncer sigue siendo una experiencia devastadora para las personas. Sufrir de un SCP, sincrónico o metacrónico probablemente lo hace aún más dramático. No sólo afecta el estado de ánimo del paciente, que es un hecho clave en la adhesión a la terapia, sino también puede interferir en el esquema de tratamiento que se le ofrece al paciente, el cual muchas veces debe personalizarse. Así por ejemplo si un paciente con cáncer de próstata se trata con radioterapia no puede tratarse después con quimioradioterapia por un cáncer rectal debido a la dosis acumulada localmente. Algo similar ocurre cuando una mujer sufre un cáncer de mama bilateral metacrónico que es tratada con quimioterapia con antraciclinas, la cual tiene una dosis máxima acumulativa que puede ser administrada debido a toxicidad cardíaca. Lo más probable es que la dosis máxima casi se alcance con el primer tratamiento y el margen para tratar el segundo cáncer con dicha droga es pequeño y obliga a reducir las dosis o a usar una droga alternativa.
Está demostrado que el tener un cáncer puede predisponer a la aparición de un segundo cáncer primario, por tanto, de ser posible, la prevención es el mejor enfoque disponible.
Pese a lo evidente de este planteamiento uno de los aspectos menos estudiado respecto a los SCP es el tema de la quimioprevención, definida como el uso de drogas, agentes biológicos o nutrientes para inhibir, retrasar o revertir los procesos relacionados con el de carcinogénesis.
Un grupo especialmente interesante al respecto lo constituyen los pacientes fumadores, debido a que presentan una alta frecuencia de SCP, sin embargo sólo algunos estudios de prevención primaria de cáncer como el ATBC Lung Cancer realizado con Vitamina E o el Selenium and Vitamin E Chemoprevention Trial (SELECT)6,7 con Selenio(Se) y Vitamina E han logrado reunir información aceptable del punto de vista de la calidad de la evidencia. La principal conclusión a la que han llegado los autores es que los estudios para demostrar el efecto benéfico de la quimioprevención requieren de un tamaño de la muestra muy grande, que atenta contra la factibilidad de los mismos. Un buen estudio de quimioprevención lo da Clark y cols. en que desarrollaron el Nutricional Prevention of Cancer Study (NPCS). Los investigadores aportaron una dieta suplemantada en Se (200µgr/d) vs placebo en algo más de 1300 pacientes con el objetivo de reducir la incidencia de SCP de piel. El análisis interino demostró entre otros una reducción de la incidencia de cáncer pulmonar de un 46%, de cáncer colorrectal en un 48% y de cáncer prostático de un 63%.8 No obstante, recientemente se han reportado resultados no concordantes, en el sentido de que no habría una reducción real del riesgo de cáncer debido a que la población suplementada tenía niveles normales de Selenio.9 Hoy en día es un área de creciente interés para numerosos investigadores.
Otro ejemplo de quimioprevención de un SCP lo proporciona el uso de tamoxifeno. En cáncer de mama se demostró que el uso de tamoxifeno reduce la incidencia de un SCP contralateral en un 13%, 26% y un 47% al ser usado por 1, 2 y 5 años, respectivamente. Anastrazole, un inhibidor de la aromatasa sería incluso más efectivo que tamoxifeno en este mismo aspecto.2
Debido al corto período de tiempo estudiado, en nuestra serie de casos no se presentaron SCP derivados de tratamientos previos con radioterapia y quimioterapia. A inicios de la década del 70´, Kyle y cols. describieron la primera asociación entre leucemia y el efecto carcinógeno de un tratamiento oncológico previo10, sin embargo, el efecto carcinógeno de las radiaciones ionizantes se conoce desde hace muchos años basados en estudios de exposiciones laborales a radiaciones, en sobrevivientes de la bomba atómica, en pacientes expuestos a radiaciones durante métodos de diagnóstico y por estudios de pacientes irradiados por enfermedades benignas y malignas. El riesgo relativo (RR) de sufrir una leucemia post radioterapia es de 2, siendo máximo entre los 5 y 9 años por irradiación para luego ir disminuyendo lentamente. El riesgo depende de la dosis administrada y la cantidad de médula ósea expuesta. Esto se vio en pacientes tratados con radioterapia usada en el manejo de Linfoma No Hodgkin (LNH) o en pacientes irradiados por cáncer testicular. Los SCP que se produjeron en estos casos fueron Leucemia Mieloide Aguda, Leucemia Mieloide Crónica y Leucemia Linfoblástica Aguda.11 La radioterapia también puede inducir la aparición de SCP sólidos. Los órganos especialmente sensibles al efecto carcinogénico de la radioterapia son la mama y el tiroides. A diferencia de las leucemias inducidas por radioterapia el período de latencia es superior a los 10 años. A modo de ejemplo el cáncer de mama es el tumor sólido más frecuente en mujeres sobrevivientes de LNH irradiadas, especialmente en menores de 30 años. Con la reducción de los campos y del uso de radioterapia en linfoma habría una reducción del riesgo de este cáncer, así como las mejoras en la tecnología como la radioterapia de intensidad modulada (IMRT) seguramente van a traer aparejadas una reducción de los SCP asociados a radiación.11
También después de un tratamiento con quimioterapia pueden ocurrir SCP. Las leucemias ocurridas posteriores a la quimioterapia por linfoma se encuentran entre las más conocidas. La quimioterapia con procarbazina, vincristina y prednisona se asocian a un alto riesgo (de 3,5 a 24 veces) de SCP de tipo leucemia, dependiendo de la dosis acumulativa y del número de ciclos, de este modo el riesgo acumulativo es de 3,4 a 9,5% al cabo de 15 años de seguimiento. Otros esquemas usados como el ADVD (doxorrubicina, bleomicina, vinblastina y dacarbazina) es bastante menor, llegando a un incremento del riesgo de SCP de 1,3%.11
Un área de particular interés lo constituyen los pacientes portadores de cáncer de cabeza y cuello, que sufren de SCP hasta en una tasa de 7% de los casos por año, de hecho, uno de los principales objetivos del seguimiento de estos pacientes es su diagnóstico y tratamiento precoz. En este grupo de pacientes, aparentemente factores relacionados con el tratamiento no influyen tanto en su aparición. Los factores directamente relacionados con su elevada frecuencia tienen que ver más con la exposición a factores de riesgo, carcinógenos (“cancerización de campo”) y a factores genéticos. Algunos hechos importantes a considerar son los siguientes:
- El cáncer de pulmón se presenta como SCP en hasta un 15% de los casos de cáncer de laringe durante el período de seguimiento. Esta situación ocurrió con uno de nuestros pacientes de la serie de casos.
- El cáncer de esófago es frecuente después de un cáncer faríngeo. Ambos se relacionan con el uso de alcohol y tabaco, habiendo una relación dosis dependiente entre la cantidad de sustancia consumida y el riesgo de cáncer.
- En pacientes con cáncer de cavidad nasal, senos paranasales y nasofaringe no habría un mayor riesgo de SCP (debido a otros factores de riesgo como Virus Ebstein Barr, Virus Papiloma Humano o carcinógenos ambientales).
- Dejar de fumar es la medida más eficaz de intervención para prevenir los SCP del territorio de cabeza y cuello.12
El concepto de cancerización de campo fue acuñado por Slaughter en 1953, para describir la existencia de carcinogenia generalizada en un epitelio en el cuál múltiples lesiones independientes pueden ocurrir. Los carcinógenos más frecuentes son el tabaco y el alcohol, que afectan difusamente al epitelio. Pese a todos los avances el proceso aún no está del todo claro cómo ocurre. Un carcinógeno podría inducir múltiples alteraciones genéticas diferentes en distintas células generando múltiples tumores por proliferación policlonal de ellas, o bien generando un clon de células anormales que se expanden lateralmente y reemplazan finalmente al epitelio normal, así se genera un área preneoplásica que dará origen a los SCP. Otros autores creen que durante la organogénesis, células alteradas serían susceptibles al efecto carcinógeno futuro y de este modo originarían un segundo tumor. Para el caso de los cánceres de cabeza y cuello se sabe que la mayoría de los SCP se derivan de células monoclonales de áreas preneoplásicas vecinas.13
En los pacientes de cáncer de cabeza y cuello se han descrito otras anormalidades genéticas que contribuyen a la aparición de SCP. Se han descrito polimorfismos genéticos de las enzimas que componen el citocromo P450, que metabolizan y detoxifican algunos carcinógenos derivados del tabaco, de esta forma hay también una susceptibilidad individual a la aparición de estas lesiones14, esta situación explicaría por ej. la aparición de SCP intraorales más agresivos en población más joven y sin el antecedente de tabaquismo.
REFERENCIAS
1. Braakhnis BJ, Tabor MP, Leemans CR, van der Waal J, Snow GB, Brakarhoff RH. Second primary tumours and field cancerization in oral and oropharyngeal cancer: molecular techniques provide new insights and definitions. Head Neck 2002; 24 (2): 198-206.
2. Mayne S, Cartmel B. Chemoprevention of second cancers. Cancer Epidemiol Biomarkers Prev 2006; 15(11): 2033-37.
3. Vogel V. Identifying and screening patients at risk of second cancers. Cancer Epidemiol Biomarkers Prev 2006; 15(11): 2027-32.
4. Bórquez P, Romero C. El paciente oncológico geriátrico. Rev Chil Cir 2007; 59(6): 467-71.
5. Asis N. Cancer Survivorship Research: Challenge and Opportunity. J Nutr 2002; 132: 3494-503.
6. Goodman GE. Prevention of lung cancer. Crit Rev Oncol Hematol 2000; 33(3): 187-97.
7. Klein EA, Lippman SM, Thompson IM, Goodman PJ, Albanes D, Taylor PR et al. The selenium and vitamin E cancer prevention trial. World J Urol. 2003; 21(1): 21-7.
8. Clark LC, Combs GF, Tumbull BW, Slate EH, Chalker DK, Chow J et al. Effects of Selenium Suplemantation for cancer prevention in patients with carcinoma of skin. A randomized controlled trial. Nutricional Prevention of Cancer Study Group. JAMA 1996; 276: 1957-67.
9. Lippman S, Klein E, Goodman P, Lucia MS, Thompson I, Ford L et al. Effect of Selenium and Vitamin E on risk of prostate cancer and other cancers. The Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA 2009; 301(1): 39-51.
10. Kyle RA, Pierra RV, Bayad ED. Múltiple myeloma and acute myelomonocitic leukemia. N Engl J Med 1970, 283: 1121-1125.
11. Travis LE. Epidemiology of Second Primary Cancers. Cancer Epidemiol Biomarkers Prev 2006; 15(11): 2020-2026.
12. Andrea K, Travis L. Second Primary Cancers: an overview. Hematol Oncol Clin N Am 2008; 22: 271-89.
13. Dakubo G, Jakupciak J, Birch-Machin M, Parr R. Clinical implications and utility of field cancerization. Cancer Cell Int 2007; 7: 2.
14. Nair U, Bartsch H. Metabolic polymorphisms as susceptibility markers for lung and oral cavity cancer. IARC Sci Publ 2001; 154: 271-90.