Cuad.
Cir. 2011; 25: 67-74
DOI: 10.4206/cuad.cir.2011.v25n1-10
ARTÍCULO DE ACTUALIZACIÓN
Clasificación molecular del cáncer de mama
Molecular Classification of breast cancer
Felipe Imigo G. 1, Edgardo Mansilla S. 2, Ignacio Delama G. 2, María Teresa Poblete S. 3, Carlos Fonfach Z. 4
1 Residente
Cirugía. Instituto de Cirugía. Universidad Austral de Chile.
2 Médico
General. Universidad Austral de Chile.
3 Médico Anátomo
Patólogo. Subdepartamento de Anatomía Patológica. Hospital
Base Valdivia. Instituto Anatomía, Histología y Patología.
Universidad Austral de Chile.
4 Cirujano
General. Subdepartamento de Cirugía. Hospital Base Valdivia. Instituto
de Cirugía. Universidad Austral de Chile. Correspondencia: Dr. Felipe
Imigo, felipeimigo@gmail.com.
RESUMEN
El cáncer de mama causa 1000 muertes al año en nuestro país, siendo la segunda causa de muerte por cáncer en la mujer. La base fundamental del tratamiento es la cirugía, la cual, según la evaluación de los caracteres clínicopatológicos puede complementarse con distintas terapias coadyuvantes (radioterapia, quimioterapia, hormonoterapia). Existe un grupo de pacientes en las que, a pesar de la terapia, la enfermedad presentará un curso ominoso, con recidiva precoz y pobre sobrevida libre de enfermedad y sobrevida total. Las razones de esta mala evolución permanecen sin explicaciones precisas que permitan plantear terapias adecuadas para estas pacientes. El estudio histopatológico de los tumores proporciona gran cuantía de información que permite predecir el comportamiento biológico del tumor. El desarrollo de las técnicas inmunohistoquímicas, a su vez, ha permitido develar caracteres tumorales que son factores pronósticos y predictivos. El avance de los estudios moleculares en cáncer, ha proporcionado argumentos para establecer subclasificaciones de importancia diagnóstica y terapéutica, las cuales están acercando a la práctica diaria la deseada posibilidad de una terapia personalizada para las pacientes de cáncer de mama. Dentro de estos factores se han identificado una serie de alteraciones génicas que explicarían en parte algunos casos de mal pronóstico. En el presente artículo se presenta la clasificación molecular del cáncer de mama, haciendo énfasis en la descripción de los diferentes subtipos desde el punto de vista histopatológico y clínico.
Palabras claves: cáncer de mama, clasificación molecular genómica.
ABSTRACT
Breast cancer causes 1000 deaths a year in our country, being the second leading cause of cancer death in women. The fundamental basis of treatment is surgery, which can be complemented with different adjuvant therapies (radiotherapy, chemotherapy, hormonal therapy). Exists a group of patients in whom, despite therapy, the disease presents an ominous course with early recurrence and poor disease-free survival and overall survival. The reasons for this poor outcome remain present precise explanations that enable appropriate therapies for these patients. Histopathological examination of tumors provides much information that can predict the biological behavior of tumor. The development of immunohistochemical techniques, in turn, has allowed to reveal tumor characteristics that are predictive and prognostic factors. The advancement of cancer molecular studies have provided arguments to establish subclassifications of diagnostic and therapeutic importance which are closer to the daily practice the desired possibility of personalized therapy for breast cancer patients. Among these factors have identified several genetic alterations that partly explain some por prognosis cases. In this paper we present the molecular classification of breast cancer, emphasizing the description of the different histopathology and clinical subtypes.
Key words: breast cancer, molecular classification genomic.
INTRODUCCIÓN
En nuestro país, en el año 2003 el cáncer de mama fue la segunda causa de muerte por cáncer en la mujer, especialmente en las mayores de 40 años, registrando una tasa de mortalidad a los 80 años de 143,4/100.000 mujeres, falleciendo anualmente alrededor de 1000 mujeres por esta causa1.
En los estadios tempranos del cáncer de mama, la cirugía es el tratamiento fundamental, y asociado a la radioterapia, pueden controlar la enfermedad en la gran mayoría de los casos. A pesar de esto, alrededor de un 30% de las pacientes finalmente fallecerá debido a la diseminación de la enfermedad. A fin de erradicar las micrometástasis y por consiguiente prolongar el tiempo de sobrevida, se desarrollaron las terapias coadyuvantes, tales como la hormonoterapia y la quimioterapia. La decisión sobre qué pacientes deben recibir estos tratamiento se establece considerando criterios clínico-patológicos básicos, como la edad, tamaño del tumor, tipo y grado histológico, compromiso ganglionar axilar, expresión de receptores de estrógeno y progesterona, y del receptor HER2, sin embargo, estos criterios en algunos grupos de pacientes, y muy particularmente en las pacientes sin compromiso ganglionar axilar, no son buenos indicadores pronósticos o de recidiva.
Considerando estos antecedentes, se han desarrollado líneas de investigación molecular a fin de estudiar la expresión génica de estos tumores y así determinar de forma más precisa qué pacientes tienen más riesgo de presentar recidiva/recurrencia, y por lo tanto deben recibir terapia coadyuvante. Del mismo modo, es importante determinar qué tipo de pacientes tienen bajo riesgo de desarrollar una enfermedad metastásica y estarían, por lo tanto, sobretratados al recibir terapia adyuvante. La adecuada clasificación de estos pacientes les evitaría las complicaciones derivadas de la toxicidad de estos tratamientos y de forma secundaria disminuiría en forma importante los costos del tratamiento2,3.
BASES MOLECULARES
Existen múltiples formas para determinar expresión génica, siendo la utilización de cDNA microarray el método de mayor difusión. Este procedimiento se basa en la hibridación de moléculas de DNA complementario (cDNA), preparadas a partir de RNA aislado del tejido tumoral, a secuencias del genoma humano impresas en un soporte sólido (láminas de vidrio o membranas de nitrocelulosa). A fin de reconocer qué genes se están expresando en el tumor, el cDNA es marcado con una molécula fluorescente, la cual es posteriormente detectada a través de un láser según la longitud de onda determinada para tal efecto4 (Figura 1).
CLASIFICACIÓN MOLECULAR
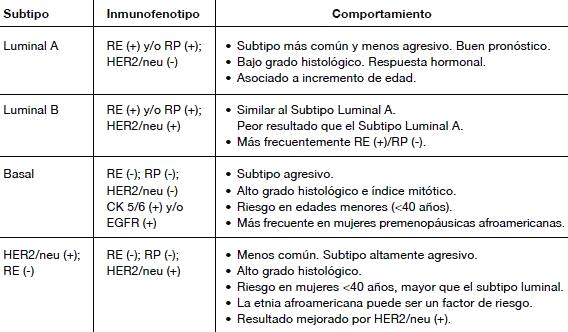
La contribución fundamental de los microarreglos de cDNA al estudio del cáncer de mama ha sido develar la complejidad de los tipos histológicos tradicionales, como asimismo contribuir a las hipótesis que plantean que el cáncer mamario no es una simple enfermedad derivada de un único progenitor. Los estudios preliminares de Perou y Sorlie basados en microarreglos identificaron cuatro subtipos principales de cáncer mamario: i) Luminal; ii) Similar a basal; iii) Similar a normal y iv) HER2/ERBB2.
Esta taxonomía molecular se basó en la identificación de una lista de genes y la posterior agrupación jerárquica de éstos. Este procedimiento identifica subgrupos de tumores más homogéneos que presentan similar comportamiento clínico y sensibilidad a agentes terapéuticos. Sin embargo, hay variabilidad de respuesta terapéutica entre los tumores de un mismo grupo, por lo cual se ha planteado que diferentes tipos de cánceres mamarios están comandados por diferentes genes, lo cual ha dirigido la investigación hacia diversos oncogenes en busca de dianas terapéuticas específicas.
FIGURA 1: Método
de obtención de las firmas moleculares. |
El año 2002 Van´t Veer y col. realizaron un estudio de la predicción del perfil genético y sus resultados clínicos en el cáncer de mama, proponiendo este método para seleccionar pacientes que puedan beneficiarse con la quimioterapia6. Esta clasificación fue posteriormente modificada por Sorlie el año 20037. De acuerdo a los patrones de expresión génica, que se relacionan con el pronóstico o con el riesgo de metástasis, estos autores dividieron el cáncer de mama en 2 grandes grupos, basados en la positividad para el receptor de estrógeno: i) neoplasias de bajo grado, para aquellas que expresan receptores de estrógeno (RE) y progesterona (RP) y ii) neoplasias de alto grado que no presentan RE y RP, pero en las cuales hay sobre-expresión y/o amplificación de HER25 (Tabla 1).

|
TUMORES RECEPTOR ESTRÓGENO POSITIVO
Este grupo de tumores comprende los tumores luminales; los cuales poseen un patrón inmunofenotípico similar al componente epitelial luminal de la glándula mamaria. Expresan citoqueratinas luminales, receptores de estrógeno y los genes asociados a su activación (LIV1 y CCND1). Habitualmente son de bajo grado histológico y tienen mutación de p53 en menos del 20%.
Existen varios subtipos, sin embargo los más considerados por su frecuencia son el Luminal A y B. El subtipo Luminal A es el más frecuente, correspondiendo al 67% de los tumores, posee alta expresión de genes relacionados con los receptores hormonales y baja expresión de genes relacionados con la proliferación celular. A la inversa el subtipo Luminal B presenta niveles menores de receptores de estrógeno y altos niveles de genes de proliferación. Es necesario mencionar el subtipo Luminal HER2/neu, que se caracteriza además, por expresar citoqueratinas CK9 y CK10 (Figura 2).
FIGURA 2: Tipos
celulares y marcadores en la glándula mamaria. |
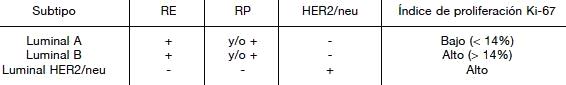
Algunos autores han intentado subtipificar los tumores mamarios utilizando paneles de inmunotinción, como una forma de acercar estos hallazgos a la práctica rutinaria de los laboratorios de patología. En este sentido, un aporte valioso al estudio de los tumores luminales ha sido publicado recientemente por Cheang y col el 2009, quienes probaron un panel de inmunotinción que consistió de cuatro marcadores, que establecen el estado de los receptores hormonales para estrógeno y progesterona, HER2/neu y el índice de proliferación determinado por la expresión de Ki-67, el cual corresponde a un antígeno nuclear presente en todas las células que se encuentran en la fase proliferativa del ciclo celular. Se estudió un número de 357 cánceres de mama con este panel, siendo posible discriminar entre los tumores Luminal A y Luminal B10.
Los tumores luminales fueron divididos en tres grupos: Luminal A (RE o RP positivos, HER2/neu negativo, y bajo índice de proliferación), Luminal B (RE o RP positivos, HER2/neu negativo e índice de proliferación alto), el tercer grupo fue denominado Luminal HER2/neu positivo. Se determinó que un punto de corte del Ki-67 de 14% o más podía discriminar entre los subtipos Luminal A y B (Tabla 2).
La importancia pronóstica de la subtipificación previa fue testeada por los mismos autores en una serie de 4046 casos de cáncer mamario, analizados con microarreglos de tejidos. Al compararlos con el subtipo Luminal A, tanto el Luminal B como el Luminal HER2/neu, estuvieron asociados con mala sobrevida libre de enfermedad y menor sobrevida total en presencia o ausencia de terapia con tamoxifeno y/o quimioterapia.
Los tipos A y B son de buen pronóstico, pero el tipo B tiene un peor pronóstico que el A, debido a variaciones en la respuesta al tratamiento, pues expresan menor cantidad de RE. No obstante, ambos se tratan con hormonoterapia7.
Se ha descrito que los tumores RE positivo tienen menor respuesta a la quimioterapia comparado con los que carecen de estos receptores11. Los tumores luminales tienen un 6% de respuesta completa a quimioterapia preoperatoria, basada en paclitaxel seguida de 5-fluoracilo, doxorrubicina y ciclosfosfamida en comparación a 45% en los subtipos basal y HER2/neu12.
|
TUMORES RECEPTOR ESTROGENO NEGATIVO
Existen dos grandes grupos: El subtipo basal y el subtipo con sobre-expresión de HER2/neu.
Subtipo basal
El subtipo basal/mioepitelial, se describió originalmente por su patrón de expresión inmunohistoquímico, al comprobarse que expresan citoqueratinas de alto peso molecular en sus células mioepiteliales (Figura 2). Corresponde entre el 2 al 18% del total de los cánceres de mama. Fue reconocido como triple negativo por ser RE negativo, RP negativo y HER2/neu negativo. Es un subgrupo que expresa genes asociados a células mioepiteliales cuyo inmunofenotipo corresponde a CK5, CK17, c-kit (una tirosina quinasa del epitelio mamario), factores de crecimiento de hepatocito e insulina, calponina 1, caveolina y laminina. Los datos clínicos actuales muestran que es el subtipo más agresivo, cuya sobrevida total y libre de enfermedad es baja, debido a que las terapias endocrinas y con trastuzumab son ineficaces en este grupo de tumores15.
En estos tumores hay además alteraciones de genes reparadores del DNA. El promotor de BRCA1 está metilado, lo cual ocasiona un silenciamiento de la expresión génica, también inactivación transcripcional de BRCA1 o ambos. El 80% de las mujeres que nacen con mutaciones de inicio temprano en BRCA1 tienen el subtipo basal, aunque estos casos corresponden a un pequeño porcentaje del total de tumores de subtipo basal, ya que la mayoría son de tipo esporádico. Además, la estructura génica de BRCA1 y su producto transcripcional están aparentemente intactos15,16.
Los estudios basados en poblaciones demuestran que el subtipo basal se desarrolla con mayor frecuencia en mujeres afroamericanas y en la premenopausia. La hormonoterapia y el trastuzumab no tienen aplicación en estos tumores y además, la utilidad de la quimioterapia no está del todo clara17.
Nielsen y col. estudiaron dos grupos: i) Fenotipo triple negativo RE, RP y HER2/neu (-) y ii) Fenotipo basal RE, RP y HER2/neu (-) EGFR (+) y/o CK 5/6 (+). Aquellos tumores que sobre-expresan EGFR pueden beneficiarse del uso de terapias desarrolladas recientemente, tales como inhibidores de tirosina quinasa (gefitinib, eclotinib) y anticuerpos monoclonales (cetuximab). Los inhibidores de la actividad tirosina quinasa del EGFR no son agentes quimioterápicos, ya que no destruyen a las células tumorales, pero sí bloquean la activación del EGFR y consecuentemente las vías de señalización activadas con la estimulación de este receptor.
Subtipo de sobre-expresión de HER2/neu
Este subtipo corresponde entre el 10 a 15% de los cánceres de mama y sobre-expresa genes ubicados en el cromosoma 17q. Incluyen el gen del EGFR-2 (ERBB2) y el growth factor receptor bound protein 7 (GRB7), además de sobre-expresar genes de proliferación y presentar escasos genes asociados al fenotipo luminal. El ERBB2 es un proto-oncogen que cuando está sobre-expresado (amplificado), se asocia con caracteres histopatológicos asociados a mal pronóstico un alto grado histológico, baja expresión de RE y R P, además de mala respuesta a terapia. Este subtipo corresponde a la mitad de los cánceres de mama que son HER2/neu positivos10.
Este subtipo es particularmente resistente a la terapia hormonal, debido a la ausencia de receptores hormonales. En cambio los tratamientos basados en el anticuerpo monoclonal recombinante (Trastuzumab/Herceptin) producen una mejoría significativa en los pacientes. La amplificación de ERBB2 y la sobre-expresión de su proteína HER2/neu puede ser evaluada con precisión mediante FISH o inmunohistoquímica. Los nuevos protocolos definen como negativo la tinción 0 ó 1+ y positivo 3+, requiriendo confirmación de la amplificación por FISH a los casos 2+. El silenciamiento génico por metilación parece estar disminuida en este subtipo de tumores respecto a los luminales18.
PERSPECTIVAS Y APLICACIONES DE LOS ESTUDIOS MOLECULARES
Como se ha descrito, los estudios que utilizan perfiles de expresión génica buscan definir patrones que permitan predecir la evolución clínica que tendrán grupos de pacientes muy bien definidos. La enorme cantidad de datos que generan estos estudios deben ser evaluados con modelos matemáticos y estadísticos, para determinar aquellos grupos de genes que discriminan entre los diversos parámetros que se requiere medir.
Hasta el momento dos grandes estudios han abordado interrogantes de importancia pronóstica, éstas fueron recurrencia y sobrevida en pacientes tratadas con cirugía y sin metástasis axilares. Uno de ellos, del Instituto del Cáncer de Holanda, trabajó con un grupo de 98 pacientes menores de 55 años, sin metástasis axilares. Este grupo se separó posteriormente entre las que experimentaron recidiva antes de 5 años (34 pacientes) y las que estaban sin enfermedad a los 5 años o más (44 pacientes). El estudio inicial dirigió la observación hacia 25.000 genes y un sistema de clasificación supervisada, pudo identificar 70 genes que se correlacionan en forma independiente con mal pronóstico. Posteriormente, el valor pronóstico de la firma molecular de 70 genes fue probado en un estudio de validación en 295 pacientes, algunos de los cuales tenían metástasis axilares. Los pacientes que tenían una firma genética relacionada con un buen pronóstico, tuvieron menos del 15% de recidiva en 10 años y aquellos pacientes que presentaron genes tumorales asociados a mal pronóstico, tuvieron un 50% de riesgo de metástasis a distancia. La limitante de la técnica utilizada para efectos prácticos es que requiere tejido fresco o congelado rápidamente, con el objeto de disponer de RNA de alta calidad.
Los excelentes resultados de estos estudios han permitido desarrollar un gran ensayo clínico en Europa llamado MINDACT (The Microarray in Node Negative Disease May Avoid Chemotherapy) MammoPrint, Agendia (Figura 3). En este estudio se randomizará 5000 pacientes con tratamientos que se dictarán según sus respectivos perfiles génicos y factores pronóstico tradicionales. Las conclusiones de este estudio, de seguro marcarán pautas en el manejo de las pacientes con cáncer mamario.19
FIGURA 3: Ensayos
clínicos y perfiles de expresión génica. MINDACT.
|
El segundo estudio, utiliza la técnica de la reacción en cadena de la polimerasa y se efectúa en tejidos fijados en formalina e incluidos en parafina. Pretende cuantificar la expresión de transcritos que tengan una importancia clínica potencial. Para esto se desarrolló una prueba validada de 21 genes (Oncotype DX). Este test cuantifica la expresión de 21 genes asociados al cáncer de mama (16 genes relacionados con cáncer y 5 genes de referencia). Se desarrolló un algoritmo basado en los niveles de expresión de éstos genes y que se usó para calcular un puntaje de recurrencia para cada caso. El puntaje de recurrencia varía entre 0 a 100 y se divide en tres grupos de riesgo: bajo (menor de 18), intermedio (18 a 31), y alto (mayor de 31). La diferencia en el riesgo de metástasis a distancia entre pacientes con un puntaje bajo y aquellos con un puntaje alto ha sido estadísticamente significativo en muchos estudios. También en este caso se ha desarrollado un gran ensayo clínico con el apoyo del National Cancer Institute, involucrando el Oncotype DX, cuyo nombre es TAILORx (Trial Assigning Individualized Options for Treatment) ha comenzado en Estados Unidos. Los pacientes se estratifican según su puntaje de recurrencia y se les asigna diferentes tratamientos. Aquellos con puntaje bajo tendrán terapia hormonal exclusiva, los pacientes con puntaje alto tendrán terapia hormonal y quimioterapia y aquellos con puntaje intermedio serán randomizados para recibir alguna de las dos opciones de tratamiento. De estos estudios prospectivos se espera resultados para el año 2013.
¿Están estas firmas de expresión génica, disponibles para ser usadas en nuestro medio? Actualmente, no están disponibles, pero pueden ser consultadas a distancia por medio de centros privados en Santiago. El Consenso de Mama (2009) recomienda los estudios moleculares por RT-PCR en cáncer precoz, para reconocer aquellos carcinomas de mayor riesgo, que son el tipo basal y HER2/neu positivo.20
CONCLUSIONES
La poderosa irrupción de las técnicas moleculares en el estudio del cáncer de mama, ha proporcionado sólidos argumentos para una clasificación del cáncer mamario en grupos definidos por sus patrones de expresión génica y cuyo comportamiento clínico y biológico sea predecible en los casos individuales, de forma de identificar con certeza aquellos casos que se beneficien de las diferentes terapias disponibles y también de las terapias en desarrollo que contemplan como dianas terapéuticas aquellas relacionadas con diferentes vías de señalización intracelular.
La implementación de estas técnicas en el estudio rutinario de los tumores, requerirá de un largo proceso de validación y estandarización y obviamente, disminución de los costos de procesamiento. Entretanto, los centros de investigación continúan activamente proporcionándonos una nueva y fascinante mirada al antiguo desafío de determinar cuándo el estudio de los factores pronóstico tradicionales no aporta mayores datos, cuáles pacientes de cáncer mamario desarrollarán metástasis a distancia y requieren por lo tanto de terapia adyuvante.
Tabla 3. Subtipos
de Cáncer de Mama determinados por perfiles de expresión
génica. Modificada
de Schnitt 200921. |
|
El análisis de los datos que aportarán los grandes estudios clínicos tomará tiempo en decantar en protocolos de tratamiento útiles en la práctica diaria. En nuestro medio, el manejo de los pacientes sigue dependiendo del estudio histopatológico acucioso de los factores pronósticos y predictivos tradicionales, siendo nuestra tarea más urgente la implementación de controles de calidad en todas las fases del proceso.
AGRADECIMIENTOS
Al Dr. Carlos Figueroa Valverde, quien amablemente ha aportado a nuestra revisión con el diseño de las figuras y revisión del texto.
REFERENCIAS
1. Ministerio de Salud. Guía clínica de cáncer de mama en personas de 15 años y más. 1st Ed. Santiago: Minsal, 2005.
2. Goldhirsch A, Glick JH, Gelber RD, Coates AS, Thürlimann B, Senn H. Panel members. Meeting shighlights: International expert consensos on the primary therapy of early breast cancer 2005. Ann Oncol 2005; 16: 1569-83.
3. Cleator S, Ashworth A. Molecular profiling of breast cancer: clinical implications. Br J Cancer 2004; 90: 1120-4.
4. Quackenbush J. Microarray analysis and tumor classification. N Engl J Med 2006; 354: 2463-72.
5. Poblete MT. Marcadores de utilidad en cáncer mamario. Cuad Cir 2001; 15: 74-9.
6. Van´t Veer LJ, Dai H, van de Vijver MJ, Yudong DH, Hart AA, Mao M et al. Gene exppresions profiling predicts clinical outcome of breast cancer. Nature 2002; 415: 530-36.
7. Sorlie T, Tibshirani R, Parker J, Hastie T, Marron JS, Nobel A et al. Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci USA 2003; 100: 8418-23.
8. Sotiriou C, Neo SY, McShane LM, Korn El, Long PM, Jazaeru A et al. Breast cancer classification and prognosis based on gene expression profiles from a population based study. Proc Natl Acad Sci USA 2003; 100: 10393-8.
9. Cheang MC, Chia SK, Voduc D, et al. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst 2009; 101: 736-50.
10. McCafferty M; Healy N; Kerin M. Breast cancer subtypes and molecular biomarkers. Diagnostic Histopathology 2009; 15(10): 485-9.
11. Ring AE, Smith IE, Ashley S, Fulford LG, Lakhani SR. Oestrogen receptor status, pathological complete response and prognosis in patients receiving neoadjuvant chemotherapy. Br J Cancer 2004; 91: 2012-7.
12. Rouzier R, Perou CM, Symmans WF, Ibrahim N, Cristofanilli M, Anderson K et al. Breast molecular subtypes respond differently to preoperative chemotherapy. Clin Cancer Res 2005; 11: 5678-85.
13. Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med 2004; 351: 2817-26.
14. Zepeda E; Recinos E; Cuéllar M; Robles D; Maafs E. Clasificación Molecular del Cáncer de Mama. Cir Ciruj 2008; 76: 87-93.
15. Soutiriou C. and Pusztai L. Gene-Expression Signatures in Breast Cancer. N Engl J Med 2009; 360: 790-800.
16. Foulkes WD; Stefansson IM; Chappuis PO; Begin LR; Goffin JR; Wong N et al. Germ line BRCA1 mutations and a basal epithelial phenotype in breast cancer. J Natl Cancer Inst 2003; 95(19): 1482-5.
17. Parker JS; Mullins M; Cheang MC; Leung S; Voduc D; Vickery T et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol 2009; 27(8): 1160-7.
18. Holm K., Hegardt C, Staaf J, Vallon-Christersson J, Jönsson G, Olsson H et al. Molecular subtypes of breast cancer are associated with characteristic DNA methylation patterns. Breast Cancer Research 2010, 12: R36.
19. Bogaerts J, Cardoso F, Buyse M et al. Gene signature evaluation as a prognostic tool: Challenges in the design of the MINDACT trial. Nat Clin Prac 2006; 3(10): 540-51.
20. Moyano L, Carreño L, Cornejo V, Espinoza A, Matamala P. Actualizaciones en el diagnóstico patológico en cáncer de mama. Consenso de mama Preinforme final 2009, 24.
21. Schnitt S. Classification and prognosis of invasive breast cancer: From morphology to molecular taxonomy, Breast Long Course. USCAP 2009, 261.